喜炎平注射液治疗社区获得性肺炎:1 项基于多准则决策分析的临床证据与价值评估研究
陈子佳,张 强,雷 超,王志飞,谢雁鸣
中国中医科学院 中医临床基础医学研究所,北京 100700
社区获得性肺炎( community-acquired pneumonia,CAP)是指在院外罹患的感染性肺实质炎症[1],其作为发病与死亡的重要原因之一,对社会产生了重大临床及经济影响。目前,虽然地理位置对各国CAP 有关的细菌病原体有所差异性影响[2],但主要仍以肺炎链球菌为主,同时发现,在CAP 患者中,约20%合并病毒感染[3],且多以呼吸道合胞病毒为主,此类患者往往提示病情较重,易演变为重症社区获得性肺炎。对于细菌病原体或者支原体所引发的社区获得性肺炎,抗感染治疗是核心环节[4]。调查显示,美国CAP 患者12 个月死亡率高达30.6%,且低收入国家的死亡率高于高收入国家,对社会经济与人民健康造成一定影响[5]。CAP 现如今面对高发病率与死亡率、住院时间长、治疗效果欠佳等问题,且给个人及医疗保障体系造成了沉重的经济负担。
喜炎平注射液有效成分穿心莲内酯总磺化物,是从中药穿心莲中提取的穿心莲乙素经独特的磺化工艺制成的注射剂,在解决了注射剂水溶性问题(未添加任何助溶剂)、减少不良反应、提高安全性的同时,增加了其抗炎解热的药理作用。其功能主治为清热解毒、止咳止痢。现代药理学研究显示其具有抗炎、退热、抗病毒等药理活性,临床上广泛用于支气管炎、扁桃体炎、社区获得性肺炎、细菌性痢疾等常见病、多发病治疗。有多项临床证据表明喜炎平注射液治疗成人及儿童社区获得性肺炎较单独使用莫西沙星、左氧氟沙星、头孢曲松等抗生素,显示出较好的临床疗效[6]。
多准则决策分析(multi-criteria level decision analysis model,MCDA)是一种综合评价方法,其以经济学、管理学、数学和心理学为基础,通过一系列方法对药品的综合价值进行排序,并将客观测量与主观判断综合考量,帮助决策者系统地考虑多种冲突,帮助评价不同准则的相关性、重要性以及如何利用已有信息来评价备选方案等方面达成共识,以提高决策的一致性、透明性和合理性,从而帮助决策者在多种准则中做出取舍,确定最佳选择[7]。为了充分评估喜炎平注射液治疗CAP 的临床价值,满足医患使用喜炎平注射液的用药需求,本研究利用MCDA 围绕喜炎平注射液治疗CAP,从安全性、有效性、经济性、创新性、适宜性、可及性、中医药特色“6+1”个维度其进行证据综合及价值评估,以期为临床合理用药提供参考和依据。
1 资料与方法
1.1 文献检索与资料来源
1.1.1 文献检索与筛选 为全面获得资料与相关文献,使用计算机检索中文数据库中国知网(CNKI)、万方(Wanfang)、维普(VIP)、中国生物医学文献服务系统(SinoMed);外文数据库包括EMbase、Web of Science、Medline、Cochrane Library及ClinicalTrials.gov。用主题+关键词法进行主题检索,主题词为“喜炎平注射液”,以“社区获得性肺炎”“CAP”“community-acquired pneumonia”等为关键词进行检索,同时检索学位论文、会议论文等灰色文献,时间从建库至2021 年6 月。将文献通过Endnote X9 进行整合去重,删除无关文献,根据安全性、有效性、经济性、创新性、适宜性、可及性、中医药特色进行分类汇总,构建相关数据集。
1.1.2 资料来源 安全性资料来自说明书、国家药品不良反应监测中心自发呈报系统(spontaneous reporting system,SRS)、主动监测、医院信息系统(hospital information system,HIS)数据安全性分析、不良反应病例报道;有效性资料来自随机对照试验(randomized controlled trial,RCT)、Meta 分析;经济性资料来自基于回顾性队列研究的经济学评价;创新性、适宜性、可及性资料来自问卷调查、米内网、药智网、国家知识产权局等;中医药特色资料来自对于药品的理论特色分析与该药品的人用经验。
1.2 评价方法
采用定性与定量相结合的评价方法,基于循证医学、流行病学、临床医学、临床药学、循证药学、药物经济学、卫生技术评估等方法学,通过调查问卷、公开资料、真实世界数据及文献二次评价内容等,对喜炎平注射液的安全性、有效性、经济性、创新性、适宜性、可及性、中医药特色“6+1”个维度构建评价体系。通过专家对准则层、指标层赋予权重,利用MCDA 对各维度进行度量,评价喜炎平注射液的临床综合价值。综合评价技术路线如图1 所示。
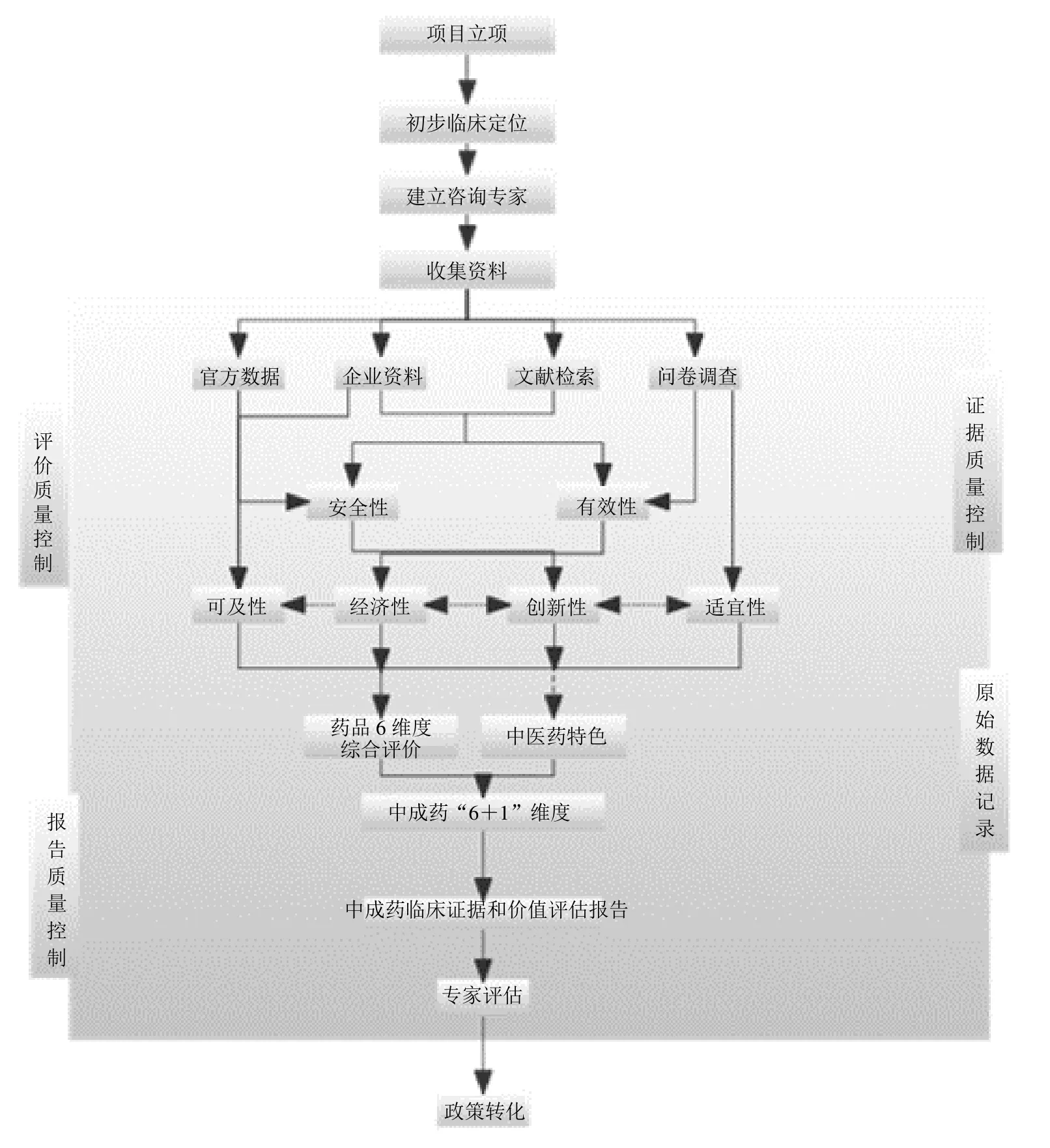
图1 喜炎平注射液综合评价技术路线Fig.1 Technical route for comprehensive evaluation of Xiyanping Injection
1.3 质量控制
从证据质量、评价和报告质量进行数据、程序、报告的严格把关与质量控制。按照国际公认的循证医学证据评价方法对证据质量进行严格评价;按照评价流程及评价方法的具体实施过程对评价与报告的质量进行严格控制。具体流程见图2。

图2 喜炎平注射液质量控制图Fig.2 Quality control diagram of Xiyanping Injection
2 药理与药学特性
2.1 药学成分及稳定性实验
喜炎平注射液是由穿心莲中提取出的高纯度(98%)单体穿心莲内酯进行磺化工艺得到的穿心莲内酯总磺化物(化合物发明专利,专利号:ZL200510038561.1)制得的中药注射剂。独特的磺化工艺使得穿心莲内酯总磺化物极易溶解、辅料仅为注射用水,制剂过程未添加任何助溶剂及辅料。
喜炎平注射液在高温、光照、酸、碱和氧化条件下均敏感,提示喜炎平注射液应合理储存,避免极端环境使用。与溶媒配伍时,为减少不良反应发生,应注意用药浓度与用药时间,建议使用控制在配液后4 h 内,与5%葡萄糖注射液配伍比例不宜超过20 mL∶250 mL,与0.9%氯化钠注射液配伍比例不宜超过16 mL∶250 mL。临床应严禁混合配伍,且应谨慎考虑药物联合应用之间的时间间隔,换药时冲洗输液管,以防止药物之间的混合与相互作用。推荐医院有条件的情况下,推荐优先使用二件式注射器。
2.2 药学质量评价
喜炎平注射液2002 年获得原国家食品药品监督管理总局注册批准(国药准字Z20026249)时,原辅料与制剂工艺试行标准为 WS-10863(ZD-0863)-2002,2011 年获原国家食品药品监督管理总局正式国家标准批准[WS-10863(ZD-0863)-2002-2011Z],2020 年8 月取得最近一次国家药品监督管理局颁发的再注册批件。同时,为进一步提升制剂工艺水平,喜炎平注射液不断深入进行工艺、原辅料等药学研究;喜炎平注射液原料药在国家质量标准基础上增加了17-氢-9-去氢穿心莲内酯-19-硫酸酯钠的TLC 鉴别和HPLC 法含量测定,并对原料药和注射液进行了指纹图谱的检查,进一步保障药品质量。喜炎平注射液积极开展生产过程的质量控制研究,在国家标准的基础上建立了更为严格的质量控制标准,同时优化生产工艺条件促进生产和提高质量,全面提升了药品的品质。
3 结果
3.1 安全性
3.1.1 安全性证据
(1)药品说明书:不良反应包括潮红、皮疹、瘙痒、呼吸困难等过敏反应;荨麻疹等皮肤及附件反应;畏寒、寒战、颤抖等全身性反应;恶心呕吐、腹泻等消化道反应;胸痛、胸闷、憋气等呼吸系统反应;心悸、心动过速等心血管系统反应;头晕、头痛、抽搐等神经精神系统反应;皮疹、疼痛、麻木、瘙痒、静脉炎等用药部位反应。需要注意的是,对本品或含有穿心莲内酯总磺化物制剂过敏者禁用,需警惕过敏性休克。在用药过程中应密切观察用药反应,特别是开始30 min,发现异常立即停药,采取积极措施救治患者。
(2)国家药品不良反应监测中心SRS:2015—2019 年国家药品不良反应监测中心SRS 监测数据显示,收到喜炎平注射液不良反应报告共计16 474例,严重(新的严重和已知严重)报告1 226 例。不良反应累及系统前3 位主要为皮肤及皮肤附件疾病(55.59%)、全身整体疾病(12.89%)和胃肠疾病(8.07%),严重不良反应以皮疹、荨麻疹等已知不良反应为主。未发现严重的新不良反应风险因素。
(3)主动监测:由中国中医科学院中医临床基础医学研究所牵头,采用医院集中监测的方式对21 家医院2012 年3 月—2015 年1 月使用喜炎平注射液的住院患者开展了安全性监测。研究共纳入30 759 例患者,发现与喜炎平注射液相关的不良反应23 例,不良反应发生率为0.075%,未发现严重不良反应。根据国际医学科学组织委员会(Council of International Organizations of Medical Sciences,CIOMS)药物不良反应频度分级标准,喜炎平注射液不良反应为罕见级别。
(4)临床文献报道:1 项喜炎平注射液的循证安全性评估研究[8]结果显示,在RCT 与观察性研究中不良反应发生率为1.78%。喜炎平的不良反应主要集中在胃肠系统、皮肤及其附件系统、全身性及给药部位各种反应、心脏系统。
(5)真实世界研究:1 项4 023 例使用喜炎平注射液患者的真实世界研究[9]中,药物不良反应发生率为0.17%,6 例轻度不良反应,1 例中度不良反应。
(6)官方网站通知公告:2017 年9 月23 日,原国家食品药品监督管理总局发布通告责令江西青峰药业有限公司喜炎平注射液立即召回出现寒战、发热严重不良反应批次的喜炎平注射液。后对喜炎平注射液相关样品检验、生产现场检查和风险评估,根据原国家食品药品监督管理总局办公厅《关于做好山西振东安特生物制药有限公司红花注射液和江西青峰药业有限公司喜炎平注射液有关问题处置工作的通知》(食药监办药化监[2017]128 号)文件精神,恢复喜炎平注射液的生产和销售。
(7)药物警戒与风险管理:企业制定完善《药物警戒部工作标准》,按时提交药物警戒年度报告和产品不良反应年度分析报告,并制定了药品安全风险管理标准操作程序等,定期开展安全性文献检索,更新说明书,并开展了“中药注射剂喜炎平注射液不良反应综合评价和预警体系构建研究”省自然科学基金项目,建立了基于“信号检测-信号分析”综合应用的喜炎平预警模型,并及时向医务人员、患者、公众传达药品安全性新信息,沟通药品风险。
3.1.2 证据评价
(1)证据充分性方面:喜炎平注射液目前已开展的研究类型有①RCT 及系统评价;②前瞻性安全性主动监测(登记注册研究);③SRS 数据分析;④个案报道;⑤真实世界研究。由此可见,目前喜炎平已开展多种研究,样本量大,观察周期长,观察范围全面,并积极主动监测。根据评价原则和分级标准,评为A 级,表明喜炎平注射液证据充分,安全性结论明确。
(2)已知风险方面:已知风险评价根据已知的药品不良反应对药品的安全性分为A、B、C、D 4级。根据前瞻性主动监测,喜炎平注射液不良反应发生率为0.075%,根据CIMOS 定义的不良反应分级标准为罕见级别,罕见的严重不良反应为过敏性休克。因此根据已知风险分级依据表评为B 级。
(3)证据综合评价:以证据的充分性为横坐标,以已知风险为纵坐标,构建安全性象限系,见图3。根据证据充分性、已知风险分级,计算安全性标准化效用分数标准化系数。采用等频离散化法则,将计算得出的安全性标准化效用分数转化等级。根据证据充分性和已知风险,评为B 级,表明基于现有研究,认为喜炎平注射液风险较可控,安全性较好。

图3 安全性风险-证据矩阵图Fig.3 Matrix graph of security risk-evidence
3.2 有效性
3.2.1 有效性证据 为明确喜炎平注射液治疗CAP 的有效性,王一民等[10]通过筛选文献,最终共纳入18 项RCTs[11-28]进行Meta 分析。结果显示:喜炎平注射液联合氟喹诺酮类、头孢菌素类、大环内酯类、β-内酰胺类抗生素治疗较单用抗生素治疗,可提高总有效率;同时进行亚组分析显示,相较于单用抗生素,喜炎平注射液联合抗生素治疗能显著缩短CAP 患者的退热时间、咳嗽时间、住院时间,改善炎症反应情况,对病原菌清除率更为有效。漏斗图呈正态分布,提示可能不存在发表偏倚。
3.2.2 证据评价
(1)证据质量评价:按照GRADE 证据体系对Meta 分析证据质量进行评价,见表1。
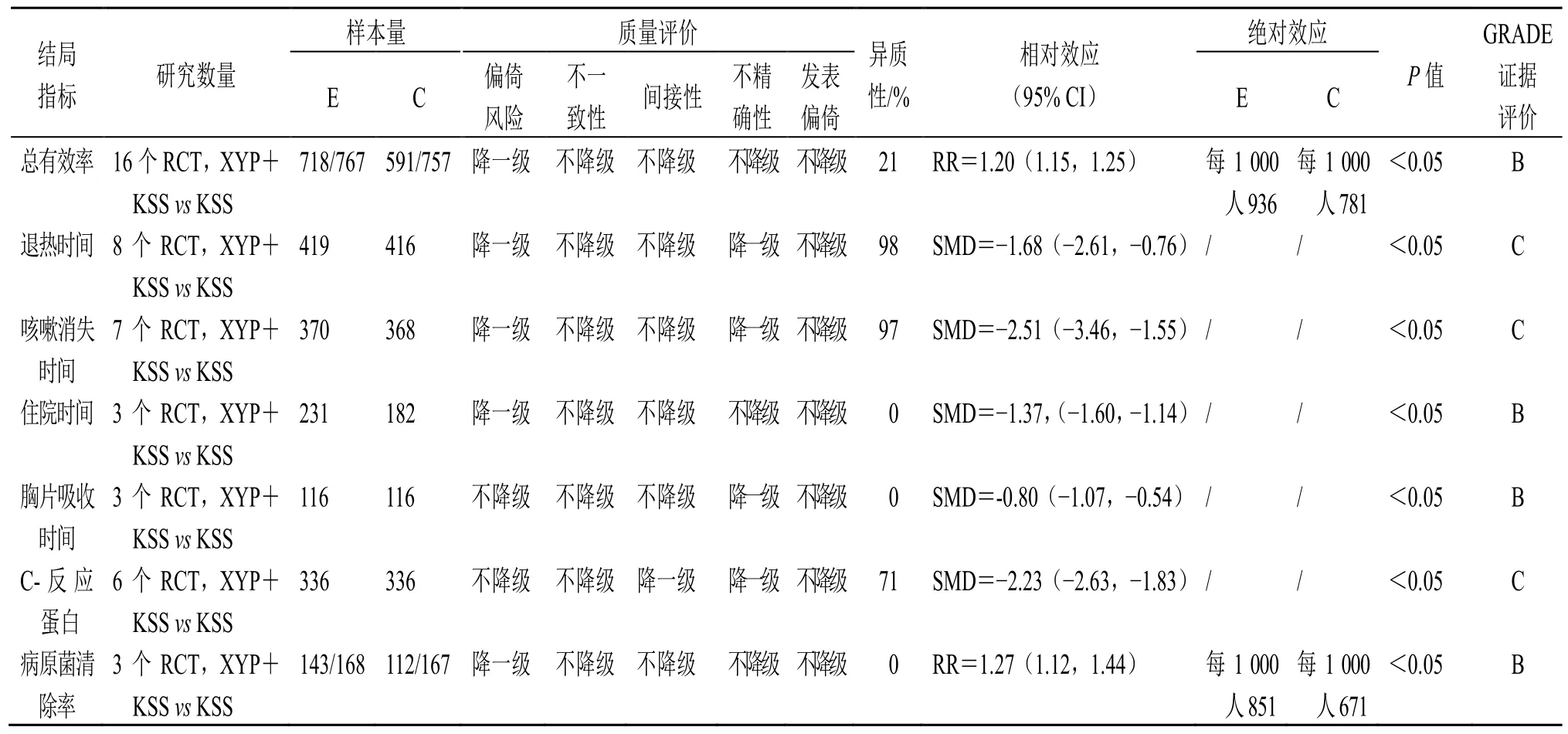
表1 有效性证据评价Table 1 Validity evidence evaluation
(2)证据价值评价:根据《中国成人社区获得性肺炎的诊断和治疗指南》(2016 年版),其核心指标群为退热时间、咳嗽消失时间、改善炎症反应情况,次要指标群为住院时间,证据价值按照PICO 原则来衡量,根据有效性评价方法核心指标群赋分0.875 分,次要指标群赋分0.375 分,采用加权乘积模型(weighted product model,WPM)计算证据价值。按照等频离散化的原则计算咳嗽消失时间、退热时间等级为A,表明具有较大临床价值;总有效率、胸片吸收时间、C-反应蛋白、病原菌清除率、住院时间等级为B,表明具有较大临床价值。
(3)证据综合评价:以证据价值为横坐标,证据质量为纵坐标,构建象限系矩阵,见图4,有效性标准化效用分数落在蓝色区域,评为B 级,表明有效性较好。

图4 有效性证据价值-质量矩阵图Fig.4 Matrix graph of validity evidence value-quality
3.3 经济性
3.3.1 经济性证据 根据回顾性队列研究[29]评价喜炎平注射液治疗CAP 的经济性,如表2 所示。从成本和结局来看,青霉素组、头孢菌素组和抗病毒组常规治疗与喜炎平注射液联合常规治疗差异无统计学意义。从药物经济学结果来看,以住院时间长短为效果指标时,两组在成本效益上差异无统计学意义;从绝对值看,在头孢菌素组和抗病毒药物组中,喜炎平注射液联合常规治疗比单纯常规治疗更经济。以临床治愈率为效果指标时,两组间无统计学差异;从绝对值看,喜炎平注射液联合常规治疗对单纯青霉素治疗无经济效益。需要将其他两组的增量成本效益比与阈值进行比较,以确定其是否具有经济效益。

表2 喜炎平注射液经济学评价Table 2 Economic evaluation of Xiyanping Injection
3.3.2 证据评价
(1)证据质量:经济学证据质量评价通过CASP清单来进行评价,评价结果为0.79 分。
(2)经济价值评价:经济性价值从增量效应水平和干预方案成本水平2 个方面进行评价。增量效应水平方面,住院天数和治愈率增量效应不明显(表3),评为D 级。干预方案成本水平方面,计算3 组的成本干预水平,青霉素组为1.1,头孢素组0.96,抗病毒组0.46,评价为A 级。
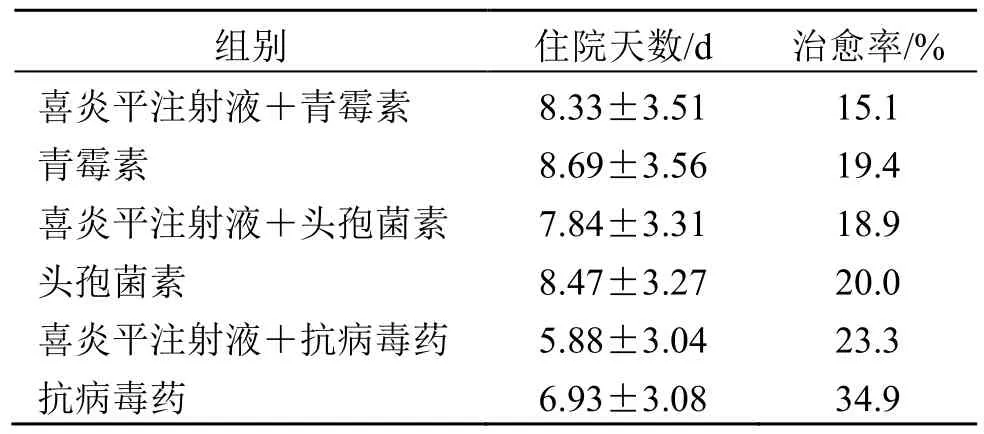
表3 增量效应水平Table 3 Incremental effect level
(3)证据综合评价:通过中成药临床证据和价值评估软件(CSC,V2.0 版),根据增量效应水平和干预成本水平评价结果,计算得喜炎平注射液经济性价值标准化效用分数。根据证据质量和经济价值评价结果计算经济性标准化效用分数,评价等级为B,经济性结果较好,能够根据现有证据说明相对经济性;证据报告比较充分、结果较明确。见图5。
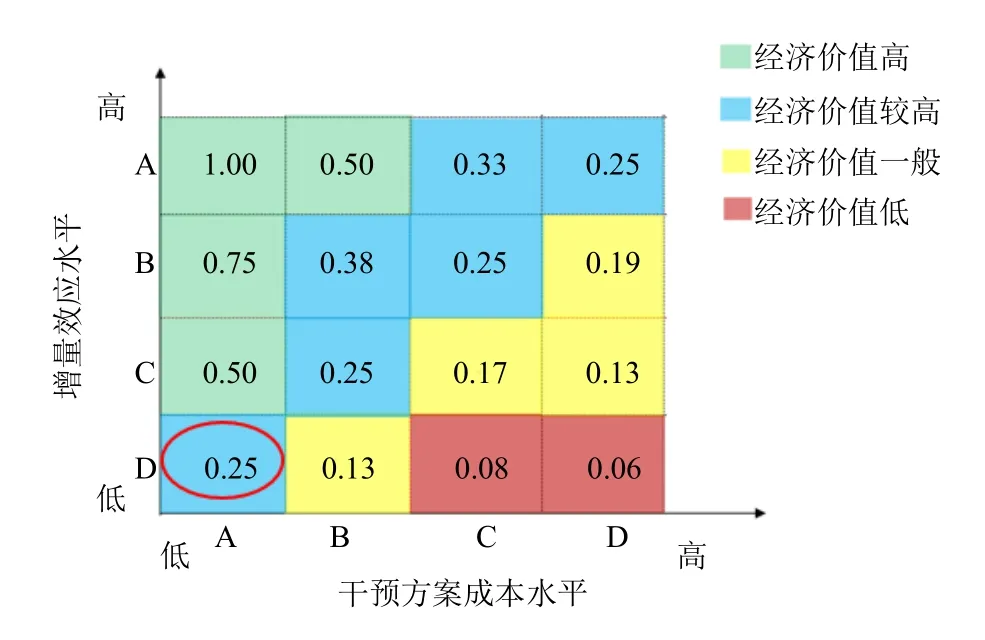
图5 增量效应水平-干预成本水平矩阵图Fig.5 Matrix graph of incremental effect levelintervention cost level
3.4 创新性
3.4.1 创新性证据
(1)临床创新性:喜炎平注射液为非特异性抗炎、抗病毒药物,其与抗生素联用治疗成人CAP 能够提高成人CAP 的临床有效率,改善患者咳嗽症状,缩短患者退热时间、住院治疗时间。专家共识建议[30],对于明确细菌感染或肺炎支原体感染的成人CAP,在合理选择抗生素的同时尽早联合使用喜炎平注射液调节气道炎症反应,改善临床症状和缩短发热时间,从而缩短病程时间(A 级)。对于病毒性肺炎初期或中期的成人患者,推荐使用喜炎平注射液调节炎症反应,促进肺部炎症吸收,缩短住院时间,减少疾病发展和降低并发症发生率(A 级)。
(2)企业服务体系创新性:企业联合多个行业内研究团队,在中华中医药学会立项,共同建立了高于《中国药典》标准的穿心莲(供注射用)团体标准,修订了穿心莲内酯(供注射用)团体标准。同时在国内建立了多个穿心莲原药材标准化中药材种植基地,保证药材及原料安全充足,可扩展性较好。产品销售覆盖国内30 个省、市、自治区,近6 000 余家医院,并建立了数字化的物流可追溯系统。
(3)产业创新性:喜炎平注射液是通过磺化工艺萃取而成的现代中成药,不含助溶剂等辅料,分子结构中引入亲水基团以增强水溶性,从而实现注射途径给药,改善穿心莲内酯生物利用度。企业开展了“喜炎平注射液不良反应综合评价和预警体系构建研究”省自然科学基金项目,建立基于“信号检测-信号分析”综合应用的喜炎平注射液预警模型。同时开展50 余项科学研究,拥有国内已授权发明专利20 余项。
3.4.2 证据评价 创新性评价设置3 个一级指标,18 个二级指标,对每个二级指标进行评价,通过CSC 2.0 软件计算喜炎平注射液创新性标准化效用分数[31],评价为B 级,表明喜炎平注射液的创新性较好。
3.5 适宜性
3.5.1 适宜性证据 喜炎平注射液为安瓿包装,用法分肌内注射和静脉滴注2 种,为处方药。储存方面需要避光、密封,在20 ℃以下的阴凉处储存即可,供应及贮存方便。此药严禁与其他药物在同一容器内混合使用,联合使用其他静脉用药,在换药时建议冲洗输液管。
对医护而言,用药时无需特殊装置,滴速适宜即可,配备及给药方便,发生药品不良反应时易于救治,针对不同患者可个体化给药,技术与管理方面易于达到。但需要注意的是,应严格控制输液速度,成人以30~60 滴/min 为宜。首次使用喜炎平注射液的患者应加强监测,密切观察用药过程的反应,发现异常应立即停药,并采用积极救治措施。同时以问卷调查方式针对配药及给药方便度、不良反应救治难易、个体化方案、技术与管理要求、政策与宣传促销5 个方面调查了来自22 个省份、直辖市、自治区的166 名医护人员。针对患者而言,CAP 治疗用药周期为7 d,用药疗程合适。喜炎平注射液上市时间早,患者对药品信息有一定了解,联合用药可减少住院时间,从而降低经济费用。
3.5.2 证据评价 适宜性维度评价根据调查问卷结果,计算各领域的平均分作为各领域得分;计算所有项目的平均分作为适宜性得分。综合计算,喜炎平注射液适宜性得分为0.75 分,评为B 级,可基本满足临床用药需求,表明喜炎平注射液适宜性较好,可基本满足临床用药需求。
3.6 可及性
3.6.1 可及性证据 参照世界卫生组织和国际健康行动机构评估基本药品准入标准化方法,药品可及性主要涉及药品价格水平、可获得性和可负担性3个方面[32]。
(1)药品价格水平:喜炎平注射液2021 年中标价格中值25.3 元,每支2 mL∶50 mg。喜炎平注射液规格为5 mL∶125 mg,每盒6 支,每支49.8 元,成人用量250~500 mg,每日1 次,按最低剂量计算,日治疗费用约100 元。
(2)可负担性:按最低剂量计算,喜炎平注射液日治疗费用约100 元。CAP 的治疗周期约7 d,喜炎平注射液每疗程总金额700 元。疗程费用占2021 年城镇居民人均可支配收入的0.29%,占农村的1.11%。
(3)可获得性:喜炎平注射液主要分布30 个省市自治区,覆盖6 500 家医院。三级医院约70%配备有药品,二级医院约50%配备有药品,一级医院约35%配备有药品。每年接受治疗患者1 000 万左右。每年产量大概1.5~2 亿支,足够覆盖全年销量。
3.6.2 证据评价 根据前期专家投票为3 个方面赋权,计算喜炎平注射液可及性得分,评价为B 级,表明喜炎平注射液可及性较好。
3.7 中医药特色
3.7.1 中医药特色证据
(1)中医辨证:中医认为CAP 属于“风温”“肺热咳嗽”等范畴,是一种外感热病。CAP 的病因多为风邪、湿邪伤肺卫,卫气郁闭或邪气阻肺络或肺不布津,痰聚化热。《素问·刺热篇》曰:“肺热病者,先渐然厥,起毫毛,恶风寒,舌上黄。身热,热争则喘咳,痛走胸膺背,不得大息,头痛不堪。”由此可见,CAP 发热、高热不退、身热不退或往来寒热,咳嗽、胸痛等症与肺热病、风温病的症状相似,多表现为实热证或湿热证。治疗上以清、宣、透、热为法,以清热燥湿、化痰止咳、宣肺平喘为主。
(2)组方特点:喜炎平注射液主要组成为穿心莲,穿心莲味苦,性寒;归心、肺、大肠、膀胱经,具有清热解毒、凉血、消肿、燥湿的功效。临床一般认为适用于实热或湿热证候,其药理作用基本覆盖了CAP 在实热或湿热证阶段的各个病理环节,其抗病毒、抗炎作用也与这个阶段的中医辨证病理相吻合。多项专家共识及重大疾病诊疗方案中均推荐喜炎平注射液用于治疗CAP 痰热壅肺证、热毒闭肺证等湿热、实热证。
3.7.2 证据评价 中医药特色评价标准:①证候、复方配伍、民族药中有1 项为是,得1 个“+”;②中成药的组方记载于1911 年以前的医书中,或其为1911 年以前医书中记载的2 个及以上处方的合方,或君药、臣药不变的加减方,源于院内制剂、协定处方得1 个“+”;③发表了3 000 例的真实世界研究,得1 个“+”。喜炎平注射液在理论特色和人用经验方面均有中医药特色,评为“++”,评为B 级,表明喜炎平注射液中医药特色较突出。
3.8 临床价值综合评价
根据有效性、安全性、经济性、创新性、适宜性、可及性、中医药特色“6+1”个维度,计算综合衡量价值分数,综合评价为A、B、C、D 4 类,安全性维度评价B、有效性维度评价B、经济性维度评价B、创新性维度评价B、适宜性维度评价B、可及性维度评价B,中医药特色维度评价B。采用MCDA 模型,构建中成药临床价值评价框架,将评价结果转换为分值,即A 为0.875 分,B 为0.625分,C 为0.375 分,D 为0.125 分。通过专家对准则层、指标层赋予权重,采用加权求和思想,计算临床价值分数。根据前期专家会议及专家共识,对6个维度赋权结果,安全性为0.26 分,有效性为0.38分,经济性为0.12 分,创新性为0.10 分,适宜性为0.07 分,可及性为0.07 分,按照公式计算,喜炎平注射液临床价值分数为0.625 分,评为B 类,表明临床价值较好。在综合衡量价值分类的基础上,整合中医药特色维度,形成“6+1”维度雷达图,见图6。

图6 喜炎平注射液临床价值“6+1”个维度示意图Fig.6 Schematic diagram of clinical value of Xiyanping Injection in “6 + 1” dimensions
4 讨论
由于喜炎平注射液治疗CAP 的综合临床价值研究较少,尚不完全清晰,因此本研究采用定性与定量相结合的方法,基于循证医学、流行病学、临床医学、临床药学、循证药学、药物经济学、卫生技术评估等方法学,通过问卷调查、公开资料、真实世界数据及文献二次评价,利用MCDA 进行多层次维度评价,以辅助提升卫生健康资源配置效率、优化药品使用结构,促进临床合理安全用药。同时,开展以临床定位为基础,临床价值为导向,科学决策为目标的中成药证据综合与价值评估,是在满足《药品临床综合评价指南(2021 年版试行)》要求的基础上,充分发挥中医药特色及优势。
本研究基于现有临床研究证据综合进行临床价值评估,结果显示喜炎平注射液安全性风险可控,安全性良好;有证据表明其联合喹诺酮类、头孢菌素类、大环内酯类、β-内酰胺类抗生素治疗成人CAP具有较好效果,临床价值较大。经济性上,现有证据说明其联合青霉素、头孢素和抗病毒药治疗成人CAP 经济性疗效显著,相对常规治疗更为经济;证据报告比较充分、结果较明确。其在临床创新性、服务体系及产业创新性也较好;适宜性上对医患双方可基本满足临床用药需求;可及性较好,在信息服务评价方面符合国家标准的规定,信息比较规范,准确;中医药特色较突出,为单味中药提取物,临床适用于CAP 中医辨证的实热症或湿热症。因此,综合评估其整体临床价值后,认为喜炎平注射液具有较好临床综合价值,建议可按程序有条件转化为基本临床用药管理的相关政策结果。
建议开展进一步临床精准定位研究,提高治疗成人社区获得性肺炎的临床疗效;开展以临床价值为导向的精准用药机制的研究,在实践中及时更新评价结果。
专家组成员(按姓氏笔画排序):于雪峰(辽宁中医药大学第二附属医院)、王成祥(北京中医药大学第三附属医院)、支英杰(中国中医科学院中医临床基础医学研究所)、边永君(中国中医科学院广安门医院)、卢健棋(广西中医药大学第一附属医院)、田金徽(兰州大学基础医学院)、史利卿(北京中医药大学东方医院)、孙增涛(天津中医药大学第二附属医院)、李素云(河南中医药大学第一附属医院)、李平(中日友好医院)、李振吉(世界中医药学会联合会)、李楠(北京大学医学部第三医院)、李薇(北京大学医药管理国际研究中心)、李雪迎(北京大学第一医院)、闫博华(成都中医药大学附属医院)、张玲(首都医科大学公共卫生学院)、张洪春(中日友好医院)、张琼(中国中医科学院西苑医院)、陈薇(北京中医药大学循证医学中心)、苗青(中国中医科学院西苑医院)、赵海滨(北京中医药大学东方医院)、赵德喜(长春中医药大学附属医院)、姚卫海(首都医科大学附属北京中医医院)、曹俊岭(北京中医药大学东方医院)、盖国忠(中国中医科学院中医临床基础医学研究所)、彭伟(山东中医药大学附属医院)、雷燕(中国中医科学院医学实验中心)、蔡少青(北京大学药学院)、潘平(世界中医药学会联合会)、冀晓华(中国中医科学院西苑医院)。
利益冲突所有作者均声明不存在利益冲突