基于UPLC-Q-Exactive Plus-Orbitrap MS 的丹参提取物成分表征及其抗血栓作用谱效相关药效物质基础解析
刘 悦 ,丁晓彦,王 娜,高 燕,杨龙飞,吕 婧,韩利文,傅春升,赵渤年*
1.山东中医药大学 药物研究院,黄河流域特色中药生态保护和高质量发展协同创新中心 山东 济南 250355
2.山东中医药大学附属医院 药学部,山东 济南 250014
3.山东省中医药研究院,山东 济南 250014
4.山东现代学院,山东 济南 250104
5.山东第一医科大学(山东省医学科学院),药学院(药物研究所),山东 济南 250024
6.山东中医药大学附属医院,山东 济南 250014
血栓是引起缺血性疾病的主要原因,中医认为,血栓的形成与患者气血运行不畅、气滞血瘀有关,因此,中医临床常用活血化瘀类中药治疗血栓性疾病[1-2],代表药味有丹参、三七、川芎、桃仁、红花、赤芍等。该类药物不仅可以抑制血小板活化和炎症反应,还可以改善纤溶系统、凝血系统等,通过多种途径共同发挥抗血栓作用[3]。
丹参为唇形科植物丹参SalviamiltiorrhizaBge.的干燥根或根茎,为中医活血化瘀的要药,主要成分包括脂溶性的丹参酮I、丹参酮IIA、水溶性的丹酚酸类与多酚酸类等,具有抗血小板聚集、抑制黏附因子表达、抗氧化、抗癌等作用[4]。关于丹参抗血小板聚集作用的研究早在1982 年就有报道,不少临床资料也证实丹参制剂对血栓性疾病有较好的疗效[5-7]。故本研究采用超高效液相色谱-四极杆-静电轨道阱-高分辨质谱(UPLC-Q-Exactive Orbitrap MS)建立丹参指纹图谱,采用花生四烯酸诱导的斑马鱼血栓模型,对不同产地丹参的抗血栓作用进行考察,并运用数理统计方法将指纹图谱化学信息与药效学信息进行相关性研究,以期表征丹参的抗血栓效应组分,为丹参抗血栓作用谱-效关系研究奠定基础,为丹参临床治疗血栓性疾病提供数据支持。
1 材料
1.1 仪器
Thermo Hypersil GOLD 液相色谱柱(100 mm×2.1 mm,1.9 µm)、UPLC-Q-Exactive Orbitrap MS(美国赛默飞世尔科技公司);SB4200DTS 型超声波双频清洗机(宁波新芝生物科技股份有限公司);BP211D 型电子天平(赛多利斯科学仪器北京有限公司);电热恒温水浴锅(北京市永光明医疗仪器有限公司);KDM 型可调控温电热套(山东鄄城华鲁电热仪器有限公司);FDY1002-UV-P 型低有机物型超纯水机(青岛富勒姆科技有限公司);DLSC05 型微型涡旋混悬仪(北京东陵昌盛生物科技公司);IX83+DP8 型荧光显微镜(日本Olympus 公司);6 孔板(美国Corning 公司);KQ-300DB 型数控超声波清洗器(昆山市超声仪器有限公司);ZSA0745 型连续变倍体式显微镜(重庆光电仪器有限公司);Research plus 移液枪(徳国Eppendorf 公司);HPG-280BX 型恒温光照培养箱(哈尔滨市东联电子技术开发有限公司);斑马鱼养殖系统(五层单排,上海海圣生物实验设备有限公司)。
1.2 药品与试剂
乙腈(批号219087)、甲酸(批号193497)购自赛默飞世尔(上海)仪器有限公司;对照品隐丹参酮(批号110852-201807)、丹参酮I(批号110867-201607)、丹参酮IIA(批号110766-202022)、丹参素(批号110855-201915)、丹酚酸B(批号111562-201716)、咖啡酸(批号110885-201703)由中国食品药品检定研究院提供,质量分数均>98%;对照品丹酚酸A(批号Z23D10X106625)、原儿茶醛(批号TO1013FB14)、迷迭香酸(批号Y16A9K67403)和紫草酸(批号Y04J10H75487)由上海源叶生物科技有限公司提供,质量分数均>98%;二氢丹参酮I对照品(批号PRF7033101,质量分数>98%)购自成都普思生物科技股份有限公司;牛蒡子苷对照品(批号PRF7033101,质量分数>98%)购自成都普瑞法科技开发有限公司;花生四烯酸(arachidonic acid,AA,批号D1827021)购自上海Aladdin 公司;二甲基亚砜(dimethyl sulfoxide,DMSO,批号39075)购自上海Sangon 生物科技公司;玲联茴香胺(批号MKCC7501)、阿司匹林(批号MKCD0957)购自美国 Sigma-Aldrich 公司;4%多聚甲醛(批号B35F001200)购自武汉Servicebio 公司。
1.3 动物
成年AB 系斑马鱼(山东第一医科大学药学院提供)培养于专业的养殖系统,保持恒温(28.0±0.5)℃,14 h/10 h 光/暗循环。每天分别于9: 00 和16: 00 时投喂丰年虾。需要用卵时,把成年雄雌斑马鱼按2∶1 的比例放在交配缸中分隔板的两边;次日早晨抽去隔板,斑马鱼受光照刺激自然交配产卵。在产卵后30 min 内收集胚胎。收集的胚胎移入装有养鱼水(5 mmol/L NaCl、0.17 mmol/L KCl、0.4 mmol/L CaCl2、0.16 mmol/L MgSO4)的培养皿中,28.5 ℃培养72 h,备用。
1.4 药材
不同产地60 批丹参饮片(表1)购自安徽亳州中药材交易中心,经山东省中医药研究院丁晓彦副研究员鉴定,均为丹参S.miltiorrhizaBge.的干燥根及根茎。粉碎过40 目筛,备用。
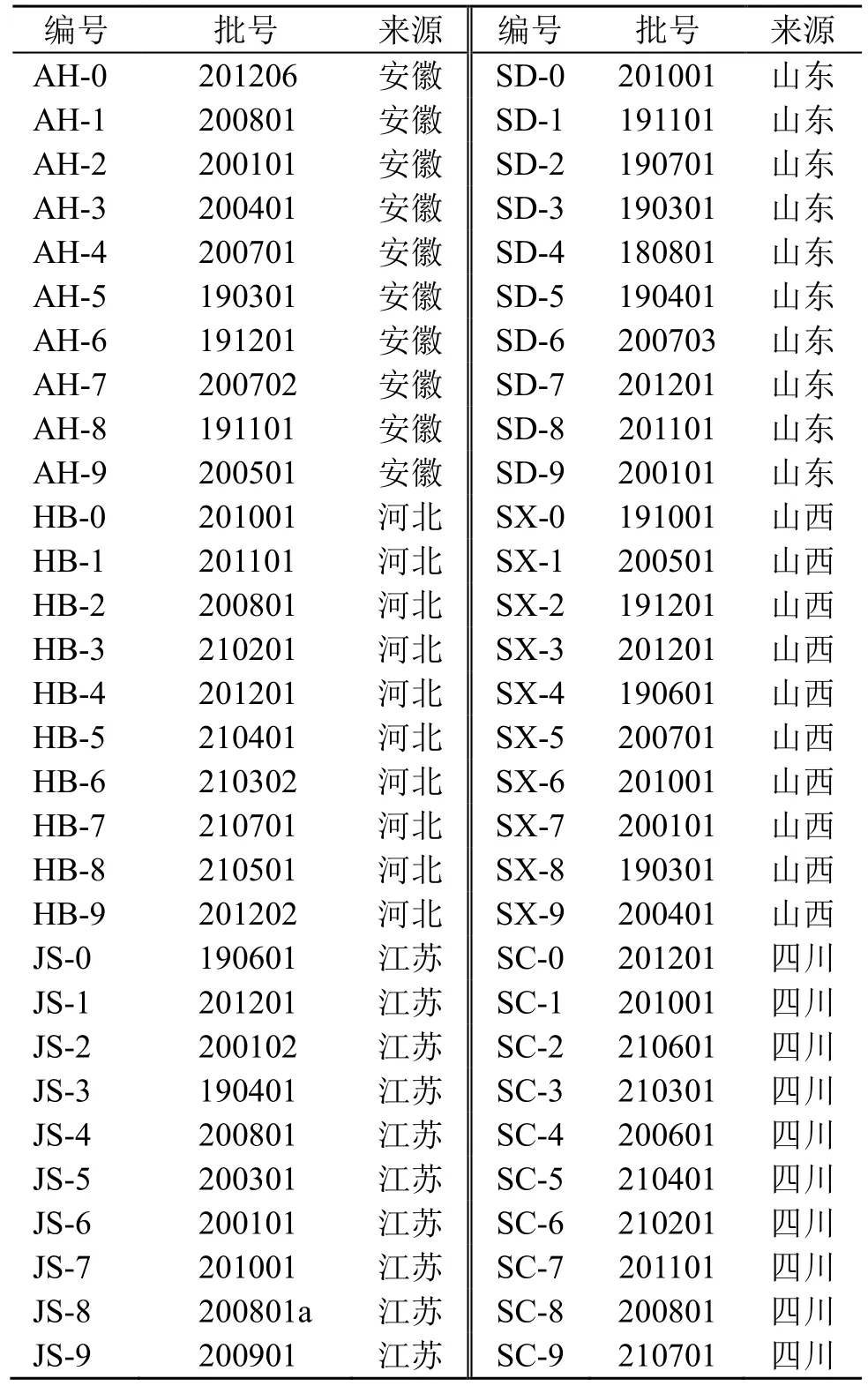
表1 丹参样品信息Table 1 Information of S.miltiorrhiza samples
2 方法
2.1 指纹图谱的建立
2.1.1 色谱条件 Thermo Hypersil GOLD 色谱柱(100 mm×2.1 mm,1.9 µm);流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱:0~5 min,90%~85% B;5~10 min,85%~80% B;10~23 min,80%~75% B;23~26 min,75%~40% B;26~36 min,40% B;36~40 min,40%~5% B;40~41 min,5%~90% B。体积流量0.3 mL/min;柱温30 ℃;检测波长285 nm;进样量6 μL。
2.1.2 质谱条件 电喷雾离子源(electric spray ion source,ESI),正、负离子检测模式;扫描范围m/z100~1 500;鞘气体积流量1 132.67 L/h;辅助气体积流量283.17 L/h;毛细管温度350 ℃;辅助气温度320 ℃;喷雾电压为+3.50 kV(正离子模式)和−3.00 kV(负离子模式);扫描模式为FullMs/dd-Ms2,FullMs 分辨率70 000,dd-Ms2分辨率17 500。
2.1.3 对照品溶液和内标溶液的制备 精密称定原儿茶醛、迷迭香酸、紫草酸、丹酚酸A、丹酚酸B、咖啡酸、丹参酮I、隐丹参酮、丹参酮IIA、二氢丹参酮I 对照品适量,加甲醇制备成质量浓度分别为1.200、1.730、1.450、1.260、1.150、0.950、0.020 4、0.108、0.100、1.200 mg/mL 的对照品溶液。精密称定丹参素钠对照品适量,加50%甲醇制备成质量浓度为422.5 μg/mL 的对照品溶液。精密称定牛蒡子苷对照品适量,加甲醇制成质量浓度为51.5 µg/mL的内标溶液。
2.1.4 供试品溶液的制备
(1)冻干粉I 的制备:精密称定丹参粉末3 g,置圆底烧瓶中,加95%乙醇120 mL,回流提取1 h,放至室温,称定质量,补足减失质量,摇匀,滤过,取续滤液10 mL,制成冻干粉I,余滤液另器留存,残渣晾干备用。
(2)冻干粉II 的制备:取“2.1.4(1)”项下的残渣,置圆底烧瓶中,加50%乙醇90 mL,回流提取1.5 h,放至室温,称定质量,补足减失质量,摇匀,滤过,取续滤液7.5 mL,制成冻干粉II,余滤液另器留存,残渣晾干备用。
(3)冻干粉III 的制备:取“2.1.4(2)”项下的残渣,置圆底烧瓶中,加水120 mL,回流提取0.5 h,放至室温,称定质量,补足减失质量,摇匀,滤过,取续滤液10 mL,制成冻干粉III,余滤液另器留存。
(4)UPLC-Q-Exactive Orbitrap MS 检测用供试品溶液的制备:冻干粉I 用甲醇转移至100 mL 量瓶中,定容、混匀得溶液a;冻干粉II 以50%甲醇为溶剂,同法操作得溶液b;冻干粉III 以水为溶剂,同法操作得溶液c;取a、b、c 3 种溶液等体积混合均匀后,与内标溶液等体积混匀,10 000 r/min 离心5 min,上清液过0.22 µm 微孔滤膜后作为供试品溶液。
(5)药效实验用样品溶液的制备:分别取“2.1.4(1)(2)(3)”项下的余滤液30、22.5、30 mL 合并冻干;用5 mL DMSO 将冻干粉转移至EP 管中,加养鱼水20 mL,超声处理3 min,配成30 mg/mL 的母液,置4 ℃冰箱中保存备用;药效试验前用养鱼水稀释为所需质量浓度。
2.1.5 方法学考察
(1)精密度考察:取丹参样品(批号200601),按照“2.1.4”项下方法制备供试品溶液,按照“2.1.1”“2.1.2”项下分析条件,连续进样6 次,采集图谱并处理,计算各共有峰与内标峰的相对峰面积及相对保留时间RSD 值。
(2)重复性考察:取同一批丹参样品,按照“2.1.4”项下方法制备6 份供试品溶液,按照“2.1.1”“2.1.2”项下分析条件,分别测定,采集图谱并处理,计算各共有峰与内标峰的相对峰面积及相对保留时间RSD 值。
(3)稳定性考察:取同一批丹参样品,按照“2.1.4”项下方法制备供试品溶液,按照“2.1.1”“2.1.2”项下分析条件,分别在0、2、4、8、12、24 h进样,采集图谱并处理,计算各共有峰与内标峰的相对峰面积及相对保留时间RSD 值。
2.1.6 指纹图谱的建立 取60 批丹参样品,按照“2.1.4”项下方法制备供试品溶液,按“2.1.1”“2.1.2”项下分析条件进样检测,记录色谱图。选取峰纯度较高、分离较好的色谱峰为共有峰。根据国内外专业数据库Pubchem Compound 以及丹参化学成分、质谱研究相关文献,收集丹参中各种化学成分信息,导入Xcalibur 软件,根据相对分子质量误差<1×10−5,并结合二级质谱碎片信息、保留时间、对照品的信息以及相关文献数据,对共有峰进行定性、相对定量分析。
2.2 丹参抗血栓药效学研究
2.2.1 AA 对斑马鱼心脏红细胞染色面积的影响选用受精后72 h(72 h post fertilization,72 hpf)的AB 系斑马鱼,脱膜后在荧光显微镜下筛选发育正常的幼鱼于6 孔板中,设置对照组(0.1% DMSO)、模型组(AA 质量浓度分别为20、24、28 μg/mL),每组1 孔,每孔15 条斑马鱼,给药后放入28.5 ℃的恒温箱中继续培养1 h[8]造成血栓,之后用玲联茴香胺染液避光染色15 min,移除染色液,用养鱼水清洗2 次,4%多聚甲醛于4 ℃固定过夜。每组随机选取8 条斑马鱼在荧光显微镜下采集图像,利用Image Pro Plus 6.0 软件测量斑马鱼心脏红细胞染色面积,GraphPad Prism 8.0 软件进行单因素方差分析,各组结果均以±s表示,以确定最佳建模浓度。
2.2.2 不同质量浓度丹参提取物对斑马鱼尾静脉血栓的影响 取72 hpf AB 系斑马鱼于培养皿中,在显微镜下挑选发育正常的斑马鱼于6 孔板中,每孔15 条。设置对照组(0.1% DMSO)、模型组(0.1%DMSO 培养6 h 后加入24 μg/mL AA)、阳性对照组(25 μg/mL 阿司匹林培养6 h 后加入24 μg/mL AA)和丹参给药组(分别给予50、100、150 μg/mL 的丹参提取物预处理6 h 后加入24 μg/mL AA),置28 ℃光照培养箱中培养1 h,之后用玲联茴香胺染液避光染色15 min,移除染色液,用养鱼水清洗2 次,4%多聚甲醛于4 ℃固定过夜。每组随机选取8 条斑马鱼拍摄心脏和尾部位,利用Image Pro Plus 6.0 软件测量心脏红细胞染色面积,GraphPad Prism 8.0 软件进行统计分析。
2.2.3 60 批不同产地丹参提取物抗血栓药效学研究 设置空白对照组、模型组、阳性对照组和60 批丹参提取物组(质量浓度均为150 µg/mL),各组均按“2.2.2”项下方法处理。
2.3 多元统计分析
将不同产地丹参提取物指纹图谱数据导入SIMCA 14.1 软件中进行层次聚类分析(hierarchical cluster analysis,HCA)和正交偏最小二乘-判别分析( orthogonal partial least squares-discrimination analysis,OPLS-DA)。
2.4 谱效关系研究
采用在线数据分析平台SPSSPRO,以不同产地丹参提取物共有峰相对峰面积为自变量(X),斑马鱼心脏相对红细胞染色面积为因变量(Y),进行偏最小二乘回归(partial least squares regression,PLSR)分析。
3 结果
3.1 方法学考察
在重复性、精密度、稳定性考察中,以牛蒡子苷为参照峰,各共有峰的相对峰面积值RSD 为0.16%~4.99%,相对保留时间RSD 为0.02%~2.45%,说明该法重复性良好,仪器的精密度良好,样品在24 h 内稳定性良好,可用于建立丹参提取物的指纹图谱。
3.2 指纹图谱解析
3.2.1 指纹图谱检测结果 丹参提取物总离子流图见图1,根据总离子流图中的保留时间,把一级质谱提供的准分子离子峰及二级质谱提供的碎片离子信息与对照品及文献数据[9-19]比对,共识别39 个化合物,见表2。以牛蒡子苷为内标峰(峰40),计算39 个共有峰的相对峰面积值。
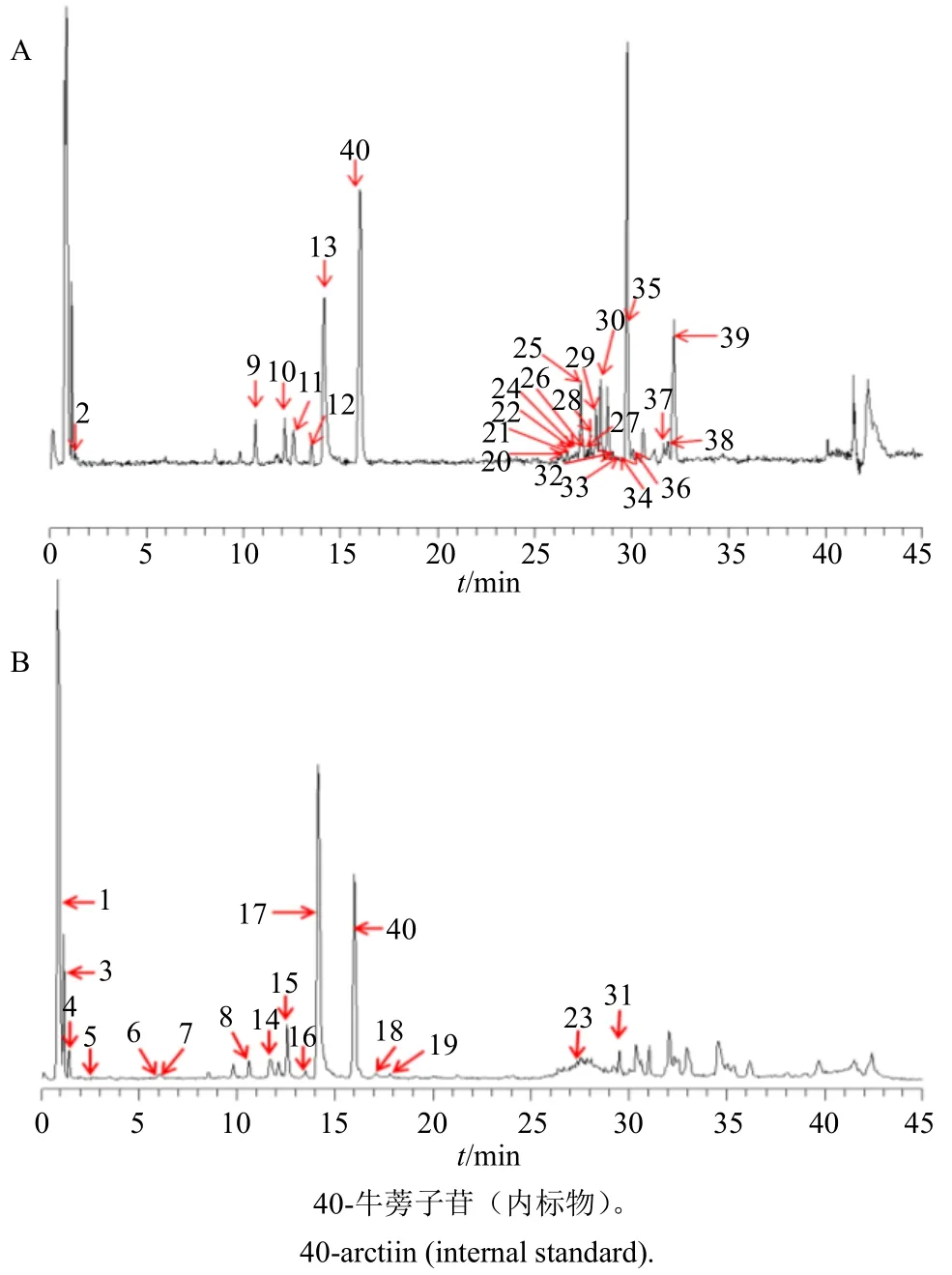
图1 正 (A)、负 (B) 离子模式下丹参提取物总离子流图Fig.1 Total ion flow chromatograms of S.miltiorrhiza extracts in positive (A) and negative (B) modes
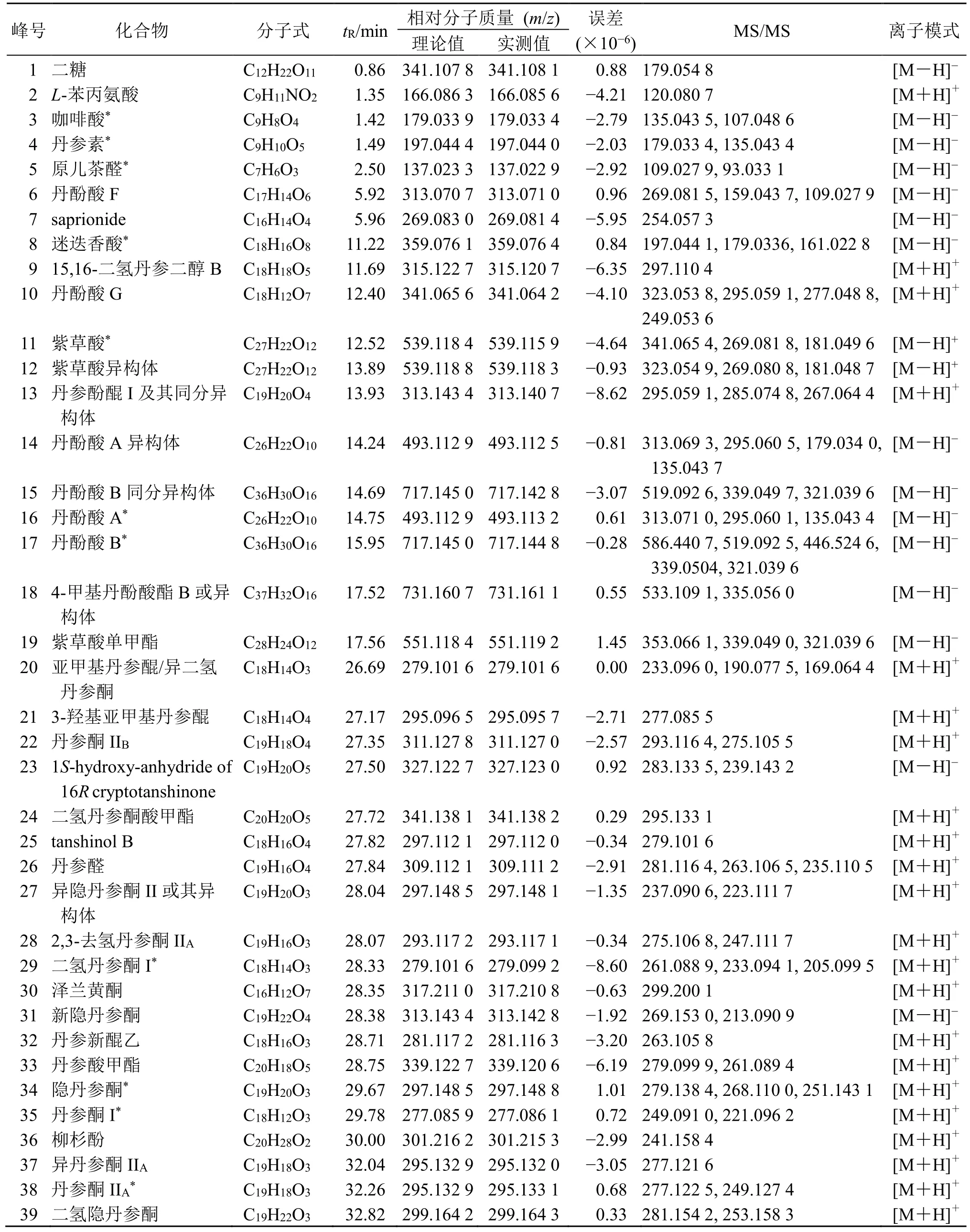
表2 丹参提取物指纹图谱共有峰解析结果Table 2 Results of common peak analysis in fingerprint of S.miltiorrhiza extracts
3.2.2 HCA 结果 将39 个共有峰的相对峰面积值作为变量,导入SIMCA 14.1 数据分析软件,采用HCA,60 批丹样品聚为2 类(距离=100,除去异常点),山西、河北、安徽、江苏产地的聚为一类,山东、四川的聚为一类(图2)。
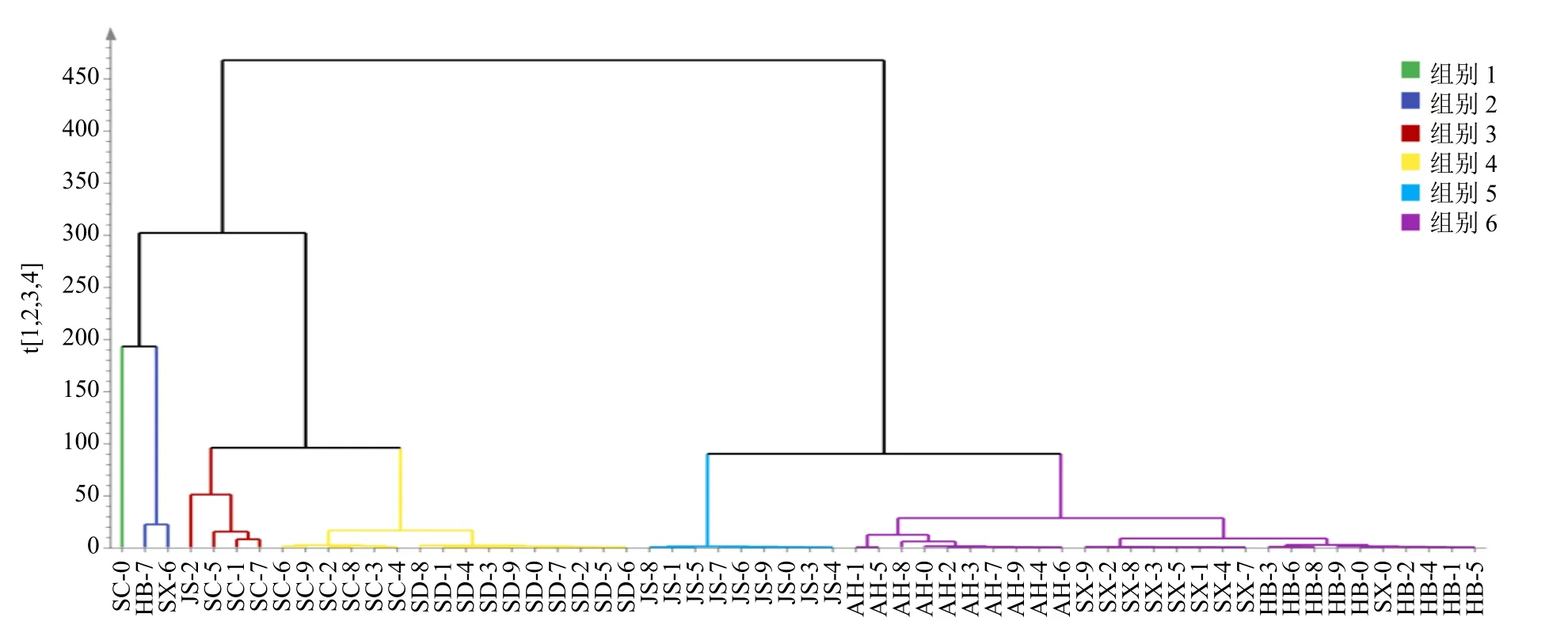
图2 60 批丹参样品的HCA 结果图Fig.2 HCA result graph of 60 batches of S.miltiorrhiza samples
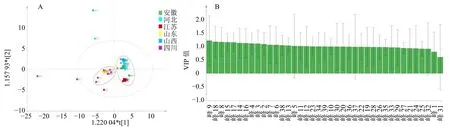
图3 丹参样品OPLS-DA 模型图Fig.3 OPLS-DA of S.miltiorrhiza samples
3.2.3 OPLS-DA 结果 为分析引起不同产地丹参样品差异的色谱峰,对安徽、江苏、河北、山东、山西和四川6 个产地的丹参样品进行OPLS-DA。OPLS-DA 模型可以使样本之间的差异最大化,以确定样本之间的差异成分[17]。由图3-A 可见,剔除异常值后安徽、河北、江苏和山西产地的丹参(A 组)分布在图的右侧,山东、四川产地(B 组)的丹参分布在左侧,表明A 组和B 组产地的丹参化学成分存在一定的差异,与聚类分析结果相一致。变量投影重要性(variable importance in projection,VIP)较大的成分即VIP 值>1 的变量,通常与样本分类更相关。所有成分的VIP 值见图3-B,VIP 值大于1 的变量有15 个,分别为峰9(15,16-二氢丹参二醇B)、峰18(4-甲基丹酚酸酯B 或异构体)、峰8(迷迭香酸)、峰15(丹酚酸B 同分异构体)、峰17(丹酚酸B)、峰14(丹酚酸A 异构体)、峰16(丹酚酸A)、峰4(丹参素)、峰3(咖啡酸)、峰2(L-苯丙氨酸)、峰7(saprionide)、峰6(丹酚酸F)、峰38(丹参酮IIA)、峰13(丹参酚醌I 及其同分异构体)和峰5(原儿茶醛),它们是区分A 组和B 组最为相关的变量,可初步推测为引起2 组丹参样品差异的物质。
3.3 丹参提取物抗血栓药效学研究
3.3.1 AA 对斑马鱼心脏红细胞染色面积的影响由图4 可知,与对照组比较,不同质量浓度的AA处理后斑马鱼心脏红细胞染色面积均显著减小(P<0.001),故本实验选取24 μg/mL AA 作为建模条件。
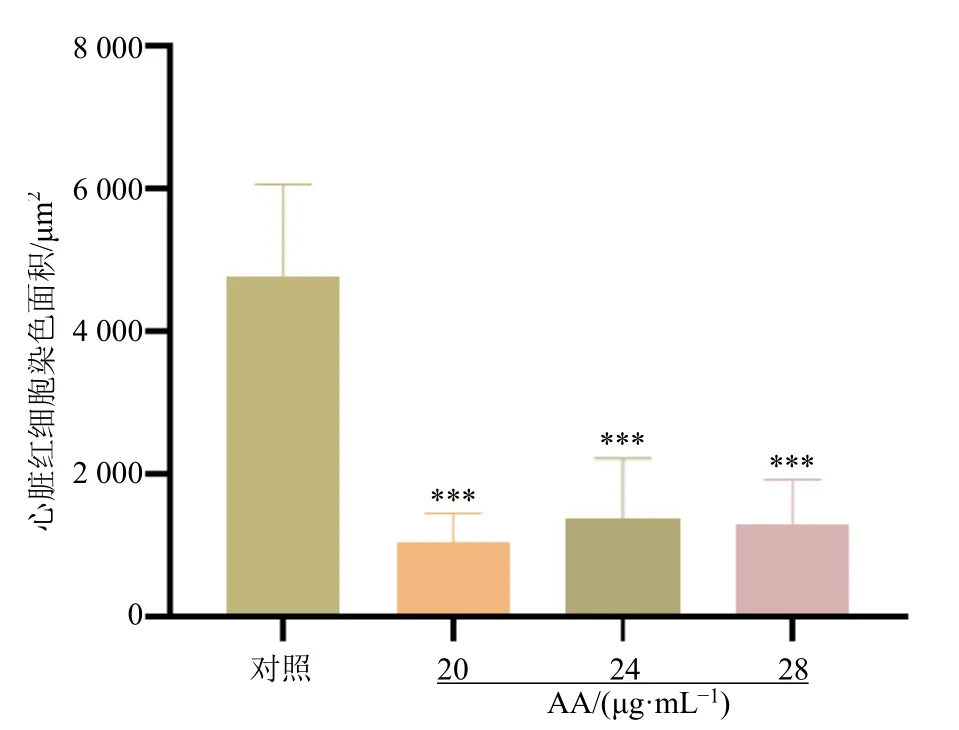
图4 AA 对斑马鱼心脏红细胞染色面积的影响 (±s, n = 8)Fig.4 Effect of AA on staining area of red blood cells of zebrafish hearts (±s , n = 8)
3.3.2 不同质量浓度丹参提取物对斑马鱼尾静脉血栓的影响 由图5 可知,AA 可导致斑马鱼尾部血栓形成,表现为与对照组比较,AA 处理后心脏红细胞染色面积显著减小(P<0.001);阳性对照药阿司匹林干预后,心脏红细胞染色面积显著增大(P<0.001),尾部静脉血栓明显改善,表明阿司匹林对于AA 诱导的血栓具有改善作用;丹参提取物(50、100、150 µg/mL)组心脏红细胞染色面积与模型组相比均显著增大(P<0.05),且150 μg/mL 丹参提取物对尾静脉血栓的改善作用最佳,故选择150 μg/mL 丹参提取物进行后续的抗血栓作用实验。
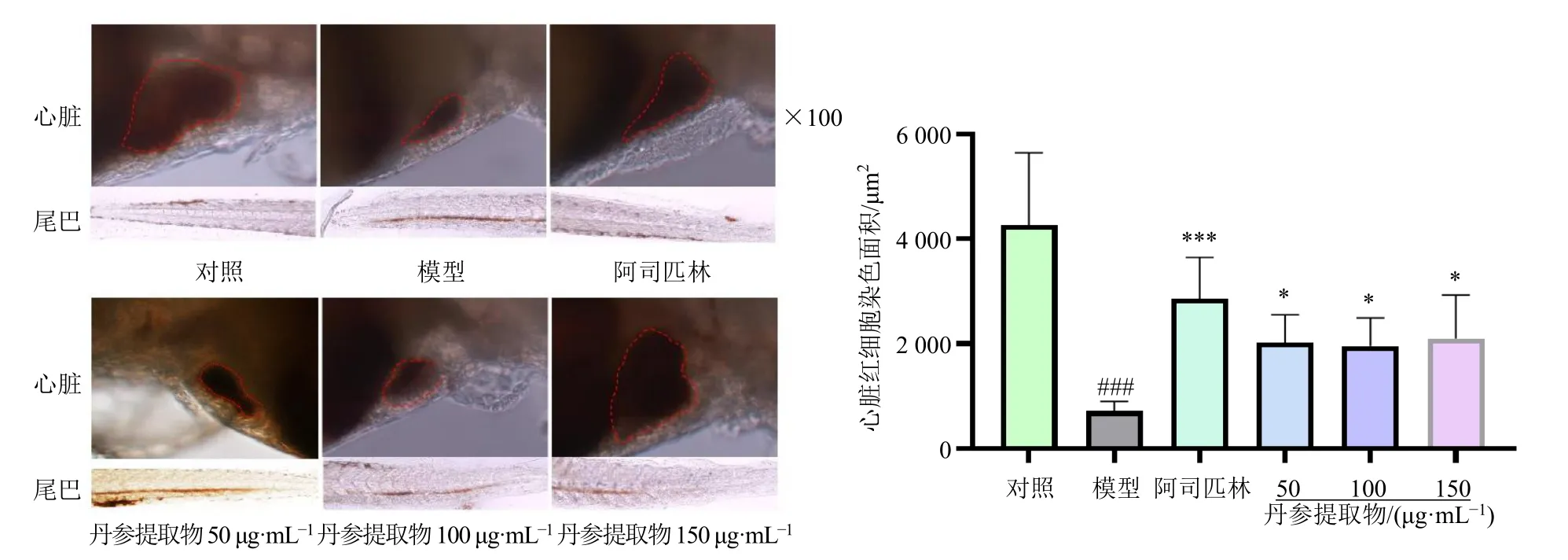
图5 不同质量浓度丹参提取物对斑马鱼心脏红细胞染色面积的影响 (±s, n = 8)Fig.5 Effects of different concentrations of S.miltiorrhiza extracts on staining area of red blood cells of zebrafish hearts(±s , n = 8)
3.3.3 60 批丹参提取物的抗血栓药效学研究 如表3 所示,与对照组比较,模型组斑马鱼心脏红细胞染色面积明显减小(P<0.001),表明建模成功;与模型组比较,阿司匹林组和60 批丹参提取物组斑马鱼心脏红细胞染色面积显著增加(P<0.05、0.01、0.001),均表现出不同程度的抑制斑马鱼尾静脉血栓形成的作用。丹参提取物由于产地及批次不同,抑制斑马鱼尾静脉血栓形成的作用不同,各产地10 批丹参平均相对红细胞染色面积排序为山东>江苏>山西>安徽>河北>四川(图6),相对红细胞染色面积越大表明抗尾静脉血栓形成的能力越强。OPLSDA 发现山东四川产地的丹参化学成分差异较小,但药效学研究发现2 产地丹参抗血栓作用存在显著性差异(P<0.001),由此可见OPLS-DA 仅能分析不同产地丹参样品的成分信息,若要评价丹参的抗血栓效果,须将成分信息与药效指标相结合。
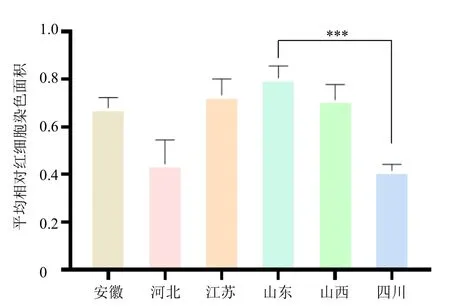
图6 不同产地丹参对斑马鱼心脏相对红细胞染色面积的影响 (±s, n = 8)Fig.6 Effects of S.miltiorrhiza from different origins on relative staining area of red blood cell of zebrafish hearts(±s, n = 8)
表3 60 批丹参提取物的抗血栓作用 (±s, n = 8)Table 3 Antithrombotic activity of 60 batches of S.miltiorrhiza extracts (±s , n = 8)
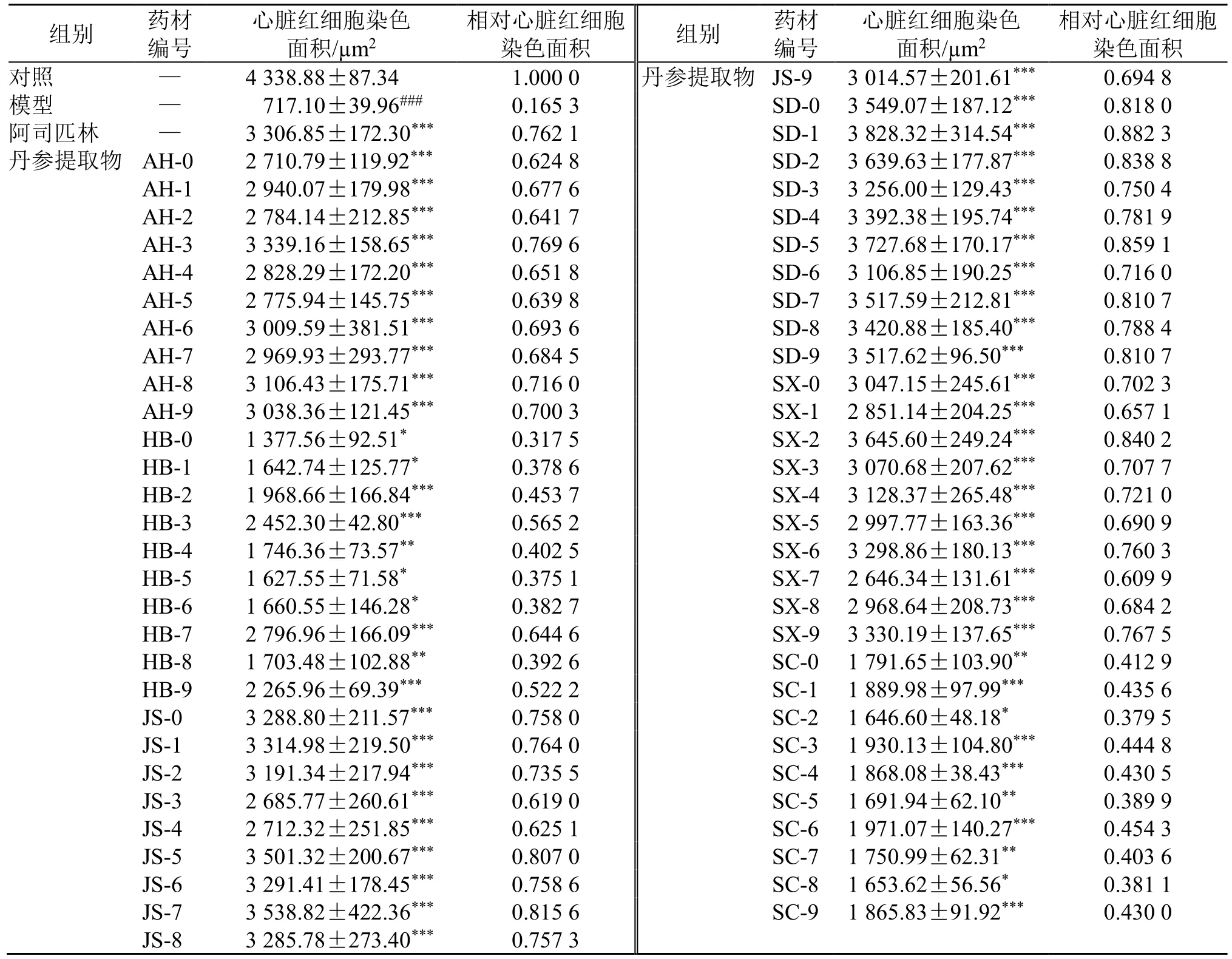
表3 60 批丹参提取物的抗血栓作用 (±s, n = 8)Table 3 Antithrombotic activity of 60 batches of S.miltiorrhiza extracts (±s , n = 8)
与对照组比较:###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001。###P < 0.001 vs control group; *P < 0.05 **P < 0.01 ***P < 0.001 vs model group.
组别 药材编号心脏红细胞染色面积/µm2相对心脏红细胞染色面积 组别 药材编号心脏红细胞染色面积/µm2相对心脏红细胞染色面积对照 — 4 338.88±87.34 1.000 0 丹参提取物 JS-9 3 014.57±201.61*** 0.694 8模型 — 717.10±39.96### 0.165 3 SD-0 3 549.07±187.12*** 0.818 0阿司匹林 — 3 306.85±172.30*** 0.762 1 SD-1 3 828.32±314.54*** 0.882 3丹参提取物 AH-0 2 710.79±119.92*** 0.624 8 SD-2 3 639.63±177.87*** 0.838 8 AH-1 2 940.07±179.98*** 0.677 6 SD-3 3 256.00±129.43*** 0.750 4 AH-2 2 784.14±212.85*** 0.641 7 SD-4 3 392.38±195.74*** 0.781 9 AH-3 3 339.16±158.65*** 0.769 6 SD-5 3 727.68±170.17*** 0.859 1 AH-4 2 828.29±172.20*** 0.651 8 SD-6 3 106.85±190.25*** 0.716 0 AH-5 2 775.94±145.75*** 0.639 8 SD-7 3 517.59±212.81*** 0.810 7 AH-6 3 009.59±381.51*** 0.693 6 SD-8 3 420.88±185.40*** 0.788 4 AH-7 2 969.93±293.77*** 0.684 5 SD-9 3 517.62±96.50*** 0.810 7 AH-8 3 106.43±175.71*** 0.716 0 SX-0 3 047.15±245.61*** 0.702 3 AH-9 3 038.36±121.45*** 0.700 3 SX-1 2 851.14±204.25*** 0.657 1 HB-0 1 377.56±92.51* 0.317 5 SX-2 3 645.60±249.24*** 0.840 2 HB-1 1 642.74±125.77* 0.378 6 SX-3 3 070.68±207.62*** 0.707 7 HB-2 1 968.66±166.84*** 0.453 7 SX-4 3 128.37±265.48*** 0.721 0 HB-3 2 452.30±42.80*** 0.565 2 SX-5 2 997.77±163.36*** 0.690 9 HB-4 1 746.36±73.57** 0.402 5 SX-6 3 298.86±180.13*** 0.760 3 HB-5 1 627.55±71.58* 0.375 1 SX-7 2 646.34±131.61*** 0.609 9 HB-6 1 660.55±146.28* 0.382 7 SX-8 2 968.64±208.73*** 0.684 2 HB-7 2 796.96±166.09*** 0.644 6 SX-9 3 330.19±137.65*** 0.767 5 HB-8 1 703.48±102.88** 0.392 6 SC-0 1 791.65±103.90** 0.412 9 HB-9 2 265.96±69.39*** 0.522 2 SC-1 1 889.98±97.99*** 0.435 6 JS-0 3 288.80±211.57*** 0.758 0 SC-2 1 646.60±48.18* 0.379 5 JS-1 3 314.98±219.50*** 0.764 0 SC-3 1 930.13±104.80*** 0.444 8 JS-2 3 191.34±217.94*** 0.735 5 SC-4 1 868.08±38.43*** 0.430 5 JS-3 2 685.77±260.61*** 0.619 0 SC-5 1 691.94±62.10** 0.389 9 JS-4 2 712.32±251.85*** 0.625 1 SC-6 1 971.07±140.27*** 0.454 3 JS-5 3 501.32±200.67*** 0.807 0 SC-7 1 750.99±62.31** 0.403 6 JS-6 3 291.41±178.45*** 0.758 6 SC-8 1 653.62±56.56* 0.381 1 JS-7 3 538.82±422.36*** 0.815 6 SC-9 1 865.83±91.92*** 0.430 0 JS-8 3 285.78±273.40*** 0.757 3
3.4 PLSR 分析结果
中药指纹图谱与药效的谱效关系需要通过一定的数据处理才能实现,故选择适合的数据处理方法至关重要。PLSR 集相关分析、主成分分析、多元回归分析优势于一体,具有无须剔除样本、预测精度高、计算量小等特点,已逐渐成为中药谱效关系构建的主要数据处理方法[20-22]。本研究利用SPSSPRO在线数据分析软件,把丹参指纹图谱共有峰的相对峰面积作为自变量,斑马鱼相对心脏红细胞染色面积作为因变量,进行PLSR 分析。根据PLSR 原理,VIP 值越大表示其对因变量的解释能力越强。由分析结果可知,当主成分个数为t[5]时,累计的X方差为100%,代表对自变量信息的提取;累计的Y方差为60.2%,代表对因变量信息的提取;39 个共有峰中有18 个峰与抗血栓活性呈正相关,18 个峰中VIP>1 的成分有8 个,分别为峰1(二糖)、峰31(新隐丹参酮)、峰26(丹参醛)、峰34(隐丹参酮)、峰39(二氢隐丹参酮)、峰8(迷迭香酸)、峰18(4-甲基丹酚酸酯B 或异构体)和峰17(丹酚酸B),计算得到的模型系数和VIP 值,见图7。据此推测与丹参抗血栓活性最相关的化合物可能为二糖、新隐丹参酮、丹参醛、隐丹参酮、二氢隐丹参酮、迷迭香酸、4-甲基丹酚酸酯B 或异构体和丹酚酸B。先前的研究也报道了相关化合物的抗血栓作用,与本研究结论相一致。唐惠兰[23]通过分子对接技术筛选出了丹参中可能具有抗血栓效应的活性成分,包括丹酚酸B、迷迭香酸、紫草酸等,并发现它们可能都是通过多靶点发挥抗血栓效应;李丹丹等[24]研究发现西洋参、丹参组方中有16 个活性成分作用于血小板活化通路,包括隐丹参酮、新隐丹参酮等。
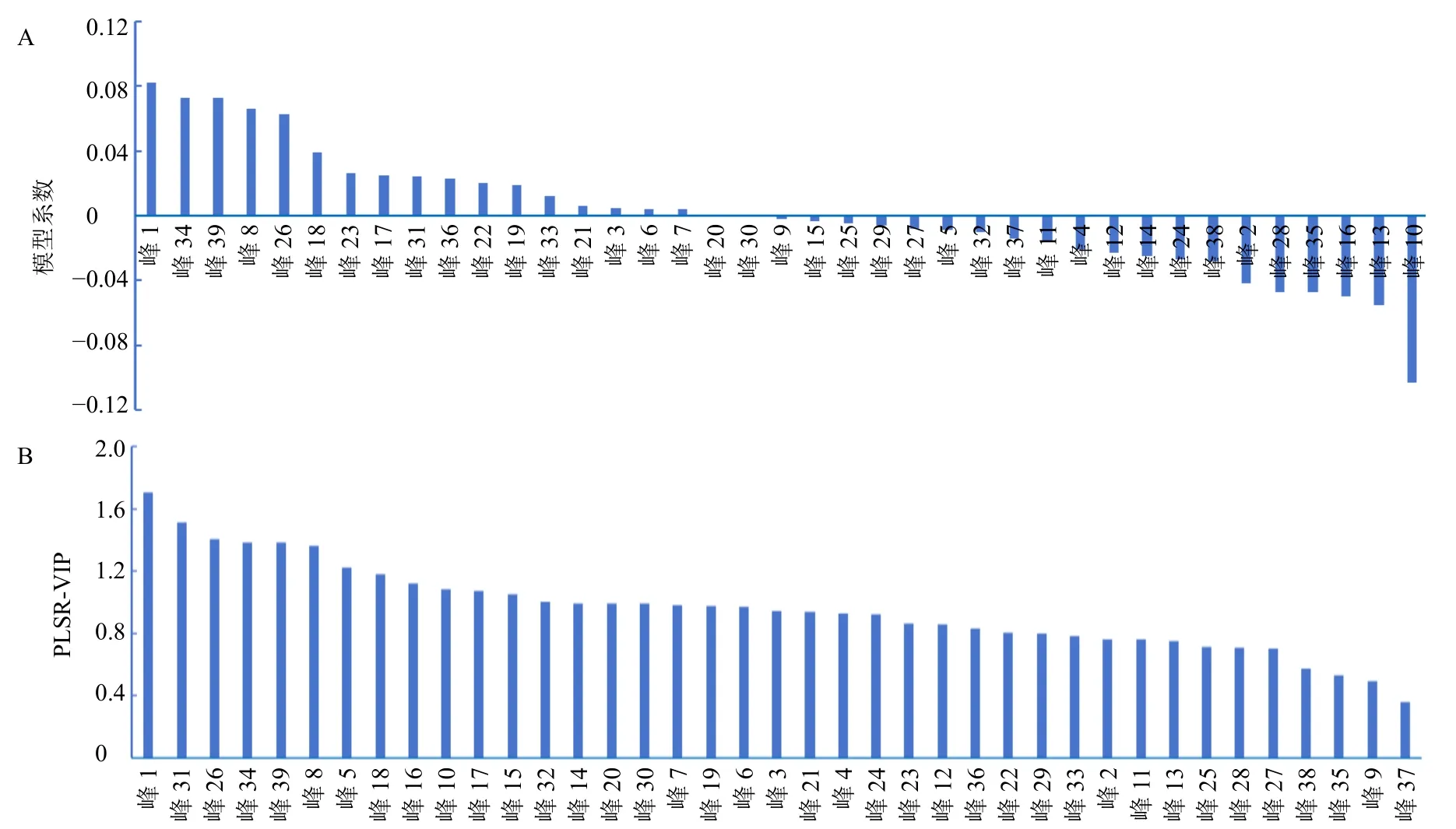
图7 PLSR 分析结果Fig.7 Results of PLSR analysis
4 讨论
4.1 斑马鱼血栓模型的特色优势
斑马鱼作为一种体外发育、胚胎透明的新型模式生物,具有给药方便、实验周期短、用药量少、可实现高通量筛选等优点,现已广泛应用于人类疾病模型的构建及中药活性成分的研究[25-27]等领域。人类与血栓形成相关的基因在斑马鱼中均存在,斑马鱼的血栓形成及凝血机制与人类相似[28-29],可以模拟人类血栓形成的过程,这为斑马鱼血栓模型的构建奠定了基础。史永平[30]利用AA 构建的斑马鱼血栓模型,发现了栀子中的3 个抗血栓关键化合物,其中包括以前未报道的新化合物。樊娇娇[31]选用盐酸肾上腺素构建的斑马鱼在体血栓模型,操作简便,结果准确,有利于中药抗血栓活性成分的筛选与研究。本课题利用AA 作为诱导剂构建的斑马鱼血栓模型,实验周期短,操作简便,检测指标客观可靠。
4.2 中药谱效学在丹参质量评价中的应用
丹参临床应用广泛,是常用的大宗药材。四川是丹参的道地产区,但山东的丹参产量最大,占全国丹参产量的50%以上[32]。此外河南、陕西、湖北、河北、安徽、山西、江苏、云南和贵州等地也在栽培,由于各产地的地理、气候、环境等因素,不同产地的丹参质量差异大[33],临床疗效不稳定,如何科学地评价丹参药材的质量一直是一个难题。2002年李戎等[34]首次提出了中药谱效学,该理论能较好地体现中医药整体观的理念[35],已经广泛应用于中药质量控制和评价的研究中。中药谱效学中的指纹图谱与药效需要通过一定的数据处理才能构建真正意义上的谱效关系,目前常用的数据处理方法有相关分析、灰色关联度分析、多元回归分析、PLSR 法、典型相关分析等[36]。王雅莉[37]采用典型相关分析将药效数据与丹参-红花药对液相图谱进行谱效相关分析,可快速、有效地筛选出丹参-红花药对中主要的活血成分,并利用斑马鱼血栓模型验证了药对中的抗血栓活性成分及谱效筛选的可行性。彭丽颖等[38]采用PLSR 法将丹参醇提物指纹图谱与抗氧化活性进行谱效相关分析,发现丹参中13 个共有成分对总抗氧化能力均有影响,符合中药多通路、多靶点的特点。
本研究为了更加全面地了解不同产地丹参样品的成分以及抗血栓疗效的差异,采用谱效学相关研究思路,结合HPLC-Q-Exactive-Orbitrap MS 技术的优势,借助OPLS-DA,寻找不同产地丹参样品的差异化学成分;为了进一步探讨丹参指纹图谱与抗血栓作用之间的关系,将丹参指纹图谱与抗血栓药效指标相关联,采用PLSR 分析,较大程度地反映了各成分对药效的贡献作用。接下来将整合谱效相关研究与分子对接技术,旨在进一步缩小物质基础范围,从构效关系层面揭示活性成分可能发挥药效的作用机制,对整合研究获得的药效物质进行抗血栓活性验证,进一步挖掘丹参抗血栓活性的质量标志物。
利益冲突所有作者均声明不存在利益冲突