黄芩汤治疗蓖麻油致小鼠腹泻的作用及机制研究
陈文露 ,彭新宇,康桦华,潘育方,唐兴刚,蒋顺进,黄炜乾,丁焕中,黄 婷 ,徐志宏
1.广东省农业科学院动物卫生研究所,广东 广州 510640
2.惠东县人民医院,广东 惠州 516399
3.广东药科大学,广东 广州 510006
4.广东容大生物股份有限公司,广东 清远 511517
5.华南农业大学,广东 广州 510642
6.仲恺农业工程学院 动物科技学院,广东 广州 510225
腹泻是指大便频次增多,粪便呈半流质或水样,伴有腹部胀满、腹痛等症状的一种消化系统疾病[1]。急性腹泻在发展中国家仍与发病率和死亡率增加有关,而用于治疗腹泻的抗生素常导致耐药性和菌群失调,因此,由于中药止泻具有较低的不良反应和良好的功效,越来越受到研究者的关注。
目前,腹泻模型有细菌[2]、降钙素基因相关肽(calcitonin gene-related peptide,CGRP)[3]、脂多糖[4]和蓖麻油[4]诱导的腹泻模型。研究表明,水通道蛋白(aquaporins,AQPs)、Na/H 离子交换器(Na/H exchangers,NHEs)和急性期蛋白(acute phase proteins,APPs)的水平与蓖麻油致腹泻相关,肠道的关键功能是吸收水分[5],APPs 控制肠道内的跨上皮液运输[6]。AQP3 和AQP4 在小鼠肠道内定位,在腹泻时下调[7-9],可能影响水分吸收。目前已知10 种哺乳动物NHEs 亚型,其中NHE1、NHE2、NHE3和NHE8 在肠上皮[10]中已被鉴定,均在细胞膜刷缘区高表达[11],NHE3 为主要亚型[12]。NHE3 缺陷小鼠Na+吸收缺陷,酸碱失衡[13],导致自发性轻度腹泻和酸中毒[14]。NHE8 对Na+吸收也至关重要[15],可以维持肠内的黏膜稳态[16]。NHE2 的破坏改变了黏液层的酸性分泌,减少肠壁和原酶细胞的数量,影响肠道屏障恢复[17]。包括α-1-酸性糖蛋白(α-1-acid glycoprotein,AGP)、转铁蛋白(transferrin,TRF)、白蛋白(albumin,ALB)和、C 反应蛋白(Creactive protein,CRP)在内的APPs 主要由肝细胞合成,是创伤、感染、应激、肿瘤和炎症所触发的先天急性期反应的一部分[18-19]。
肠道菌群是一个密集多样的生态系统,涉及生理和病理过程。一方面,正常的肠道菌群通过帮助新陈代谢、排除毒素和维持肠道屏障功能来影响宿主的健康。另一方面,肠道菌群失调涉及多种疾病和炎症反应[20-28]。黄芩汤由黄芩、芍药、甘草和红枣组成[29],最早出现在中医论著《伤寒论》中,主要用于治疗胃肠道疾病如腹泻、腹部痉挛、发热、头痛、呕吐、恶心、极度口渴、心脏下胀等。多年的临床治疗经验表明,黄芩汤治疗胃肠道疾病安全有效。研究发现,黄芩汤可减少癌症治疗相关的毒性的影响[30-31],可以通过激活Wnt 通路来修复损伤肠道上皮细胞,并通过下调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、环氧化酶-2(cyclooxygenase-2,COX-2)和核因子-κB(nuclear factor-κB,NF-κB)缓解炎症[27]。然而,黄芩汤的止泻机制尚不明确。因此,本研究从肠道菌群、APPs、AQPs、NHEs 的肠道表达等方面评价了黄芩汤对蓖麻油致腹泻的影响。
1 材料
1.1 动物
SPF 级昆明小鼠60 只,雌雄各半,3~4 周龄,体质量18~20 g,购自济南朋悦实验动物繁育有限公司提供,许可证号SCXK(鲁)20140007。动物在温度(23.0±1.5)℃、相对湿度(50±15)%环境下饲养。动物实验经广东省农业科学院动物卫生研究所动物伦理委员会批准(批准号20180107003)。
1.2 药材
黄芩、芍药、甘草和红枣(批号分别为20170911、20180506、20180620、20180523)购自广东省广州市大参林药店,经广东药科大学中医学院程轩轩教授分别鉴定为唇形科植物黄芩ScutellariabaicalensisGeorgi 的干燥根、毛茛科植物芍药PaeonialactifloraPall.的干燥根、豆科植物甘草GlycyrrhizauralensisFisch.的干燥根和根茎、鼠李科植物枣ZiziphusjujubaMill.的干燥成熟果实。
1.3 药品与试剂
对照品黄芩苷(批号P16S8F44143)、黄芩素(批号CO2A6Y1)、汉黄芩苷(批号P09J8F28374)购自上海源叶生物技术有限公司,质量分数均≥98%;对照品芍药苷(批号17031901,质量分数为99.3%)、甘草酸铵(批号17060510,质量分数为99.45%)购自北京恒元启天化工技术研究院;盐酸洛哌丁胺胶囊(批号20170820)购自西安杨森制药有限公司;蓖麻油(批号151111)购自湖北科田药业有限公司;中性通用型组织固定液(批号YP184305)、Trizol 溶液(批号182805)、HRP 标记的山羊抗兔IgG 二抗(批号GB23303)购自武汉塞维尔生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒(批号10247)购自日本TaKaRa 公司;RNase-Free Water(批号EC05BA0039)购自上海生工生物工程技术服务有限公司;NHE8 兔抗(批号24K4519)购自Affinity 公司;APQ3 兔抗(批号CPA4133)购自Cohesion Biosciences 公司;GAPDH小鼠单抗(批号KC-5G4)购自上海康成生物工程有限公司;HRP 标记的羊抗小鼠IgG 二抗(批号BA1050)购自武汉博士德生物工程有限公司;DNA抽提试剂盒(批号CLS-D6382-01)购自美国Bio Tek公司。
1.4 仪器
Agilent 1260 型超高液相色谱仪(美国Agilent公司);XS 型十万分之一电子天平(瑞士梅特勒-托利多公司);DS-FI2 型显微镜(日本Nikon 公司);Epoch 2 型超微量分光光度计、EL800 型酶标仪(美国Bio Tek 公司);TBS380 型微型荧光计(美国Turner Biosystems 公司);Light Cycle 480 型高通量实时荧光定量PCR 仪(瑞士罗氏公司);5418 型高速离心机(德国Eppendorf 公司);DW-86W420 型低温冰箱(青岛海尔特种电器有限公司);HISEQ 型测序仪(美国Illumina 公司)。
2 方法
2.1 黄芩汤制备和质量控制
2.1.1 黄芩汤的制备 经UPLC 检测本研究所用药材黄芩中黄芩苷质量分数为13.19%,白芍中芍药苷质量分数为3.1%,甘草中甘草酸铵质量分数为2.29%,符合《中国药典》2020 年版规定。称取黄芩90 g、芍药60 g、甘草60 g、红枣60 g,加入15倍量的水煮沸2 h,滤过;残渣再加入10 倍量的水煮沸提取1 h,滤过。合并2 次提取液,浓缩至1 g/mL,冷却至4 ℃。
2.1.2 黄芩汤的质量控制
(1)对照品溶液的制备:分别称定芍药苷、黄芩苷、汉黄芩苷、黄芩素和甘草酸铵0.020 5、0.020 5、0.010 0、0.010 1、0.010 3 g 于10 mL 量瓶中,用甲醇溶解即得对照品储备液。取对照品储备液,稀释制备系列梯度质量浓度的对照品溶液,芍药苷质量浓度为40、60、80、100、120 mg/mL,黄芩苷质量浓度为120、140、160、200、220 mg/mL;黄芩素质量浓度为10、30、50、70、90 mg/mL,汉黄芩苷质量浓度为8、10、20、40、80 mg/mL,甘草酸铵质量浓度为20、40、60、80、100 mg/mL。
(2)色谱条件:Poroshell 120 EC-C18色谱柱(100 mm×3 mm,2.7 μm),流动相为0.2%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~4 min,90% A;4~5 min,90%~80% A;5~15 min,80%~50% A;15~16 min,50%~0 A;16~17 min,0~90% A。体积流量0.6 mL/min;柱温40 ℃;检测波长230 nm。
(3)样品检测:黄芩汤提取物用蒸馏水稀释至0.02 g/mL,经0.22 μm 膜滤过,按照色谱条件进样检测。
2.2 分组、造模及给药
小鼠适应性饲养7 d 后,随机分为对照组、模型组、洛哌丁胺(5 mg/kg)组和黄芩汤高、中、低剂量(20、10、5 g/kg)组,每组10 只。给药组ig相应药物,对照组和模型组ig 等体积的生理盐水,1 次/d,连续3 d。第2 天晚上给药后小鼠禁食不禁水,第3 天给药30 min 后,除对照组外其余小鼠ig 0.5 mL 蓖麻油制备腹泻模型。
2.3 腹泻评分和腹泻指数的测定
造模后,将小鼠放在不同的笼子里(每笼1 只),在滤纸上收集粪便,计算腹泻评分和腹泻指数。腹泻评分:正常便0 分,半固体便2 分,水样便3 分。稀便等级:稀便直径小于1 cm 为1 级,直径为1.0~1.9 cm 为2 级,直径为2.0~3.0 cm 为3 级,直径>3.0 cm 为4 级。
稀便率=小鼠稀便次数/小鼠总排便次数
稀便级数=稀便等级数之和/稀便次数
腹泻指数=稀便率×稀便级数
2.4 qRT-PCR 检测肝脏AGP、ALB、TRF、CRP和小肠NHE2、NHE3、NHE8、AQP3、AQP4 基因表达
造模4 h 后小鼠安乐死,取小鼠肝脏和小肠。按照试剂盒说明书提取总RNA 并合成cDNA,进行qRT-PCR 分析。引物序列见表1。

表1 引物序列Table 1 Primer sequences
2.5 免疫组化检测小肠NHE8 和AQP3 蛋白表达
取各组小肠组织,于4%多聚甲醛中固定,石蜡包埋,切成4 µm 切片。3%牛血清白蛋白封闭后,滴加AQP3(1∶800)、NHE8(1∶100)抗体孵育,PBS 洗涤后,滴加二抗室温孵育5 min,DAB 显色、示苏木素染色后,脱水、透明、封片,于显微镜下观察并拍照。
2.6 Western blotting 检测小肠NHE8 和AQP3 蛋白表达
取各组小肠组织,剪碎后加入RIPA 裂解液提取蛋白。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于5%脱脂牛奶中封闭,分别加入NHE8、AQP3 抗体孵育,洗涤后加入二抗孵育,用全自动凝胶成像分析系统采集条带。
2.7 16S rRNA 基因测序
2.7.1 16S rRNA 的提取和扩增 取各组小肠组织,根据E.Z.N.A.®soil 试剂盒说明书进行总DNA 抽提,用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)对V3~V4 可变区进行PCR 扩增,扩增程序:95 ℃预变性3 min,95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s(27 个循环),72 ℃延伸10 min。
2.7.2 Illumina Miseq 测序 采用2%琼脂糖凝胶电泳回收PCR 产物,利用AxyPrep DNA Gel Extraction试剂盒对产物进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用微量荧光计进行定量分析。根据Illumina MiSeq 平台标准操作规程将纯化后的扩增片段构建PE 2*300 的文库。构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR 扩增进行文库模板的富集;(4)氢氧化钠变性,产生单链DNA 片段。送至上海美吉生物医药科技有限公司进行测序分析。
2.8 统计学分析
采用Spass 23 软件进行统计分析,组间差异比较用单因素方差(One-way ANOVE)分析,采用GraphPad Prism 7 软件作图。
3 结果
3.1 黄芩汤的成分分析
以芍药苷、黄芩苷、黄芩素、汉黄芩苷、甘草酸铵为对照品,采用UPLC 对黄芩汤的成分进行分析。对照品和黄芩汤样品的色谱图见图1,峰面积(Y)与质量浓度(X)呈线性关系(表2),表明芍药苷、黄芩苷、黄芩素、黄芩苷、甘草酸铵在各自的质量浓度范围内线性关系良好。作为黄芩汤的主要成分,芍药苷来源于芍药,而黄芩苷、黄芩素、汉黄芩苷来源于黄芩,甘草酸铵来源于甘草。1 kg黄芩汤药材可提取干燥成93 g 提取物粉末,芍药苷、黄芩苷、汉黄芩苷、黄芩素和甘草酸铵质量浓度分别为100.32、186.51、69.89、25.05、61.26 µg/mL。

图1 对照品 (A) 和黄芩汤 (B) 的UPLC 色谱图Fig.1 UPLC chromatograms of reference substance (A)and Huangqin Decoction (B)

表2 各成分的回归方程、线性范围和相关系数Table 2 Regression equations, linear ranges and correlation coefficients for each component
3.2 黄芩汤对腹泻小鼠腹泻指数和腹泻评分的影响
如图2 所示,与对照组比较,模型组小鼠腹泻指数和腹泻评分明显升高(P<0.05);与模型组比较,各给药组小鼠腹泻指数和腹泻评分均显著降低(P<0.05)。

图2 黄芩汤对腹泻小鼠腹泻指数和腹泻评分的影响 (±s , n = 5)Fig.2 Effect of Huangqin Decoction on diarrhea index and diarrhea score in diarrhea mice (±s , n = 5)
3.3 黄芩汤对腹泻小鼠肝脏AGP、ALB、TRF、CRP和小肠NHE2、NHE3、NHE8、AQP3、AQP4 基因表达的影响
如图3 所示,与对照组比较,模型组小鼠肝脏中CRP和AGPmRNA 表达水平明显升高(P<0.05),TRFmRNA 表达水平明显降低(P<0.05);与模型组比较,黄芩汤低剂量组CRPmRNA 表达水平显著降低(P<0.05),洛哌丁胺组和黄芩汤中、高剂量组AGPmRNA 表达水平显著降低(P<0.05)。

图3 黄芩汤对腹泻小鼠肝脏CRP、AGP、ALB 和TRF 基因表达的影响 (±s, n = 5)Fig.3 Effect of Huangqin Decoction on CRP, AGP, ALB and TRF gene expressions in liver of diarrhea mice (±s , n = 5)
如图4 所示,与对照组比较,模型组小鼠小肠中AQP3、NHE3和NHE8mRNA 表达水平均明显升高(P<0.05),AQP4mRNA 表达水平明显降低(P<0.05);与模型组比较,洛哌丁胺组和黄芩汤中、高剂量组AQP3mRNA 表达水平显著降低(P<0.05)。黄芩汤各剂量组NHE8mRNA 表达水平显著降低(P<0.05)。
3.4 黄芩汤对腹泻小鼠小肠AQP 和NHE83 蛋白表达的影响
如图5 所示,免疫组化验证了AQP3 和NHE8在肠道的特异性定位表达。如图6 所示,与对照组比较,模型组AQP3 和NHE8 蛋白表达水平均显著升高(P<0.05);与模型组比较,各给药组AQP3 和NHE8 蛋白表达水平均显著降低(P<0.05),与“2.3”项下结果一致。

图5 免疫组化检测AQP3 和NHE8 在小肠上皮细胞绒毛中的定位Fig.5 Localization of AQP3 (A) and NHE8 (B) in villi of small intestinal epithelial cells by immunohistochemistry

图6 Western blotting 检测小肠AQP3 和NHE8 蛋白表达 (±s, n = 5)Fig.6 AQP3 and NHE8 protein expressions in small intestine by Western blotting (±s , n = 5)
3.5 黄芩汤对腹泻小鼠肠道菌群的调节作用
采用Shannon 指数和ACE 指数测定肠道菌群α 多样性(均匀度和丰富度)。如图7 所示,黄芩汤低、高剂量组Shannon 指数显著低于对照组(P<0.05)。各组ACE 指数无显著差异。主坐标分析结果(图8)显示,黄芩汤各剂量组与模型组、对照组差异显著,而洛哌丁胺组与模型组相似。

图7 各组肠道菌群的α 多样性 (±s, n = 5)Fig.7 Alpha diversity of gut microbiota in each group (±s, n = 5)
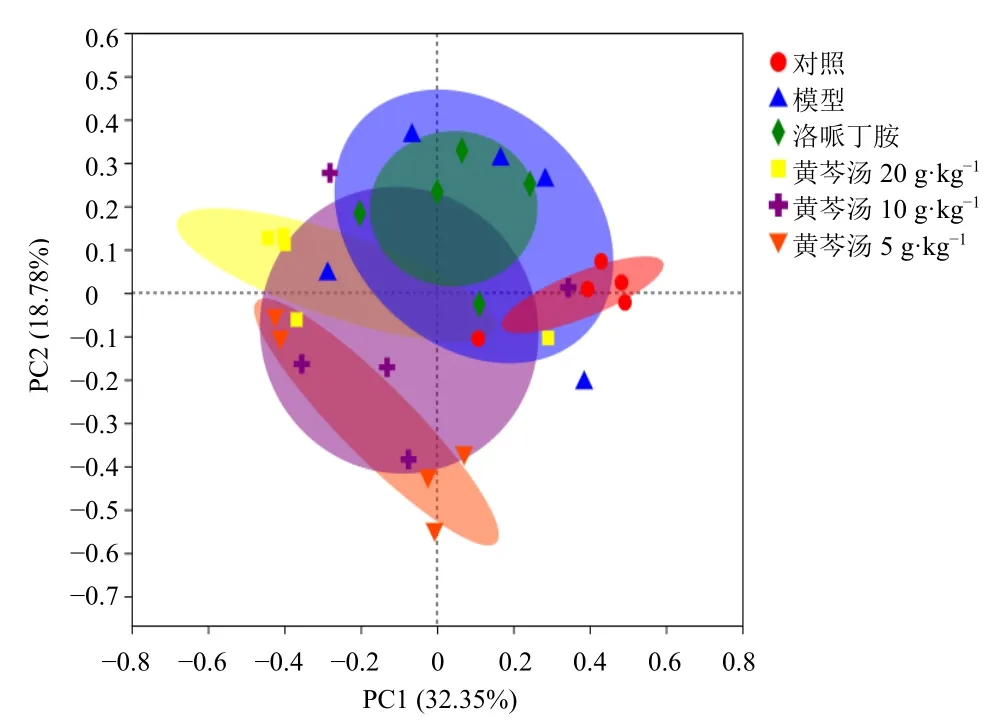
图8 各组小鼠肠道菌群的主坐标分析Fig.8 Principal co-ordinates analysis of gut microbiota in each group of mice
如图9-A 所示,各组小鼠肠道菌群优势菌门为变形杆菌门( Proteobacteria )、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)。与模型组比较,黄芩汤各剂量组和洛哌丁胺组厚壁菌门丰度降低,黄芩汤高剂量组和洛哌丁胺组放线菌门丰度降低,黄芩汤中、低剂量组放线菌门丰度升高,黄芩汤低、高剂量组和洛哌丁胺组厚壁菌门与拟杆菌门比值(F/B)降低。

图9 各组小鼠门 (A) 和属 (B) 水平肠道菌群丰度 (±s, n = 5)Fig.9 Abundance of gut microbiota at phylum (A) and genus (B) levels in each group of mice (±s , n = 5)
如图9-B 所示,各组小鼠肠道菌群优势菌属为Candidatus_Arthromitus、乳杆菌属Lactobacillus、粪杆 菌 属Faecalibaculum、棒 状 杆 菌 属Corynebacterium_1、双歧杆菌属Bifidobacterium、螺杆菌属Helicobacter和气球菌属Aerococcus。与模型组比较,各给药组双歧杆菌属、粪杆菌属和Ruminococcaceae_UCG-014 丰度降低;黄芩汤低剂量组Facklamia、Jeotgalicoccus和Corynebacterium_1 丰度升高,乳杆菌属和unclassified_p_Firmicutes丰度降低;黄芩汤高剂量组 unclassified_p_Firmicutes 和Candidatus_Arthromitus丰度升高;黄芩汤中剂量组 unclassified_p_Firmicutes 和Psychrobacter丰度升高。
4 讨论
蓖麻油及其活性成分蓖麻油酸能够降低小肠和结肠对Na+和K+的吸收,降低Na+、K+ATP 酶活性,改变肠道通透性,从而引起小鼠腹泻[32],同时会伴随肠绒毛大量坏死、脱落,杯状细胞生成量减少,随着内层黏液消耗殆尽抗菌屏障被破坏,小鼠肠道菌群稳态被破坏[33]。蓖麻油腹泻模型模拟了小鼠在经过肠炎腹泻中的生理变化,有利于研究黄芩汤在炎症腹泻过程中药理作用研究。
本研究发现,黄芩汤可通过调节小鼠小肠内Na+/H+交换剂和水通道蛋白来缓解小鼠腹泻。黄芩汤下调上皮细胞AQP3和NHE8的mRNA 和蛋白表达,下调急性期蛋白AGPs、CRP的mRNA 表达。与对照组比较,模型组AQP4和TRFmRNA 表达水平明显降低,NHE3mRNA 表达水平明显升高,但黄芩汤对AQP4、TRF、NHE3mRNA 表达均无明显调节作用,这可能由于腹泻诱导和组织剥离之间的时间窗太短。
通过16S rRNA 基因测序发现,蓖麻油诱导的腹泻小鼠肠道菌群显著改变,这可能作为肠道健康的潜在生物标志物。而黄芩汤部分逆转了这一改变。厚壁菌门和拟杆菌门是主要的肠道菌群门,可以调节宿主炎症和免疫状态[34]。厚壁菌门是宿主代谢的关键因素[35],但其在肠道内的过度生长会导致脂多糖等代谢内毒素的产生,这些内毒素会进入血流,引发炎症[36]。而拟杆菌门则减少了肠道和全身的炎症反应[37-38]。因此,F/B 值升高提示自身免疫性疾病具有促炎环境和免疫失衡的特征。蓖麻油升高F/B 值,洛哌丁胺和黄芩汤有降低F/B 值的作用。
黄芩汤显著降低粪杆菌属的相对丰度[39-41]。本研究结果显示,黄芩汤降低双歧杆菌属、粪杆菌属、Ruminococcaceae_UCG-014 和 unclassified_p_Firmicutes 的相对丰度,影响了小肠微生物群的组成。双歧杆菌是人类胃肠道的主要有益共生体[42],Ruminococcaceae_UCG-014 通过分泌大量的复合酶帮助机体消化吸收纤维素的能量[43]。在黄芩汤高剂量组中,具有调节宿主免疫系统的Candidatus_Arthromitus的相对丰度增加[44],而在黄芩汤中、低剂量组中未发现这种现象。黄芩汤低剂量组Facklamia、Jeotgalicoccus和Corynebacterium_1 的相对丰度增加,黄芩汤中剂量组Psychrobacter的相对丰度增加。Jeotgalicoccus对人体健康有着至关重要的作用,可能是肠道菌群的核心功能群之一[45]。Facklamia、Corynebacterium_1 和Psychrobacter在以往研究[46-49]中均有提及,但未对其在腹泻模型中的作用进行解释。因此,这些菌群的改变与黄芩汤抗腹泻作用的关系尚不清楚。基于以上结果,推测黄芩汤可能通过降低双歧杆菌属和Ruminococcaceae_UCG-014 的相对丰度,并增加Candidatus_Arthromitus和Jeotgalicoccus的相对丰度,从而平衡小鼠的肠道健康。本研究结果为腹泻的分子机制和肠道菌群的研究提供了新的思路,为黄芩汤的临床应用提供了实验依据。然而,临床腹泻的发病机制复杂,黄芩汤的作用机制需要在不同病因的腹泻模型中进行验证分析。
综上,在蓖麻油致腹泻模型中,黄芩汤具有明显的止泻作用。可以通过降低AQP3和NHE8的mRNA 和蛋白表达,降低肠道菌群F/B 值,来缓解腹泻症状。本研究揭示了黄芩汤在微生态系统中的其他变化,如高剂量黄芩汤增加了Candidatus_Arthromitus的相对丰度,这与肠上皮的免疫活性有关。低剂量黄芩汤增加了Jeotgalicoccus的相对丰度,对肠道健康起着重要的作用。
利益冲突所有作者均声明不存在利益冲突