白术水提物对肥胖小鼠血管稳态失衡的影响
陈钰岚,魏柯健,刘 静,郭静妍,吕圭源,苏 洁
浙江中医药大学 药学院,浙江 杭州 310053
据国家卫生健康委员会发布的《中国居民营养与慢性病状况报告(2020 年)》显示,我国超重肥胖的成年居民超过50%[1]。肥胖导致血管阻力增加,导致血管稳态失衡[2]。血管稳态的失衡与重构机制涉及代谢、氧化应激、炎症等,其中能量代谢是血管重构的关键机制之一[3]。腺苷酸激活蛋白激酶(adenylate-activated protein kinase,AMPK)信号通路与线粒体功能关系密切,为改善线粒体功能的关键途径[4]。
中医学认为血脉稳态失衡是多种病机作用下的慢性、长程的病理改变,其中血管稳态失衡以气虚和火热为本[5]。气虚见于多脏功能不足,而脾胃为气血生化之源,是气机升降的枢纽,主运化与统血[6],故推测血管稳态失衡与脾胃气虚有关。脾胃气虚的首要原因为过食肥甘[7],过食肥甘者常见倦怠乏力、口渴少饮、五心烦热等临床表现[8],与“阴火”患者的临床表现相似,阴火证是以脾胃气虚为主和火热亢盛为次的证候群[9],故认为肥胖与阴火证密切相关。李东垣治疗阴火证以“甘温除热”“益气升阳”为主,补中益气,健运中焦[10]。白术为菊科植物白术AtractylodesmacrocephalaKoidz.的干燥根茎,味甘,性温,归脾、胃经,具有健脾益气、燥湿利水的功效[11]。同时现代临床发现,白术能影响机体内脂质代谢转运,调节血脂紊乱[12],因此,白术或可治疗肥胖所致的血管稳态失衡。本研究通过高糖高脂饲料的肥胖小鼠,结合各药效指标综合评价白术水提物对肥胖相关中医证候表现影响,并探讨其对肥胖小鼠主动脉血管稳态的作用机制。
1 材料
1.1 动物
SPF 级雄性ICR 小鼠40 只,6~8 周龄,购自上海市计划生育科学研究所实验动物经营部,许可证号 SCXK ( 沪) 2018-0006,合格证号20180006023028。饲养环境温度20~25 ℃,相对湿度40%~65%,光照时间12 h/d,循环通风换气。动物实验经浙江中医药大学实验动物管理与伦理委员会批准(批准号ZSLL-2016-118)。
1.2 药材
麸炒白术饮片(批号202007069)购自浙江钱王中药有限公司,经浙江中医药大学朱波副教授鉴定为菊科植物白术A.macrocephalaKoidz.的干燥根茎。
1.3 药品与试剂
依折麦布片(批号W018665)购自杭州默沙东制药有限公司;高糖高脂饲料(由20.0%蔗糖、15%猪油、0.8%胆固醇、0.2%胆酸钠及适量的酪蛋白、磷酸氢钙、石粉等组成,批号20220923、20221126)购自南通特洛菲饲料科技有限公司;对照品白术内酯III(批号22010404,质量分数为99.98%)、白术内酯IV(批号20091003,质量分数为99.56%)购自成都普菲德生物技术有限公司;低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)试剂盒(批号220811301)购自美康生物科技股份有限公司;总胆固醇(total cholesterol,TC)试剂盒、一氧化氮(nitric oxide,NO)试剂盒(批号分别为20230104、20230424)均购自南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒、内皮素1(endothelin-1,ET-1)试剂盒(批号分别为202301、23021460)均购自江苏酶免实业有限公司;Toll 样受体4(Toll-like receptor 4,TLR4)抗体、沉默信息调节因子2 相关酶1(silent mating type information regulation 2 homolog 1,SIRT1)抗体(批号分别为00105090、00130130)均购自武汉三鹰生物技术有限公司;TNF-α 抗体(批号B8905)购自苏州睿瀛生物技术有限公司;白细胞介素-6(interleukin-6,IL-6)抗体(批号HH0827)购自杭州华安生物技术有限公司;磷酸化AMPK(p-AMPK)抗体(批号16)购自美国CST 公司;过氧化物酶体增殖物激活受体γ 辅激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)抗体、AMPK 抗体(批号分别为M27MA02、L220C04)购自成都正能生物技术有限责任公司。
1.4 仪器
SENCO R-501 型旋转蒸发器(上海申顺生物科技有限公司);FA2204B 型电子天平(上海精科天美科学仪器有限公司);1200 型高效液相色谱仪(美国Agilent 公司);TBA40-FR 型全自动生化分析仪(东芝三广医疗株式会社);EC360 型全自动包埋机(美康仪器设备制造高淳县有限公司);Tissue-Tek VIPTM 5Jr 型全封闭组织脱水机(日本樱花检验仪器株式会社);RM2245 型半自动切片机(德国Leica公司);HS-KP-G 型烤片机(沈阳恒松科技有限公司);Power wave 340 型酶标仪(美国Bio-Tek 公司);SCIENTZ-48 型高通量组织研磨器(宁波新芝生物科技股份有限公司);FLIR ONE Pro 型红外热像仪(美国FLIR 公司)。
2 方法
2.1 白术水提物中有效成分含量测定
2.1.1 白术水提物的制备 取麸炒白术粗粉500 g,加入20 倍量水,提取3 次,每次2 h,滤过,合并滤液,60 ℃减压浓缩至1 g/mL,4 ℃备用。临用前使用蒸馏水将其分别配制成质量浓度为0.2、0.4 g/mL 的溶液。
2.1.2 色谱条件 Ultimate XB-C18色谱柱(250 mm×4.6 mm,5 μm),流动相为0.1%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~20 min,50%~60% B;20~30 min,60%~70% B;30~35 min,70%~100%B;35~40 min,100% B;40~45 min,100%~50%B。体积流量1.0 mL/min;检测波长222 nm;柱温25 ℃;进样量10 μL。
2.1.3 混合对照品溶液的制备 精密称取白术内酯III、白术内酯II 对照品1.48、0.71 mg,置10 mL 棕色量瓶中,加甲醇溶解并稀释至刻度,密塞,摇匀,得白术内酯III、白术内酯II 质量浓度分别为148、71 μg/mL 的混合对照品溶液。
2.1.4 供试品溶液的制备 取1 g/mL 白术水提物,离心,过0.22 μm 滤膜,即得。
2.1.5 线性关系的考察 精密称取白术内酯III、白术内酯II 混合对照品,加甲醇制成系列梯度质量浓度的对照品溶液,以白术内酯III、白术内酯II 的质量浓度为横坐标(X),峰面积为纵坐标(Y)得到标准曲线,白术内酯III:Y=24.613 0X,r=0.999 8;白术内酯II:Y=30.902 0X+3.154 7,r=0.999 9。结果表明白术内酯III 在质量浓度2.312 5~74.000 0 μg/mL、白术内酯II 在质量浓度1.109 4~35.500 0 μg/mL 线性关系良好。
2.2 分组、造模与给药
40 只ICR 小鼠适应性喂养1 周后,按体质量随机分为正常组、模型组、依折麦布片(1 mg/kg,依折麦布片用蒸馏水配制成0.1 mg/mL 的溶液)组和白术水提物高、低剂量(4、2 g/kg)组。除正常组给予普通饲料外,其余各组每天给予高糖高脂饲料喂养,造模的同时分别ig 相应药物(10 mL/kg),正常组及模型组ig 等体积的蒸馏水,1 次/d,连续11 周。
2.3 体质量测定
于给药第0、3、6、9 周,称定小鼠体质量。
2.4 中医证候指标检测
2.4.1 排尿量 于给药11 周后,采用代谢笼下放置15 mL 离心管收集各组小鼠24 h 的新鲜尿液,计量尿液量。
2.4.2 尿液吸光度(A) 于给药11 周后,采用代谢笼收集小鼠新鲜尿液200 μL,用移液枪准确吸取“2.4.1”项下所得各组小鼠尿液200 μL,加于96 孔板上,并使用酶标仪在450 nm 下测定A值。
2.4.3 排便量 于给药11 周后,记录小鼠24 h 内排出的粪便粒数。
2.4.4 面温 于给药11 周后,安静环境下,用非接触式红外测温仪对准小鼠面部,当测温仪稳定后记录所测数据,测定3 次,取平均值。
2.4.5 足温 于给药9 周后,安静环境下,轻抓小鼠,采用热成像仪拍摄每组小鼠的热成像,通过FLIRTools 软件分析各组小鼠足温,并统计其平均值。
2.4.6 旷场实验 于给药10 周后,进行旷场实验。握住小鼠尾根部处,轻轻将小鼠放入蓝色立方形旷场箱的正中,开始同步录像、计时。旷场箱正上方安置摄像头,在安静无干扰并杜绝参照物的环境条件下进行,观察5 min 内小鼠活动情况。取出小鼠后,用毛巾蘸清水及低质量分数乙醇彻底擦拭箱底,并等待其挥发扩散,避免留有气味而干扰下只小鼠的观察结果。运用动物行为活动标记分析系统,对各组小鼠的行为进行分析评价。
2.4.7 舌象 于给药9 周后,将小鼠进行麻醉,使用单反相机拍摄小鼠舌头表面,并统计舌表的R 值、RGB 值。
2.5 尾部微循环检测
于给药11 周后,用异氟烷呼吸麻醉机对小鼠进行呼吸麻醉,使用Moor FLPI 扫描成像系统测定小鼠尾部微循环血流量。测量面积为尾部约1 cm2处的相同面积大小,检测时间30 s,扫描速度25 Hz/s。使用Moor FLPI Review 3.0 软件对所记录的数据进行处理。
2.6 血清TC、LDL-C 水平检测
末次给药后,各组小鼠眼眦取血,4 ℃凝血2 h,3 500 r/min 离心15 min,取上层血清,采用全自动生化分析仪检测TC、LDL-C 水平。
2.7 血清NO、TNF-α 和ET-1 水平检测
末次给药后,取各组小鼠血清,按照试剂盒说明书检测血清中NO、ET-1 和TNF-α 水平。
2.8 主动脉组织病理学观察
末次给药后,眼眦取血致死,取小鼠主动脉,放入盛有10%中性福尔马林缓冲液的瓶中。经固定、取材、脱水、包埋、切片,制得4 μm 石蜡切片,采用苏木素-伊红(HE)、Masson、Gomori 醛品红弹力纤维染色,中性树脂封片,干燥后于显微镜下观察主动脉组织病理变化。
2.9 免疫组化法检测主动脉中TLR4、IL-6、TNFα 的蛋白表达
取各组小鼠主动脉石蜡切片(4 μm),经过消除内源性过氧化氢酶活性、抗原修复、牛血清白蛋白封闭后,滴加TLR4、IL-6、TNF-α 抗体,4 ℃孵育过夜;滴加二抗,37 ℃孵育30 min;经DAB 显色、苏木素染色、乙醇脱水及中性树脂封片干燥后,于显微镜下观察TLR4、IL-6、TNF-α 蛋白的表达情况,并用Image J 软件进行分析。
2.10 免疫荧光检测主动脉p-AMPK、SIRT1 和PGC-1α 的蛋白表达
取各组小鼠主动脉石蜡切片(4 μm),经抗原修复、封闭、4 ℃孵育一抗过夜、孵育二抗、DAPI 核染,蔡司荧光正置显微镜下观察主动脉中p-AMPK、SIRT1、PGC-1α 的表达情况。
2.11 Western blotting 检测主动脉 p-AMPK、SIRT1 和PGC-1α 的蛋白表达
取各组小鼠主动脉组织,液氮充分研磨后,加入适量RIPA 裂解液,冰上静置10 min,离心取上清,提取组织蛋白。BCA 法测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,5%脱脂牛奶封闭2 h,分别加入p-AMPK、SIRT1、PGC-1α 抗体,4 ℃孵育过夜;PBST 洗膜3 次,每次15 min;加入二抗,室温孵育2 h;PBST洗膜3 次,每次15 min;加入ECL 化学发光液后,采用Modena 凝胶成像仪检测蛋白条带,并用Image J 软件进行分析。
2.12 统计学分析
3 结果
3.1 白术水提物中有效成分的测定
分别取混合对照品溶液和供试品溶液,分别按“2.1.2”项下色谱条件进样分析,记录色谱图(图1)。测得1 g/mL 白术水提物中白术内酯III、白术内酯II 的质量浓度分别为11.97、2.56 μg/mL。
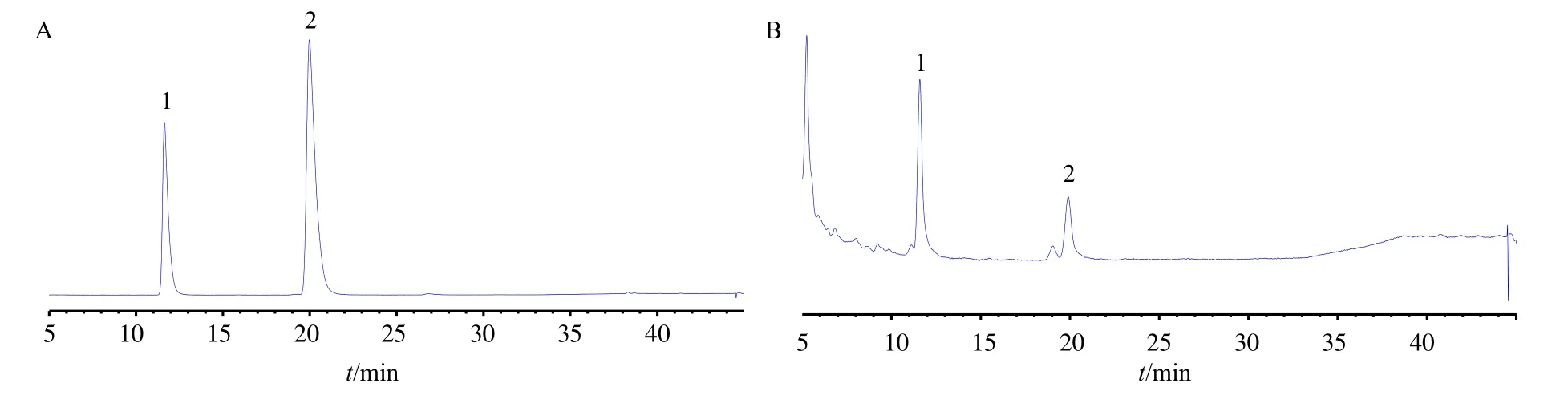
图1 混合对照品 (A) 和白术水提物 (B) 的HPLC 图Fig.1 HPLC chromatograms of mixed reference substance (A) and A.macrocephala water extract (B)
3.2 白术水提物对肥胖小鼠体质量的影响
如图2 所示,给药3、6、9 周后,与正常组比较,模型组小鼠的体质量显著升高(P<0.05、0.01);与模型组比较,各给药组小鼠的体质量均显著降低(P<0.01)。

图2 白术水提物对肥胖小鼠体质量的影响 (±s, n = 8)Fig.2 Effect of A.macrocephala water extract on body weight of obese mice (±s, n = 8)
3.3 白术水提物对肥胖小鼠中医证候指标的影响
3.3.1 对排尿量的影响 如图3-A 所示,与正常组比较,模型组小鼠的排尿量显著降低(P<0.01);给药11 周后,与模型组比较,各剂量白术水提物均能显著提高小鼠的排尿量(P<0.01)。

图3 白术水提物对肥胖小鼠中医证候指标的影响 (±s, n = 8)Fig.3 Effect of A.macrocephala water extract on TCM syndromes of obese mice (±s, n = 8)
3.3.2 对尿液A值的影响 如图3-B 所示,与正常组比较,模型组小鼠的尿液A值显著提高(P<0.01);给药11 周后,与模型组比较,各剂量白术水提物均能显著降低小鼠的尿液A值(P<0.01)。
3.3.3 对排便量的影响 如图3-C 所示,与正常组比较,模型组小鼠的排便量显著降低(P<0.01);给药11 周后,与模型组比较,白术水提物各剂量均能显著提高模型小鼠的排便量(P<0.01)。
3.3.4 对面温的影响 如图3-D 所示,与正常组比较,模型组小鼠的面温显著降低(P<0.01);给药11 周后,与模型组比较,各给药组均能显著升高小鼠的面温(P<0.01)。
3.3.5 对足温的影响 如图3-G、H 所示,与正常组比较,模型组小鼠的足温显著升高(P<0.01);给药9 周后,与模型组比较,各给药组均能显著降低小鼠的足温(P<0.01)。
3.3.6 对旷场的影响 如图3-E、F 所示,与正常组比较,模型组小鼠水平运动总距离显著减少(P<0.01),水平运动速度显著降低(P<0.01);给药10周后,与模型组比较,各给药组均能显著增加小鼠水平运动总距离和提高水平运动速度(P<0.01)。
3.3.7 对舌象的影响 如图4 所示,与正常组比较,模型组小鼠的舌色R 值、RGB 值均显著降低(P<0.01);给药9 周后,与模型组比较,各给药组均能显著提高小鼠的舌色R 值(P<0.01),各剂量白术水提物能显著升高小鼠的舌色RGB 值(P<0.01)。

图4 白术水提物对肥胖小鼠舌象的影响 (±s , n = 8)Fig.4 Effect of A.macrocephala water extract on tongue manifestation of obese mice (±s , n = 8)
3.4 白术水提物对肥胖小鼠尾部微循环的影响
如图5 和表1 所示,与正常组比较,模型组小鼠尾部微循环血流量显著降低(P<0.01);给药11周后,与模型组比较,各给药组均能显著增加小鼠尾部微循环血流量(P<0.05、0.01)。
表1 白术水提物对肥胖小鼠尾部微循环的影响(±s , n = 8)Table 1 Effect of A.macrocephala water extract on tail microcirculation of obese mice (±s , n = 8)

表1 白术水提物对肥胖小鼠尾部微循环的影响(±s , n = 8)Table 1 Effect of A.macrocephala water extract on tail microcirculation of obese mice (±s , n = 8)
组别 剂量/(g·kg−1) 尾部微循环血流量/PU正常 — 97.28±21.96模型 — 62.50±22.83##依折麦布片 0.001 84.82±29.10*白术水提物 4 94.64±19.15**2 88.04±8.25*

图5 白术水提物对肥胖小鼠尾部微循环的影响 (±s , n = 8)Fig.5 Effect of A.macrocephala water extract on tail microcirculation of obese mice (±s , n = 8)
3.5 白术水提物对肥胖小鼠血清LDL-C 和TC 水平的影响
如图6 所示,与正常组比较,模型组小鼠血清中LDL-C 和TC 水平均显著升高(P<0.01);与模型组比较,依折麦布片组和白术水提物(2 g/kg)组LDL-C 水平显著降低(P<0.01),各给药组小鼠血清中TC 水平均显著降低(P<0.01)。

图6 白术水提物对肥胖小鼠血清LDL-C 和TC 水平的影响 (±s , n = 8)Fig.6 Effect of A.macrocephala water extract on LDL-C and TC levels in serum of obese mice (±s , n = 8)
3.6 白术水提物对肥胖小鼠血清TNF-α水平的影响
如图7 所示,与正常组比较,模型组小鼠血清中TNF-α 水平显著升高(P<0.01);与模型组比较,各给药组均能显著降低小鼠血清中TNF-α 水平(P<0.01)。
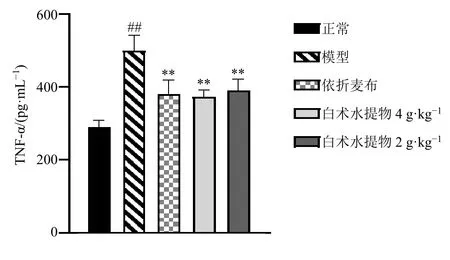
图7 白术水提物对模型小鼠血清TNF-α 水平的影响(±s , n = 8)Fig.7 Effect of A.macrocephala water extract on TNF-α level in serum of obese mice (±s , n = 8)
3.7 白术水提物对肥胖小鼠血清NO 和ET-1 水平的影响
如图8 所示,与正常组比较,模型组小鼠血清NO 水平显著降低(P<0.01),ET-1 水平显著升高(P<0.01);与模型组比较,各给药组均能显著升高小鼠血清NO 水平(P<0.05、0.01),显著降低小鼠血清ET-1 水平(P<0.01)。

图8 白术水提物对肥胖小鼠血清NO 和ET-1 水平的影响 (±s , n = 8)Fig.8 Effect of A.macrocephala water extract on NO and ET-1 levels in serum of obese mice (±s , n = 8)
3.8 白术水提物对肥胖小鼠主动脉组织形态学的影响
如图9 所示,HE 染色结果显示,与正常组比较,模型组小鼠中层平滑肌细胞增生且排列紊乱,存在内皮破裂;各剂量白术水提物均可缓解主动脉中膜增厚、血管平滑肌细胞排列紊乱状况。Masson染色结果显示,与正常组比较,模型组小鼠可见血管内胶原纤维沉积明显增多,胶原纤维面积显著增大;各剂量白术水提物均可使主动脉胶原沉积显著减小。Gomori 醛品红弹力纤维染色结果显示,与正常组比较,模型组小鼠弹力纤维断裂和增生,血管壁重构;与模型组比较,各剂量白术水提物均可缓解主动脉中弹力纤维断裂和增生状况。

图9 白术水提物对肥胖小鼠主动脉组织形态学的影响Fig.9 Effect of A.macrocephala water extract on aorta histomorphology of obese mice
3.9 白术水提物对肥胖小鼠主动脉TLR4、IL-6、TNF-α 蛋白表达的影响
如图10 所示,主动脉中TLR4、IL-6、TNF-α染色阳性产物表达在内皮细胞表面,呈棕黄色。与正常组比较,模型组小鼠主动脉中TLR4、IL-6、TNF-α 蛋白表达显著增加(P<0.01);与模型组比较,各给药组主动脉TLR4、IL-6、TNF-α 蛋白表达显著减少(P<0.01)。
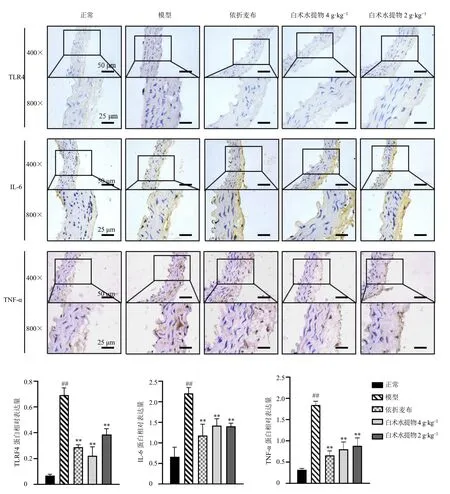
图10 白术水提物对肥胖小鼠主动脉TLR4、IL-6 和TNF-α 表达的影响 (±s , n = 3)Fig.10 Effect of A.macrocephala water extract on TLR4, TNF-α and IL-6 expression in aorta of obese mice (±s , n = 3)
3.10 白术水提物对肥胖小鼠主动脉AMPK、p-AMPK、SIRT1、PGC-1α 蛋白表达的影响
免疫荧光结果(图11)显示,主动脉中p-AMPK、SIRT1、PGC-1α 表达在内皮细胞表面。与正常组比较,模型组小鼠主动脉中p-AMPK、SIRT1、PGC-1α 绿色荧光表达减少;与模型组比较,白术水提物各剂量组主动脉p-AMPK、SIRT1、PGC-1α 绿色荧光表达增加。

图11 白术水提物对肥胖小鼠主动脉p-AMPK、SIRT1 和PGC-1α 蛋白表达的影响Fig.11 Effect of A.macrocephala water extract on p-AMPK, SIRT1 and PGC-1α protein expressions in aorta of obese mice
Western blotting 结果(图12)显示,与正常组比较,模型组小鼠主动脉中p-AMPK、SIRT1、PGC-1α 蛋白表达水平显著降低(P<0.05、0.01);与模型组比较,白术水提物(2 g/kg)组p-AMPK 蛋白表达水平显著升高(P<0.01),白术水提物各剂量组SIRT1 蛋白表达水平显著升高(P<0.05、0.01),白术水提物(4 g/kg)组PGC-1α 蛋白表达水平显著升高(P<0.01)。

图12 白术水提物对肥胖小鼠主动脉AMPK、p-AMPK、SIRT1 和PGC-1α 蛋白表达的影响 (±s , n = 4)Fig.12 Effect of A.macrocephala water extract on AMPK, p-AMPK, SIRT1 and PGC-1α protein expressions in aorta of obese mice (±s , n = 4)
4 讨论
中医学者认为,肥则碍胃、甘则滞脾。脾胃功能受损,可致气郁下焦或湿随气险郁于下焦,化火而上炎,火热伏于血脉,煎熬阴血,灼津为痰,血稠成瘀,瘀阻络脉,使脉道失于温养,经脉痉挛而病,加重瘀滞,进一步阻碍气血津液的代谢,同时体内痰瘀过久,加重脾胃亏虚的程度,最终导致血管稳态失衡的发生[13]。李东垣在《脾胃论·饮食劳倦所伤始为热中论》中指出:“脾胃气衰,元气不足,而心火独盛。心火者,阴火也”,故而脾胃失调,可致元气衰弱,营血不足,气火失调,君相不安,血中伏火,导致阴火的产生[9],此病机与肥胖引起的脾胃亏虚致血管稳态失衡的病机具有同一性。故而推测肥胖可致脾胃虚弱,而使机体产生阴火,损伤血管,并表现出相关证候,影响健康。
阴火证以脾胃气虚为主和火热亢盛为次,脾胃气虚常见口淡不渴、倦怠乏力、排便无力,其舌脉为舌淡或伴齿痕、苔薄白,脉弱无力[14]。火热亢盛以发热、口渴饮冷、胸腹灼热、面红目赤、大便秘结、小便短黄为常见症[15]。本研究以排尿量量化“口淡不渴”,尿液A值量化“小便短黄”,排便量量化“排便无力”,面部温度和足部温度量化“发热”,旷场实验量化“倦怠乏力”,舌象量化“舌淡”。李东垣主张补脾胃、升阳气、祛湿热、畅气机以散阴火,白术为菊科多年生草本植物白术的干燥根茎,具有健脾益气、燥湿利水、止汗的功效,临床多用于脾气虚弱、运化失常所致的脘腹胀满、倦怠乏力等证,为“健脾补气第一要药”[16],历代古籍中均有记载。《本草经疏》记载:“术,其气芳烈,其味甘浓,其性纯阳,为除风痹之上药,安脾胃之神品”;《本草通玄》记载:“白术,补脾胃之药,更无出其右者。土旺则能健运,故不能食者,食停滞者,有痞积者,皆用之也”。白术健脾胃、祛湿热,或可缓解过食肥甘所导致的气虚和火热。本研究发现白术水提物可显著提高肥胖小鼠旷场水平移动总距离和水平移动速度,显著提高排便量和排尿量,降低尿液A值,升高面温,降低足温,改善舌象变化,证明白术水提物能够有效改善肥胖小鼠倦怠乏力、排便无力、四肢烦热等证候,并推测此功效可能由改善阴火的途径而发挥。
研究表明,脂代谢紊乱和肥胖是血管稳态失衡的常见病因,脂质氧化功能降低,导致脂肪酸代谢物的累积,使体内TC、LDL-C 水平升高,出现血脂代谢异常[17],继而引发血管内皮细胞损伤以及弹力纤维的异常生长、增殖等血管稳态失衡[18]。同时脂代谢紊乱可激活TLR4 信号通路,TLR4 信号被激活后,向下游发出信号,下游因子通过经典途径转移到细胞核中激活一系列炎症基因如IL-6、TNFα,并促进其含量增加和释放[19]。TNF-α 表达增加,促进巨噬细胞浸润,诱导ET-1 生成[20],同时IL-6表达增加,减弱内皮细胞中NO 信号通路,抑制NO生成,导致ET-1/NO 系统失衡[21-22],NO 利用率减少,舒张血管作用减弱,平滑肌收缩,血管内皮功能受损,加重血管稳态失衡。
能量代谢作为血管重构的关键机制之一,在维持血管稳态的过程中起到重要作用。PGC-1α 为调节线粒体功能的关键因子[23],研究发现,AMPK 可以激活SIRT1 乙酰化,增加PGC-1α 的活性,缓解线粒体损伤,提高线粒体生物合成水平[24-25]。线粒体合成水平提高可以改善脂质代谢,生成启动抗炎信号,从而缓解血管内皮功能损伤,改善血管稳态失衡[26-27]。现已有研究发现白术内酯Ⅲ通过激活AMPK/SIRT1 信号通路,减少炎症反应[28];参苓白术散可激活AMPK 信号通路从而降糖控脂[29]。本研究发现白术水提物能明显上调血管 p-AMPK、SIRT1、PGC-1α 的蛋白表达,下调主动脉TLR4、IL-6、TNF-α 的蛋白表达,降低血清中TC、LDL-C、TNF-α 水平,调节血清NO/ET-1 的失衡,并减轻主动脉损伤。表明白术水提物可能是通过激活AMPK/SIRT1/PGC-1α信号通路来调节线粒体功能,调节代谢,实现血管动态平衡。
综上,白术水提物能够有效改善缓解倦怠乏力、排便无力、四肢烦热等证候,减轻主动脉的损伤,并通过激活AMPK/SIRT1/PGC-1α 通道,起到调节能量代谢的作用,最终改善线粒体功能障碍引起的血管稳态失衡。
利益冲突所有作者均声明不存在利益冲突