酚酸及有机酸辅色对山楂酒贮藏期品质的影响
蒋文鸿,张 纯,刘素稳2,, ,常学东2,
(1.中粮长城葡萄酒(蓬莱)有限公司,山东烟台 265608;2.河北省燕山特色农业产业技术研究院,河北秦皇岛 066004;3.河北科技师范学院食品科技学院,河北秦皇岛 066604)
山楂(CrataegusL.),蔷薇科(Rosaceae),在我国主要分布于山东、山西、京津冀、辽宁、河南等地[1],具有降血脂、抗心律不齐、强心、调节胃肠道、降糖、抗菌抗炎、免疫调节、抗氧化等广泛的药理作用[2]。山楂味道偏酸,直接食用较少,常被用来加工。传统山楂制品包括冰糖葫芦、山楂糕、山楂罐头、山楂果酱等产品,含糖高,附加值低。随着时代发展,开发高附加值和低糖的健康产品已成为迫切需求。
山楂发酵酒作为新兴的、具有保健功效的酒精饮料受到消费者欢迎。山楂酒的色泽主要是由花色苷呈现,但在生产过程中山楂酒花色苷易分解,发生褐变,影响山楂酒的品质。添加辅色素使其与花色苷发生增色效应和红移现象是提高果酒中花色苷稳定性的有效方法[3]。因酚酸具有较强的生物活性,能改善并稳定含花色苷食品的颜色[4],从而成为改善果酒褐变的有效措施[5]。研究表明,有机酸作为葡萄酒的重要风味构成物质,其种类和浓度对葡萄酒的感官质量、理化特性和颜色稳定性有重要影响[5]。有机酸对野生樱桃李花色苷具有辅色作用,能提高花色苷的热稳定性[6],在黑米花色苷中也有辅色效应并能提高其稳定性[7],在桑椹花色苷溶液中添加适量有机酸能够有效缓解花色苷降解,效果最佳的为苹果酸[8]。然而,不同种类酚酸及有机酸对花色苷的辅色作用及其热稳定性的影响不同[8],对不同结构的花色苷辅色效果也不同。因此,有必要考察不同类型酚酸及有机酸对山楂酒的辅色效果。研究发现阿魏酸[4]、香草酸[4]、对羟基苯甲酸[9]、丙二酸[6]、琥珀酸[3]、对香豆酸[9]、苹果酸[8]、咖啡酸[4]在酚酸及有机酸中有较好的辅色效果。
山楂酒颜色劣变是一个常见的问题,目前关于果酒的辅色作用有很多报道,但对于山楂酒的辅色研究相对较少,所以构建酒模拟体系,筛选出合适的酚酸及有机酸,对了解发酵酒陈酿过程中不同酚酸及有机酸的辅色效果和对活性物质的影响有重要作用[5],能够为改善山楂酒颜色劣变提供参考。本实验通过构建模拟体系,筛选辅色效果较好的酚酸及有机酸,利用CIELab 参数法研究模拟体系中不同酚酸及有机酸处理山楂酒的颜色变化情况,并对模拟体系及陈酿期间的山楂酒进行色度色调、总酚、花色苷等酚类活性物质的测定,验证辅色效果,以期为发酵山楂酒的辅色技术提供基础数据。
1 材料与方法
1.1 材料与仪器
兴隆紫肉山楂 产地为河北兴隆地区,采收期在10 月;无水乙醇、冰醋酸 天津市凯通化学试剂有限公司;盐酸 永飞化学试剂有限公司;碳酸钠、氯化钾、亚硝酸钠、硝酸铝 天津市风船化学试剂科技有限公司;没食子酸 天津市科密欧化学试剂开发中心;福林酚、香草酸、果胶酶(酶活力≥1000 U/mg)、矢车菊素-3-葡萄糖苷 上海源叶生物科技有限公司;对羟基苯甲酸、琥珀酸、对香豆酸、丙二酸、苹果酸、阿魏酸、咖啡酸 国药集团化学试剂有限公司;果酒酵母 法国LAFFORT;其余常用试剂均为分析纯。
JYL-C012 型打浆机 九阳股份有限公司;FE20型实验室pH 计 梅特勒-托利多仪器(上海)有限公司;DHL-A 电脑恒流泵、723 型可见分光光度计 上海光谱仪器有限公司;LGJ-15D 型冷冻干燥机 北京四环科学仪器厂有限公司;N-1100 型旋转蒸发仪 东京理化器械株式会社埃朗科技国际贸易有限公司;SN-MS-H2800 磁力搅拌器 上海尚善仪器设备有限公司;SMY-2000 系列测色色差计 北京盛名扬科技开发有限责任公司;TDZ5-WS 台式低速离心机 长沙湘仪离心机仪器有限公司。
1.2 实验方法
1.2.1 山楂花色苷制备 取山楂果皮200 g,用打浆机打碎备用。以1:6(m/v)的比例加入80%酸化乙醇(0.1%盐酸),40 ℃恒温浸提,500 r/min 搅拌1 h。抽滤,进行二次浸提,料液比为1:5(m/v),条件同一次浸提(浸提及抽滤过程避光),合并滤液。滤液用AB-8 大孔树脂纯化、45 ℃真空旋转浓缩,-18 ℃冰箱冷冻12 h 后,-40 ℃冷冻干燥,山楂花色苷粉末用棕色离心管-18 ℃避光保藏[10]。
1.2.2 山楂酒制备 将新鲜成熟无腐烂的山楂洗净去核打浆,山楂:水质量比为1:2 进行料液添加,加入75 mg/L 的二氧化硫并在25 ℃保持24 h,加入110 mg/L 的果胶酶,pH2.5,37 ℃酶解6 h,在果胶酶处理结束后,及时加入50%白砂糖以补充糖分,随后加入60 ml/L 活化酵母,二次加剩余50%糖,按照17 g/L 产生1% v/v 酒精添加,将调好的山楂汁在25 ℃的培养箱中放置发酵。每天搅拌一次,测酒精度,第12 d 发酵结束,最终生成8% v/v 酒[11]。山楂酒发酵结束后,过滤得到上清液,分别添加对羟基苯甲酸、阿魏酸和香草酸,添加浓度为0.1 mol/L,对照组不作任何添加。
1.2.3 花色苷辅色模拟体系的建立 配制0.002 mol/L(以矢车菊素-3-葡萄糖苷计)的山楂花色苷溶液,0.1 mol/L 的酚酸及有机酸溶液(阿魏酸、香草酸、对羟基苯甲酸、丙二酸、琥珀酸、对香豆酸、苹果酸、咖啡酸),取5 mL 花色苷溶液,加入5 mL 酚酸及有机酸溶液,再加入3 mL 无水乙醇,用蒸馏水定容至50 mL,对照组不加酚酸及有机酸,用盐酸调相同pH 为2.5[12]。模拟体系的酒精度达到8% v/v,pH为3.6。避光于室温下贮藏,定期测量模拟体系的L*、a*、b*、C*ab、hab值,色度色调,总酚和花色苷含量的变化。
1.2.4 颜色偏差测定 取模拟体系酒液,用色差计测量其颜色偏差,记录L*、a*、b*、C*ab、hab的值。L*表示色泽的明度,L*=0 为黑色,L*=100 为白色;a*值表示红色(+a*)和绿色(-a*);b*值表示黄色(+b*)和蓝色(-b*);C*ab表示彩度;hab表示色调角。其中C*ab、hab的计算公式为[13]:
1.2.5 色度色调测定 用分光光度计在420、520、620 nm 分别测得其吸光度值,用蒸馏水做空白。
1.2.6 总酚含量测定(福林-肖卡法)量取不同体积的没食子酸标准液(1 mg/mL)于50 mL 的容量瓶中定容,取1 mL 上述标准液,加入5 mL 经稀释十倍的福林酚试剂,摇匀。1 min 后加入7.5%碳酸钠溶液4 mL,摇匀,加蒸馏水到10 mL。在75 ℃下反应10 min,在765 nm 波长下测吸光度值。标准曲线回归方程为:y=8.5488x+0.0173,R2=0.9991,吸取样液1 mL 同标准曲线方法,测吸光度值。根据标准曲线计算总酚含量。
1.2.7 花色苷含量的测定(pH 示差法)取山楂酒1 mL,分别用pH1.0 和pH4.5 的缓冲溶液定容到5 mL,分别在700、520 nm 处测其吸光度值。
式中:A=△pH1.0-△pH4.5,MW=449.2 g/mol(矢车菊素-3-葡萄糖苷的分子质量),B=26900 L·cm-1mol-1(矢车菊素-3-葡萄糖苷消光系数),DF=5(稀释倍数),L=1 cm(比色皿光径长度)。
1.2.8 山楂酒中黄酮的测定 吸取样液0.5 mL 于棕色具塞试管中,加入5%亚硝酸钠溶液0.12 mL,放置6 min,后加入10%硝酸铝溶液0.12 mL,放置6 min,再加入1 mol/L 氢氧化钠溶液1.6 mL,然后用50%乙醇定容,摇匀放置15 min,然后于4000 r/min 离心机离心10 min,取上清液于510 nm处测吸光度值,根据标准曲线计算黄酮的含量。
芦丁标准曲线回归方程为y=10.263x-0.0035,R²=0.9993。
1.3 数据处理
本文所用数据平行及重复次数均大于3,结果以平均值±标准差(SD)表示;使用Excel 进行数据处理,SPSS 27.0 进行统计学分析,采用GLM 单变量分析,使用Waller-Duncan 检验,P<0.05 表示有显著差异,P<0.01 表示有极显著差异;采用Origin Pro 2021软件绘制图形。
2 结果与分析
2.1 模拟体系中不同酚酸及有机酸种类对花色苷辅色效果的影响
花色苷在520 nm 处有最大吸收峰,常用来判断浓度大小[14],也可以判断有机酸对花色苷的辅色效果[15]。加入有机酸能够降低溶液的pH,在低pH 的条件下花色苷的红色增强,能提高花色苷的稳定性[16]。如图1 所示,与对照组相比,八种酚酸及有机酸均能显著增加山楂酒花色苷在520 nm 的吸光度(P<0.05)。其中,对羟基苯甲酸的吸光度值最高,即辅色程度最强,其次是香草酸和阿魏酸。与对照组相比,对羟基苯甲酸、香草酸、阿魏酸的吸光度值分别增加了42.82%、36.70%、31.38%,辅色效果优于其他组。有研究表明,在520 nm 条件下加入有机酸能使黑果枸杞花色苷产生红移现象,溶液吸光度值显著增加,含量增多[17]。因此本实验选择对羟基苯甲酸、香草酸和阿魏酸作为辅色酚酸及有机酸进行后续分析。

图1 酚酸及有机酸对山楂花色苷在520 nm 吸光度的影响Fig.1 Effect of phenolic acid and organic acid on the absorbance of hawthorn anthocyanin at 520 nm
山楂酒花色苷在520 nm 的吸光度值随着时间的增长呈下降趋势(图2)。在0 d 至30 d 的处理期间,对羟基苯甲酸处理的山楂酒模拟体系花色苷吸光度降低了12.66%,香草酸和阿魏酸处理后吸光度分别降低15.32%和20.45%,对照组花色苷吸光度降低了27.13%。酚酸及有机酸处理对减弱模拟体系中花色苷吸光度的下降具有极显著作用(P<0.01),30 d时,对羟基苯甲酸的吸光度较对照组高出42.82%。表明对羟基苯甲酸可能对山楂酒吸光度保持作用效果最佳。

图2 模拟体系中山楂花色苷贮藏期间吸光度的变化Fig.2 Changes in absorbance of hawthorn anthocyanin during storage in the simulated system
2.2 模拟体系中不同酚酸及有机酸处理对酒体颜色偏差的影响
L*表示模拟体系酒的明度,由表1 可知,0~30 d时间内四个组的L*值变化较大且整体呈上升趋势,且体系颜色越来越亮。明度与色素的含量变化趋势相反,明度越低,色素含量越高[18-19]。30 d 时,经酚酸及有机酸处理的模拟体系山楂酒的L*高于对照组,且颜色也比对照组酒液颜色亮,这与添加橡木片改善西拉葡萄酒的颜色和贮藏能力[20]中的研究发现一致,说明这三种酸对山楂酒均具有一定的辅色作用。
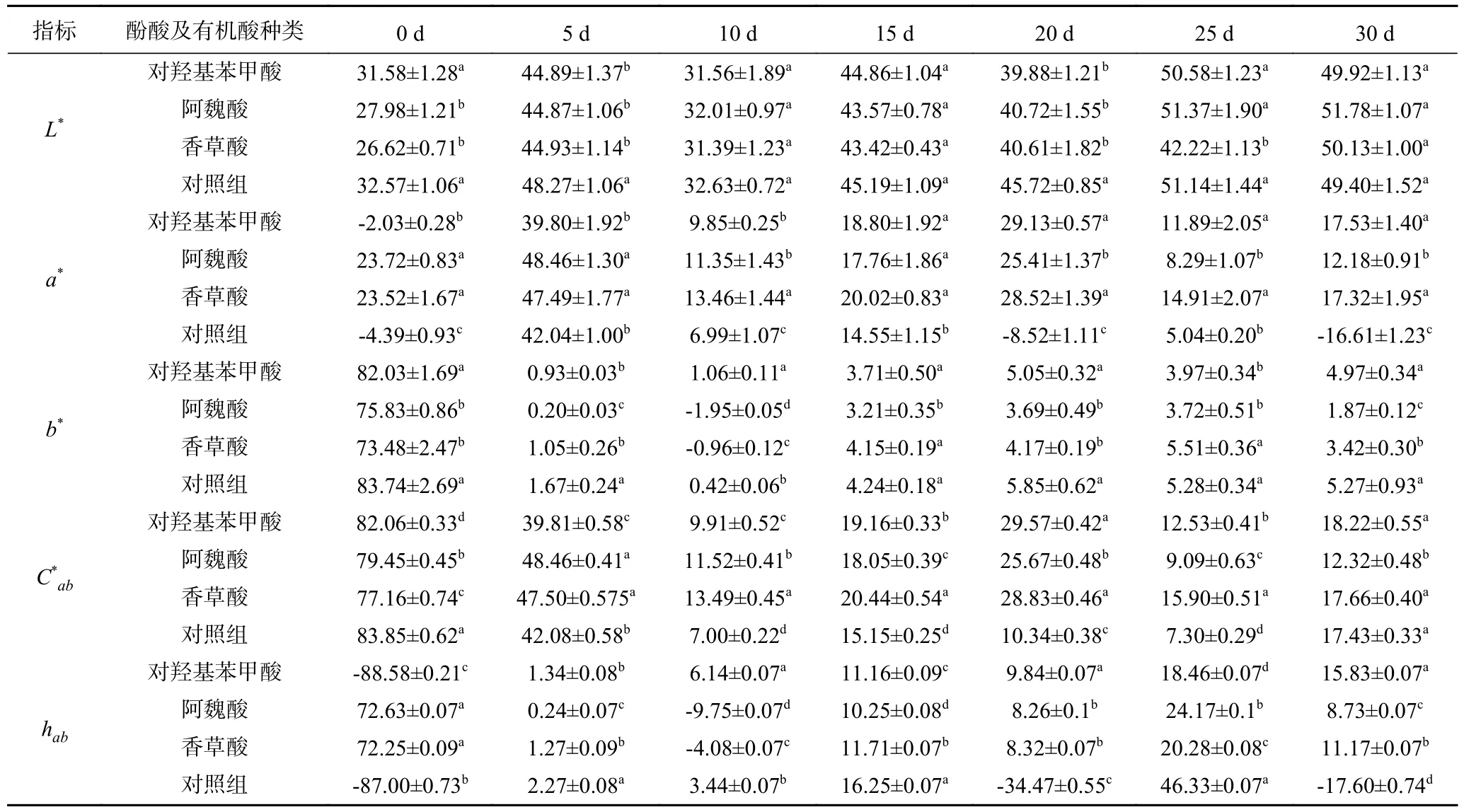
表1 模拟体系酒体的CIELab 参数Table 1 CIELab parameters for simulated system wines
a*值和b*值表示色调,色度a*值表示红色色调,色度b*值表示黄色色调,饱和度C*ab值是a*值和b*值的综合指标,表示酒颜色的色彩饱和程度[21]。在整个模拟体系中,经阿魏酸和香草酸处理的a*值整体呈下降趋势,三组的b*值整体呈下降的趋势,经酚酸及有机酸处理过的模拟体系酒a*值均大于0,且显著高于对照组(P<0.05),说明酚酸及有机酸处理的模拟体系较对照组的酒液颜色呈现更多的红色,辅色作用显著。对照组的a*值逐渐低于酚酸及有机酸辅色组,这与酚酸对三华李青汁的贮藏稳定性结果一致[4],说明加入酚酸及有机酸可以使酒中红度稳定。不同酚酸及有机酸处理对山楂酒的b*值有一定的影响。阿魏酸和香草酸处理的山楂酒相较于对照组显著降低(P<0.05),表示在模拟体系中阿魏酸和香草酸延缓了山楂酒黄色色调升高的速度,而对羟基苯甲酸处理的山楂酒相较于对照组差异不显著(P>0.05),说明对羟基苯甲酸处理的山楂酒b*值有较小的变化,而适当的b*值可以使酒体颜色更加鲜艳[22]。
C*ab是由色度决定体现颜色鲜艳程度的值,数值越大说明物体颜色越鲜艳即饱和度越高,反之则越暗[23]。经对羟基苯甲酸和香草酸处理的模拟体系酒在10~30 d 期间C*ab值高于对照组,这表明经酚酸及有机酸处理后颜色较对照组更加鲜艳,色彩饱和度更稳定,这与酚酸对三华李青汁的贮藏稳定性结果一致[4]。酚酸及有机酸处理能够降低山楂酒颜色的损失,具有一定的辅色作用。
色相hab(即色调角)是指能够比较确切地表示某种颜色色调的名称,色相在0~360 之间以逆时针方向偏转,0(±360)为红色,60(-300)为黄色,120(-240)为绿色,180(-180)为青色,240(-120)为蓝色,300(-60)为品红色[24],经酚酸及有机酸处理的山楂酒在5~30 d 期间色调角hab值约在-10~25 之间,变化范围较小,与0 较为接近,颜色变化较为平稳,接近紫红色调,与对贺兰山东麓年轻红葡萄酒的研究结果相似[21],表明酚酸及有机酸对山楂酒花色苷变化具有一定的辅色作用。
2.3 模拟体系中不同酚酸及有机酸处理对酒体色度色调的影响
颜色密度能够反映模拟体系中呈色物质的多少。如图3 所示,酒体前期色度普遍呈下降趋势,这可能与山楂酒中的呈色物质的组成变化有关;后期变化趋势较前期平稳,可能由于酚酸及有机酸对花色苷的降解的抑制作用达到动态平衡[25]。在0~5 d 时添加香草酸的模拟酒色度呈上升趋势,可能是由于香草酸与酒中物质发生反应,但随着时间增加,吸光度缓慢上升。对羟基苯甲酸、阿魏酸和香草酸处理组之间差异不显著(P>0.05)。
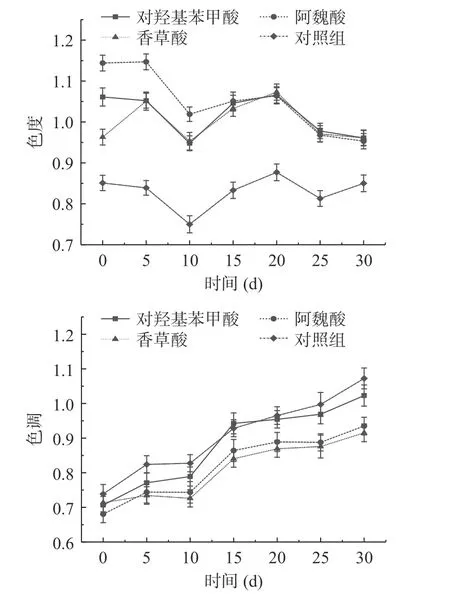
图3 模拟体系中不同酚酸及有机酸处理酒体色度色调的变化Fig.3 Changes in color hue of wines treated with different phenolic and organic acids in simulated systems
色调值能够显示模拟体系中黄色物质与红色物质的比例[26],小于1 表示其中的红色物质多于黄色物质。色调值与酒中辅色类花色苷浓度成反比[27]。模拟体系中不同酚酸及有机酸处理的山楂酒色调整体呈上升趋势,经酚酸及有机酸处理的山楂酒在发酵过程中色调均小于1,说明山楂酒中红色物质多于黄色物质,添加酚酸及有机酸能够对山楂酒进行辅色作用,使酒液颜色得到稳定的呈现。同样,在“西拉”红葡萄酒发酵前添加有机酸发现,随时间的延长,有机酸显著降低了酒体的色调,抑制了酒体逐渐由紫红色向黄色转变[5],这可能是酚酸及有机酸能够改善模拟体系中山楂酒色调的原因之一。
2.4 模拟体系中不同酚酸及有机酸处理对酒体酚类物质含量的影响
在0~20 d 时,酚酸及有机酸和对照组的总酚含量为缓慢下降的趋势,在20 d 之后四组均为上升趋势,增高程度由急剧到缓慢(图4)。阿魏酸和香草酸处理组的总酚含量均高于对羟基苯甲酸处理组和对照组。前期可能是因为山楂酒模拟体系中酚类物质发生沉降,导致总酚含量下降[28];后期贮藏过程中由于花色苷与黄烷醇之间的直接(聚合反应)或由醛类介导的聚合反应产生了新的稳定色素使总酚含量升高[29]。在整个处理过程中,阿魏酸和香草酸处理的酒体总酚含量显著高于对照组(P<0.05)。30 d 时,经阿魏酸和香草酸处理的酒体总酚含量分别高于对照组18.00%和20.88%(P<0.05),说明酚酸及有机酸处理有助于提高山楂酒的总酚含量,三种酚酸及有机酸处理中阿魏酸和香草酸优于对羟基苯甲酸。在咖啡酸和迷迭香酸处理的干红葡萄酒酒中,也发现处理组总酚含量高于对照组[30],这与本实验结果相似。
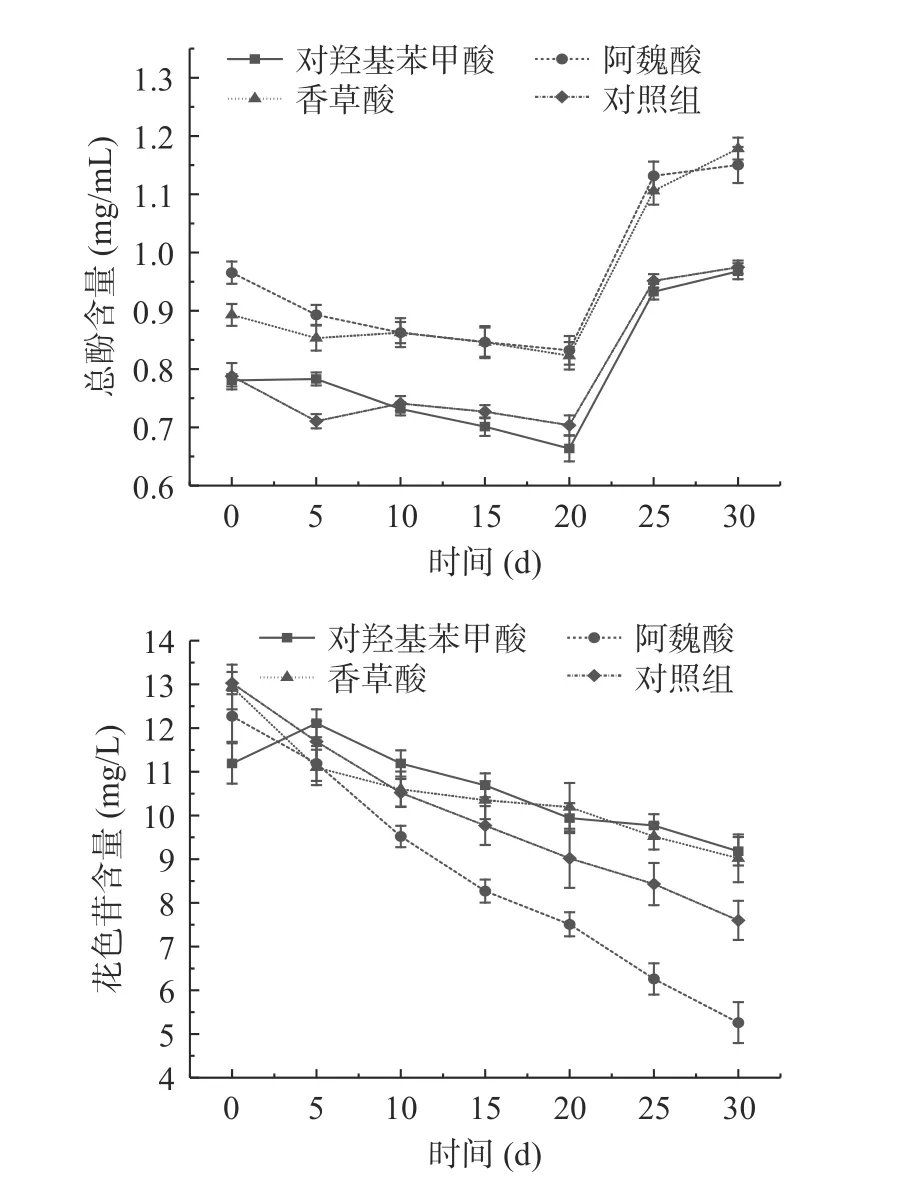
图4 模拟体系中不同酚酸及有机酸处理酒体酚类物质含量的变化Fig.4 Changes in the phenolic content of wines treated with different phenolic and organic acids in the simulated system
在模拟体系处理过程中花色苷含量呈下降趋势,主要原因是随着时间的增加,单体花色苷会逐渐降解,且有机酸会与单体花色苷形成更稳定的络合物,这些花色苷衍生物对赋予酒体持久和稳定的颜色起着积极的作用[31]。30 d 后,经对羟基苯甲酸和香草酸处理的模拟体系中花色苷含量高于对照组中花色苷的含量,分别为17.27%和15.74%。有研究发现添加有机酸的葡萄酒中总花色苷保留率高于对照组,表明添加有机酸在一定程度上促进辅色效果,延缓花色苷的降解[32]。
2.5 不同酚酸及有机酸处理对贮藏期间发酵山楂酒色度色调的影响
色度是评价果酒品质的一个重要指标,能够判断酒品的质量好坏与氧化程度。花色苷、单宁含量越高,酒的颜色越深,色度值也就越大[33]。
贮藏期间山楂酒的色度值整体呈上升趋势(图5)。120 d 时,对照组色度增高了12.13 倍,而经对羟基苯甲酸、阿魏酸和香草酸处理的山楂酒色度分别提高了17.33、13.58 和12.59 倍,对羟基苯甲酸辅色效果最好,能显著提高色度(P<0.05),这与模拟体系一致;色度趋势变化不规则可能是由于酒中的显色物质除花色苷外还有聚合色素和类黄酮物质等,也会对山楂酒色度产生影响,且单宁在酒的酿造和陈酿过程中与果皮中的花色苷形成聚合色素,也会影响酒液的色度变化[33]。樱桃酒的色度在一年的陈酿过程中,前期色度值趋势不稳定,在后期色度变化趋于平稳[34],与本实验研究结果相似。
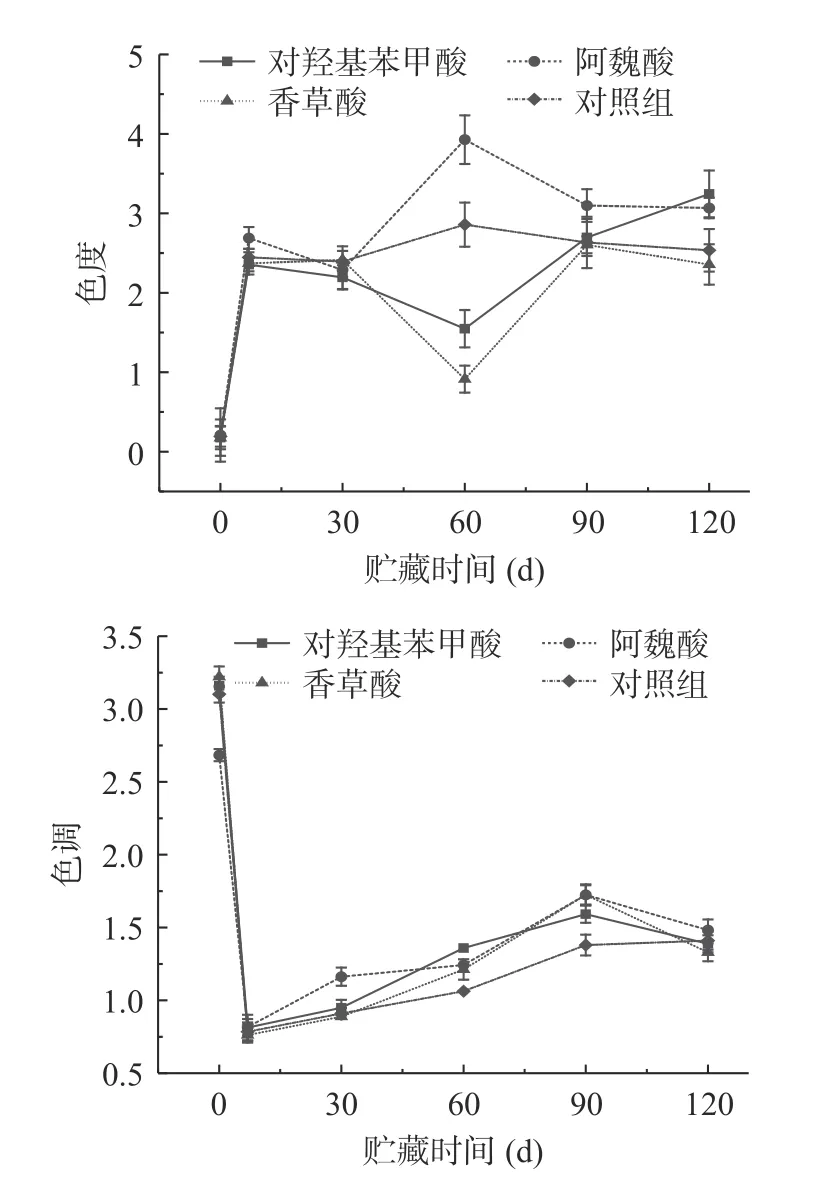
图5 不同酚酸及有机酸处理下贮藏期间山楂酒色度色调的变化Fig.5 Changes in color hue of hawthorn wine during storage under different phenolic and organic acid treatments
果酒色调值较高时,黄色色调明显,酒体偏褐色[35]。山楂酒色调整体呈下降趋势,与色度趋势相反,在5~120 d 时整体与花色苷含量呈负相关,发酵酒在贮藏期间由于铁离子和有机酸的共同存在,使花色苷降解[36],不含酚酸及有机酸的对照组花色苷含量反而较高。在120 d 时,色调值大于1,即表明山楂酒中的黄色物质多于红色物质。120 d 时,经对羟基苯甲酸、阿魏酸和香草酸处理的山楂酒色调分别降低了56.06%、44.76%和58.73%;对照组的山楂酒色调从0 d 的3.102 经120 d 的陈酿下降为1.410,降低了54.54%。酒中显黄色的物质主要是类黄酮类物质,而显红色的主要是花色苷类物质。在贮藏期间,果酒中黄酮含量随时间增加而增加,花色苷含量随时间增加而降低,导致整体色调呈降低趋势[37]。
2.6 贮藏期间不同酚酸及有机酸处理对发酵山楂酒酚类物质含量的影响
山楂酒在贮藏期间的总酚、花色苷和黄酮含量如图6 所示,山楂酒的总酚含量整体呈先下降后上升的趋势。对照组的山楂酒总酚含量在120 d 的陈酿期降低了37.17%,经对羟基苯甲酸、阿魏酸和香草酸处理的山楂酒总酚含量分别降低了31.34%、29.39%和31.53%。120 d 时经阿魏酸和香草酸处理的酒体总酚含量分别高于对照组37.42%和34.44%。陈酿前期可能是山楂酒中的酚类物质发生聚合及缩合反应[38],酚类物质发生降解,导致总酚指数下降;陈酿后期原料中酚类物质还可由微生物和乙醇作用继续缓慢溶出[39]。阿魏酸和香草酸与对照组之间存在显著性差异(P<0.05)。说明酚酸及有机酸处理对山楂酒的总酚含量具有积极的作用,三种酚酸及有机酸中处理效果较好的为阿魏酸和香草酸,和模拟体系研究结果一致。
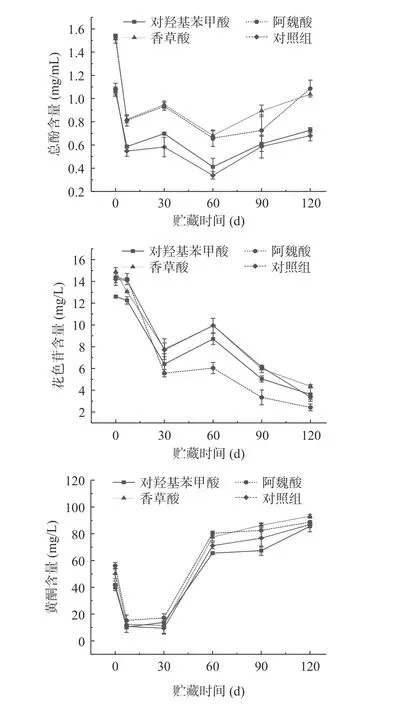
图6 贮藏期间不同酚酸及有机酸处理山楂酒酚类物质含量的变化Fig.6 Changes in phenolic content of hawthorn wine treated with different phenolic acids and organic acids during storage
山楂酒在贮藏期间花色苷含量整体呈先下降再上升后下降的趋势,60 d 后呈下降趋势。对照组花色苷含量降低了76.27%,经对羟基苯甲酸、阿魏酸和香草酸处理的山楂酒花色苷含量经120 d 的陈酿分别降低了71.30%、83.14%和70.65%。120 d 时经香草酸和对羟基苯甲酸处理的酒体花色苷含量分别高于对照组22.93%和6.92%。山楂酒中主要显色物质是一些游离花色苷和聚合色素,游离的花色苷不如聚合色素稳定,在储存过程中受到自身结构、pH、贮藏温度、光照、氧气、酶等影响,逐渐降解[40]。在120 d 贮藏期,对羟基苯甲酸和香草酸与对照组之间存在显著性差异(P<0.05),说明酚酸及有机酸种类影响花色苷聚合和降解[23]。
山楂酒中的黄酮物质大多来自山楂果,还有一部分在发酵中形成,酵母的发酵会吸收、水解或氧化这些成分[41]。黄酮含量整体呈先下降再上升的趋势,由于酵母产生的果胶酶能够破坏细胞壁,促进黄酮类物质从细胞中溶出[42],30 d 后呈上升趋势。对照组的山楂酒中黄酮含量经120 d 的陈酿增加了51.92%,经对羟基苯甲酸、阿魏酸和香草酸处理的山楂酒中黄酮含量经120 d 的陈酿增加了53.01%、36.71%和46.01%,120 d 时经香草酸和阿魏酸处理的酒体黄酮含量分别高于对照组6.67%和2.05%。经香草酸和阿魏酸处理的山楂酒与对照组之间存在显著性差异(P<0.05),说明香草酸和阿魏酸对促进山楂酒黄酮类物质的溶出有较好的效果。
3 结论
本研究考察了模拟体系和贮藏期间的山楂酒酚酸及有机酸辅色处理对色度色调和酚类化合物的影响。结果表明,在山楂酒模拟体系中对羟基苯甲酸、香草酸、阿魏酸的辅色效果最好。酚酸及有机酸辅色处理能减少色泽和营养成分的损失,使酒中色泽保持更加持久,但不同酚酸及有机酸的处理效果不同;在贮藏期间,对羟基苯甲酸和阿魏酸对色度有较好的作用。因此,对不同需求可采用不同酚酸和有机酸进行辅色。后续可进一步确定酚酸及有机酸的最适添加量,也可采用复合辅色剂对山楂酒进行辅色处理,以筛选和制备具有更好效果的辅色剂,进一步提高山楂酒品质。

