单宁添加对赤霞珠葡萄酒颜色和花色苷含量变化的影响及其相关性研究
马 懿,喻康杰,赖晓琴,肖雄峻,熊 蓉,谢李明,魏紫云,黄慧玲
(四川轻化工大学生物工程学院,四川省酿酒专用粮工程技术研究中心,四川宜宾 644000)
颜色是评价葡萄酒质量的重要指标,葡萄原料质量、酿造工艺、浸渍强度以及陈酿潜力等信息可以通过葡萄酒颜色反映[1],同时颜色也是消费者选择葡萄酒时最有影响的因素之一。研究葡萄酒颜色是实现葡萄酒加工质量控制和产品风格鉴别的重要手段。葡萄酒的颜色特点主要由花色苷的组成和浓度共同决定[2]。单体花色苷、乙酰化花色苷和吡喃花色苷是葡萄酒中的主要的红色呈色物质,并在葡萄酒陈酿过程中促进红色聚合色素的产生进一步影响葡萄酒颜色[3]。但部分花色苷化学活性较强,极不稳定,易受到发酵条件、抗氧化剂、酵母代谢等因素的影响[4]。为了提高葡萄酒的鲜艳程度以及色泽稳定性,外源添加可以与花色苷通过分子堆叠、氢键等方式结合,形成稳定化合物的辅色素是目前葡萄酒护色研究的重点。目前研究较多的辅色素种类有酚类化合物、有机酸以及金属离子[5]。
酿酒单宁是从各种植物中提取的复杂多酚化合物。酿酒单宁对蛋白质有强结合力,同时可以防止葡萄酒铁雾的形成[6]。根据其主要组成成分,酿酒单宁通常被分为缩合单宁(原花色苷、原翠雀素等)和水解单宁(没食子酸吡喃葡萄糖、没食子单宁等)[7]。Remy 等[8]发现缩合单宁能够改善葡萄酒香气的复杂性,可直接与花色苷反应生成橙色黄质盐,在乙醛的作用下还会产生紫色的乙基桥物质[9]。有研究团队发现含有吡喃花色苷和黄醇花色苷的酿酒缩合单宁生成的色聚物非常稳定,对SO2的漂白作用具有较高的抗性[3,10]。相比于缩合单宁,水解单宁在为葡萄酒提供抗氧化活性以及抑菌性方面更具优势,Strati 等[10]发现水解单宁可以显著提高酒体抗氧化活性,可以调节葡萄酒的颜色和感官特征,并指出在果酒生产中,水解单宁有一定替代SO2的潜力。酿酒单宁对葡萄酒颜色的积极作用已被证实,但不同酿酒单宁对葡萄酒颜色影响的差异性,以及在陈酿过程中单体花色苷含量与颜色相关性研究鲜见报道。
基于此,本文选取赤霞珠葡萄酒为研究对象,于酒精发酵前分别添加5 种酿酒单宁,并进行120 d 的陈酿,分析处理酒样的颜色特征和花色苷组成与含量的差异性以及陈酿过程中颜色与单体花色苷含量的相关性,以期为赤霞珠葡萄酒色泽稳定性研究和实践提供参考。
1 材料与方法
1.1 材料与仪器
赤霞珠葡萄(成熟度在8.5~9.0 之间;大小均匀,无病虫害)河北张家口葡萄酒庄园(网购);果酒高活性干酵母(Saccharomyces cerevisiae)安琪酵母股份有限公司;白砂糖 市售;果胶酶(500 U/mg)、偏重亚硫酸钾、3,5-二硝基水杨酸、苯酚、甲醇(色谱纯)、乙腈(色谱纯)、15 种单体花色苷标品(色谱纯)、甲酸(色谱纯)、对甲氨基肉桂醛(DMACA)上海源叶生物科技有限公司;碳酸氢钠、酒石酸钾钠、葡萄糖 成都市科龙化工试剂厂;五种商业单宁(橡木单宁、绿茶单宁、栗木单宁、坚木单宁、葡萄籽单宁)上海鼎唐国际贸易有限公司;304 酿酒专用不锈钢桶 网购。
1260Infinity Ⅱ液相色谱仪 安捷伦科技有限公司;UitraScan VIS 台式色差仪 HunterLab(美国)有限公司;HWS-12 水浴锅、DHG-9140A 电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;AR1140电子天平 梅特勒-托利多仪器(上海)有限公司;STARTER 2C 实验室pH 计 奥豪斯仪器(上海)有限公司;T6 新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;TG-16 台式高速离心机四川蜀科仪器有限公司;BCD-216TMZL 冷藏冰冻箱 青岛海尔股份有限公司;KQ-700DE 数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 葡萄酒酿造工艺流程与操作要点 葡萄酒酿造工艺如图1 所示,原料处理与成分调整:选择新鲜、成熟赤霞珠葡萄,去梗、破碎后再加入60 mg/L果胶酶、80 mg/L SO2后放于4 ℃冰箱中静置24 h。8 层纱布过滤,分别加入一定量白砂糖与柠檬酸调节葡萄汁糖度至22°Brix、pH4.0。

图1 葡萄酒酿造工艺流程图Fig.1 Wine brewing process flow chart
发酵:按照30 mL(50 g/L)蔗糖水使用2 g 果酒干酵母的标准配制活化液,活化液置于30 ℃活化30 min,随后接入活化好的5%酵母活化液用于葡萄酒发酵,10 L 葡萄酒清汁装入15 L 不锈钢发酵罐中发酵,发酵温度为26 ℃(每组3 个平行)。发酵15 d后8 层纱布过滤,使用不锈钢桶于14 ℃陈酿120 d。
实验设置:设置5 组实验组:BSO 组:添加橡木单宁;ECA 组:添加栗木单宁;BRE 组:添加绿茶单宁;EFC 组:添加坚木单宁;PTZ 组:添加葡萄籽单宁。在预实验的基础上结合文献[3,11],每组单宁添加量为200 mg/L。设置一组不添加单宁的对照组(CK)。葡萄酒不同发酵时期对应缩写:酒精发酵前(成分调节后)-FB;酒精发酵结束-FA;苹果酸-乳酸发酵结束(倒罐陈酿,陈酿0 d)-MLF;陈酿60 天-60 d;陈酿120 天-120 d。
1.2.2 基础理化指标的测定 可溶性固形物采用手持糖度仪测定,pH 测定使用pH 计,酒精度、还原糖、总酸测定参照GB/T 15038-2006《葡萄酒、果酒通用分析方法》[12]。
1.2.3 总酚含量测定 总酚含量使用福林-肖卡(Folin-Ciocalteu)法[13]测定,以没食子酸质量浓度计。将样品(1 mL)与福林酚试剂(1 mL)混合反应3 min,再加7.5%碳酸钠溶液(1.5 mL)。避光反应2 h后,检测OD765。测定标准曲线结果为:y=0.1003x+0.0076,y 为吸光度,x 为没食子酸含量,R2=0.9998。
1.2.4 总花色苷含量测定 标准溶液(pH4.5)配制:用分析天平称取8.2 g 无水乙酸钠于烧杯中,加入去离子水溶解后,于500 mL 容量瓶中定容,用盐酸(36.5%)调整pH 至4.5±0.1。标准溶液(pH1.0)配制:用分析天平称取7.45 g 氯化钾于烧杯中,加入去离子水溶解后,于500 mL 容量瓶中定容,用盐酸(36.5%)调整pH 至1.0±0.1。参照翦祎等[14]的方法,取去离子水(2 mL)于两支10 mL 试管中,分别加入pH4.5、1.0 的缓冲液(9 mL),将两支试管于室温下反应1 h,即制成两个空白组。样品稀释5 倍后以同样的方式分别与pH4.5 和1.0 的缓冲溶液进行反应,使用相应的空白组,测定OD520、OD700,每个样品平行测定3 次。花色苷含量以矢车菊色素-3-葡萄糖苷计,用公式(1)计算。
式中,△A(吸光度)=(A520-A700)pH1.0-(A520-A700)pH4.5;MW:矢车菊素-3-葡萄糖苷摩尔分子质量,449.2 g/mol;DF:稀释倍数;ε:矢车菊素-3-葡萄糖苷摩尔消光系数,26900;L:比色皿的光路长(cm),1 cm。
1.2.5 总黄烷醇含量测定 用DMACA 法[15]测定总黄烷醇含量,结果以儿茶素含量计(mgCTE/L)。1 mol/L 的盐酸甲醇溶液配制:量取50 mL 的浓盐酸,用甲醇定容至500 mL。配制0.1% DMACA 的1 mol/L 的盐酸甲醇溶液:称取0.2 g 的DMACA,用l mol/L 的盐酸甲醇溶液定容至200 mL。将样品溶液稀释10 倍,吸取0.3 mL 置于10 mL 离心管中,再加入9 mL 的0.1% DMACA 的1 mol/L 的盐酸甲醇溶液,摇匀并静置10 min。用紫外可见分光光度计测OD640。以蒸馏水做空白,每个处理重复3 次。测定标准曲线结果为:y=0.0063x+0.0013,y 为吸光度,x 为儿茶素含量,R2=0.9981。
1.2.6 色度的测定 色度测定参照马懿等[16]的方法,使用UitraScan VIS 台式色差仪对样品进行检测,使用蒸馏水调零。其中L*表示明亮度,a*、b*是色调坐标。每个酒样重复测量3 次,3 次平均值作为该酒样的最终色度值。
1.2.7 单体花色苷含量检测 使用高效液相色谱法进行3 类(单葡萄糖苷花色苷、乙酰化花色苷、吡喃花色苷)共15 种单体花色苷含量检测,方法参考杜霞等[17]描述的方法基础上略微修改,样品需经0.22 μm 滤膜过滤处理。使用外标法测定葡萄酒单体花色苷的含量,花色苷标品梯度设计为5、10、50、100、250、500、1000 mg/L,标品溶液均使用60%乙醇溶解。
色谱条件:色谱柱:ZORBAX SB-Aq;4.6 mm×250 mm,5 μm;柱温:25 ℃;检测波长:520 nm;流动相A:2%乙酸溶液;流动相B:乙腈;洗脱梯度:0~10 min,10% B;10~15 min,10%~20% B;15~26 min,20%~40% B;26~30 min,40%~100% B;30~35 min,100%~10% B;35~40 min,10% B。
1.2.8 感官分析 从15 名有葡萄酒酿造、品评经验的工作人员中,按照GB/T 16291.2-2012 标准[18]筛选品评员,组成葡萄酒品评小组(3 男3 女),参照徐俊南[19]的方法进行感官评价。
1.3 数据处理
以上所有实验均设置3 个重复,数据使用SPSS软件进行分析,并采用平均值±标准差(mean±SD)表示(显著性分析使用邓肯多重比较法,结果采用标记字母法表示),除相关性网络图使用R 4.2.3 外,其余图表使用Origin 2021。
2 结果与分析
2.1 基础理化分析
葡萄酒陈酿120 d 后的基础理化指标见表1。由表1 可知,各组葡萄酒之间pH、总酸、可溶性固形物等数据没有显著性差异(P>0.05)。还原糖除ECA组显著低于BRE 组(P<0.05)外,其余实验组与对照组皆无显著性差异(P>0.05)。而实验组BRE 与ECA组的酒精度均明显高于CK 组(P<0.05),其中BRE组的酒精度为11.67%vol,ECA 组的酒精度为11.52%vol,可能是BRE 和ECA 影响了酵母菌膜酶H+-ATPase 活性从而增强了酵母的酒精代谢[20]。

表1 不同单宁添加赤霞珠葡萄酒的理化指标Table 1 Physicochemical indexes of Cabernet sauvignon wine with different tannins
2.2 陈酿过程总酚、总花色苷变化
总酚是葡萄酒中关键的成分,对葡萄酒的颜色、抗氧化性、风味和口感具有重要影响,也是反映葡萄酒质量和品质的重要指标。图2 记录了不同组别葡萄酒从酒精发酵前到陈酿结束期间总酚与总花色苷的变化情况。添加单宁使在葡萄汁酒精发酵前(FB)总酚含量明显高于对照组,Li 等[21]的实验也发现了同样的规律。随着发酵的进行,酵母菌代谢产生的果胶酶和β-糖苷酶,可以分别影响葡萄中的酚类提取和水解酚类化合物的糖苷键,提高酒中游离多酚的含量[22],这也是图2a 中总酚在发酵期间出现的上升的主要原因。陈酿过程的葡萄酒总酚含量呈下降趋势,一方面是多酚发生了酶促与非酶促氧化反应,进一步聚合影响其含量;另一方面,酵母细胞壁上的甘露聚糖以及一些酵母自溶物会对多酚类物质进行吸附从而降低其含量[23]。其中BSO 组与BRE 组的总酚含量明显高于其他测试组(P<0.05),最高峰值能达到1850.13、1790.86 mg/L。Panagiotis[24]发现水解单宁在抗氧化性方面比缩合单宁更有优势,而总酚含量与自由基清除力之间存在一定相关性,酚类物质可以激活抗氧化酶并抑制产生活性氧(ROS)的酶(脂氧酶、NADH 氧化酶和黄嘌呤氧化酶)来提供抗氧化保护[25],本实验总酚结果也合理地解释了水解单宁能为葡萄酒提供更显著的抗氧化能力的原因。

图2 不同单宁添加对发酵、陈酿期间赤霞珠葡萄酒总酚、总花色苷含量的影响Fig.2 Effects of different tannins on total phenol and anthocyanin contents of Cabernet sauvignon wine during fermentation and aging
花色苷是赤霞珠葡萄酒颜色的主要来源,葡萄酒中的花色苷主要通过浸渍作用进入酒体[26]。由图2b 可知,单宁的添加不会在发酵前影响葡萄汁总花色苷的含量。在葡萄酒进行发酵、陈酿时,游离花色苷会通过酰化、共色以及聚合等作用形成更复杂的花色苷衍生物,此时花色苷含量下降,葡萄酒颜色也在发生改变。实验组的花色苷含量下降趋势都明显大于对照组,特别是PTZ 组,花色苷下降最明显,说明PTZ 组单宁与酒中花色苷结合情况最好。
2.3 陈酿过程总黄烷醇变化
黄烷醇是多酚类黄酮化合物的一个重要亚类,其核心结构为黄烷。儿茶素和表儿茶素是葡萄酒中的主要黄烷醇类物质,黄烷醇类也是葡萄酒橙色调与苦涩味的主要来源之一[22]。由图3 可知,葡萄酒中的黄烷醇含量在发酵完成时上升明显,其原因是随着发酵,葡萄皮渣与外源单宁中的黄烷醇浸渍到葡萄酒中。随着苹果酸-乳酸发酵的进行,总黄烷醇含量进一步上升并达到峰值。在苹果酸-乳酸发酵完成时,总黄烷醇含量为PTZ 组>ECA 组>BSO 组>BRE 组>EFC 组>CK 组。造成这一结果的主要原因是外源添加单宁,单宁中的黄烷醇物质进入葡萄酒从而导致总黄烷醇含量上升,而葡萄籽单宁中的总黄烷醇含量高于其他来源单宁[27],这也许是PTZ 组别黄烷醇含量高于其他组的主要原因。
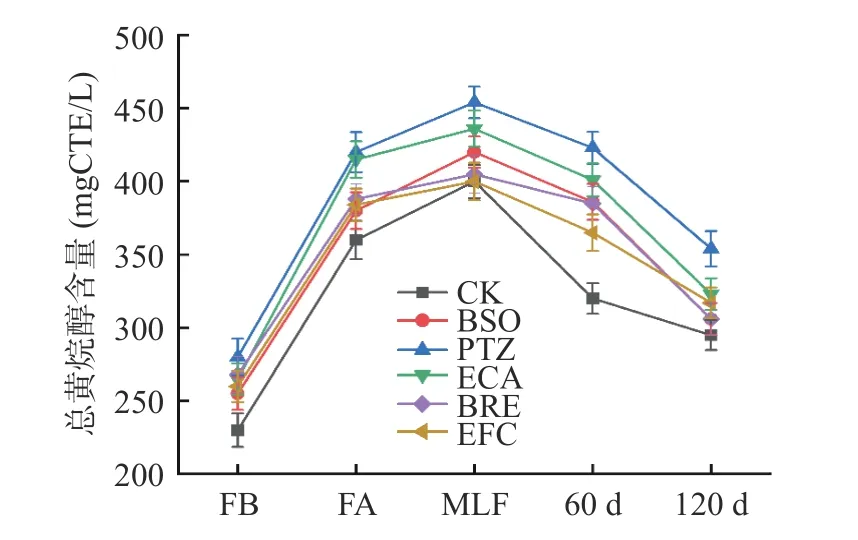
图3 不同单宁添加在发酵与陈酿期间对赤霞珠葡萄酒总黄烷醇含量的影响Fig.3 Effect of different tannins on total flavanols content of Cabernet sauvignon wine during fermentation and aging
在陈酿阶段,总黄烷醇含量下降主要是自身被氧化造成的。与此同时,酿酒单宁也会间接地抑制酵母的活性,使其产生足够的乙醛或羟基肉桂酸与黄烷醇反应[28],降低黄烷醇含量。120 d 时PTZ 组、ECA组的总黄烷醇含量依然显著性高于对照组(P<0.05),而BRE 组与CK 组差异不大。说明了不同酿酒单宁对酵母代谢有不同的影响,PTZ、ECA 的加入对酵母的抑制更低,黄烷醇下降趋势更小。
2.4 陈酿过程颜色指数变化
图4 表示的是不同组葡萄酒陈酿前后亮度L*与色调a*、b*的变化情况。单宁可以直接与葡萄酒中的花色苷反应生成紫色乙基桥类物质[29],从而加深葡萄酒颜色。陈酿前(MLF 阶段),实验组PTZ 与ECA 的L*比对照组更低,而a*、b*高,颜色更鲜艳,其他实验组的a*、b*也有提升,但L*与对照组之间差异不明显(P>0.05),在此阶段BSO、BRE、EFC 组对葡萄酒颜色的改变不如PTZ 与ECA 组。为了进行葡萄酒颜色的可视性比较,色差结果使用CIELAB色坐标系绘制,结果如图5 所示。葡萄酒a*值的正向大小决定着酒的红色程度,a*越大,酒体颜色越鲜艳、越偏红紫色[30]。陈酿前,PTZ 与ECA 更突出的a*使其显出更明显的紫色色调。而其他实验组此时颜色与对照组之间差异不明显。

图4 陈酿前后酒样的色差变化图Fig.4 Color difference changes of wine samples before and after aging

图5 陈酿前后酒样的特征颜色图Fig.5 Characteristic color map of wine samples before and after aging
陈酿120 d 后,葡萄酒整体呈现a*下降、L*与b*上升的规律,葡萄酒中呈红色的单葡萄糖苷花色苷、乙酰化花色苷和吡喃花色苷在陈酿过程中被氧化是a*值下降的主要原因,而b*可为a*辅色[31],从而调整酒体颜色框架。b*值的大小与葡萄酒的黄色程度呈正相关,葡萄果皮中的一些具有黄色色调的多酚类物质被逐渐溶出及形成了一些黄色色调的聚合色素,从而造成酒体黄色色调增强。相比于对照组,实验组葡萄酒经过陈酿后,整体L*(除PTZ 与ECA组)比对照组更低,a*与b*明显高于对照组,说明外源单宁添加可以稳定葡萄酒的红色色调,有一定的护色效果。其中,PTZ 与ECA 的a*明显高于其他组,色调更偏红色,相比对照组,PTZ 组和ECA 组a*值在陈酿后分别提升了38.19%、27.76%。而BRE 组拥有最高的b*值,颜色更偏橙黄色调。从图5 中可以看出,此时各组葡萄酒颜色存在明显的差异,PTZ与ECA 组与陈酿前色差最少,紫红色色素保留情况良好,颜色最为鲜艳。而BSO 与BRE 组比对照组色泽更深,色泽偏灰褐色调,葡萄酒中的多酚氧化酶(PPO、POD 等)可以通过调节酚类化合物的生物合成及其氧化作用来促进褐变过程,多酚氧化酶不仅可以催化单酚羟基化为双酚,而且可以催化双酚氧化为醌,醌也会进一步与其它葡萄酒化合物发生聚合或缩合反应,产生黑色或褐色类的色素类物质[32]。在上部分的研究中,发现BSO 与BRE 组的总酚含量明显高于其他组的,出现此类颜色的原因可能是更多的多酚类物质被氧化造成酒中褐色色素的堆积。在此部分,发现不同酿酒单宁在陈酿过程中都会对葡萄酒红色色素进行不同程度的保留,而不同单宁处理后,颜色差异明显,其中PTZ 与ECA 组颜色保留效果最好。
2.5 陈酿过程单体花色苷变化及相关性
利用高效液相色谱检测3 类对葡萄酒颜色具有重要影响的单体花色苷。从图6 可以看出,单葡萄糖苷花色苷在三类单体花色苷中相对含量占比最大,各单宁处理组单葡萄糖苷花色苷的含量随着发酵的进行呈先增长后下降的趋势,且在苹果酸-乳酸发酵完成时达到最大值。Gordillo 等[33]的研究表明发酵阶段各种花色苷进入葡萄酒中,葡萄酒色泽风格也在此时最为明显。在陈酿120 d 时,PTZ 组的单葡萄糖苷花色苷含量比对照组提高了36.61%,而其他单宁处理组差异不明显但均高于对照组。单葡萄糖苷花色苷使酒体呈现蓝色色调,也可与其他物质结合形成更稳定的化合物,起到辅色的作用,使葡萄酒颜色更稳定[34]。

图6 发酵及陈酿过程中不同种类花色苷含量变化Fig.6 Changes of different anthocyanins content during fermentation and aging
葡萄酒中的吡喃花色苷主要是在发酵和陈酿过程中生成的小分子化合物,是单葡萄糖苷花色苷、乙酰化花色苷与乙醛、丙酮、丙酮酸、咖啡酸、4-乙烯基苯酚、4-乙烯基丁香酚、α-酮戊二酸等化合物反应形成的新的环化化合物[35]。有研究表明[36-37],吡喃化合物对葡萄酒橙色的贡献更大,比一般花色苷的颜色高11 倍(pH2.0)左右。吡喃花色苷较其他两种花色苷的含量较少,且在发酵初期葡萄酒中几乎不存在,随着发酵的进行逐渐呈上升趋势。酒精发酵完成时,其含量达到峰值,且高于对照组。吡喃花色苷在苹果酸-乳酸发酵及陈酿期间呈下降趋势,在陈酿120 d时,PTZ 组的吡喃花色苷含量比对照组高21.49%,而其他单宁处理组吡喃花色苷含量低于对照组。
葡萄酒中乙酰化花色苷是指单葡萄糖苷花色苷与对香豆酸、咖啡酸、阿魏酸等通过酰化作用形成,其具有的酰化基团在微酸性条件下可以更好地稳定葡萄酒颜色[38]。酒精发酵完成时,其含量达到峰值,且高于对照组。乙酰化花色苷在苹果酸-乳酸发酵及陈酿期间呈下降趋势,陈酿120 d 后,PTZ 组乙酰化花色苷含量最高,而其他组别葡萄酒中乙酰化花色苷含量差异不大。
为了更好探究葡萄酒色度与单体花色苷的相关性,对陈酿期间的色度与花色苷情况进行相关性网络图分析(图7),图中保留了具有统计学意义(P<0.05,|r|>0.6)的13 种花色苷。由图7 可知,L*与7 种单体花色苷负相关,含量越高,酒体亮度越低(|r|>0.6)。a*与12 种单体花色苷正相关(|r|>0.6),b*与10 种单体花色苷负相关(|r|>0.6),陈酿过程中,单体花色苷含量下降是导致a*下降(紫色降低),b*上升(黄色增加)的主要原因。但并不是所有的花色苷都是这样的规律,部分乙酰化花色苷对颜色有着相反的作用。其中,乙酰化二甲基花翠素-3-O-葡萄糖苷表现为高浓度时对红黄色调都有抑制作用,颜色偏灰色调。而花翠素-3-O-乙酰化葡萄糖苷与香豆酰化3'-甲基花翠素-3-O-葡萄糖苷则对黄色调有促进作用。同时,还发现虽然单体葡萄糖苷花色苷在葡萄酒中相对占比最大,但对葡萄酒颜色影响程度不如乙酰化花色苷与吡喃花色苷。总而言之,单体花色苷的组成以及含量与葡萄酒的颜色存在重要关联的相关性,不同单宁处理后,会影响葡萄酒的单体酚的含量与组成,形成不同颜色特点的葡萄酒。

图7 陈酿过程中单体花色苷、色差相关性共线网络图Fig.7 Correlation network diagram of monomer anthocyanins and color difference during aging
2.6 葡萄酒感官评价
考虑消费需求,除颜色外应考虑葡萄酒的感官特点。基于人的嗅觉、视觉、味觉进行感官评价,从酒体色泽、香气、口感、质地等,全方面分析不同单宁作用后葡萄酒的品质,结果如表2 所示。可以得出,实验组葡萄酒总分均高于对照组,特别是在香气与口感方面,这可能与单宁增加乙酰辅酶a 中脱羧或脱氢酶的酶活性从而促进酯类物质的生成有关[38],葡萄酒体现出更好的收敛性和层次感,PTZ 组总分最高,达到了86.7 分。

表2 不同组葡萄酒感官评价得分Table 2 Sensory evaluation scores of different groups of wines
3 结论
以赤霞珠葡萄酒为原料,添加不同酿酒单宁进行葡萄酒酿造,并进行120 d 的陈酿。在发酵完成以及陈酿过程中通过总酚、总花色苷、总黄烷醇、单体花色苷含量、色度值以及感官品评来进行分析。结果表明:酿酒单宁能显著提升葡萄酒总酚含量,BSO 组与BRE 组(水解单宁)效果最明显。同时,酿酒单宁会结合酒样中的游离花色苷形成更稳定的共价化合物使总花色苷含量下降,同时改变酒体颜色。在陈酿120 d 后,PTZ、ECA 以及EFC 三种缩合单宁处理的葡萄酒a*变化更小,红色调损失更少,特别是PTZ 组,颜色依然呈现紫红色。而水解单宁BSO 与BRE 处理的葡萄酒颜色加深,酒体偏褐色。陈酿过程中,酒体颜色变化的主要原因是单葡萄糖苷花色苷、乙酰化花色苷、吡喃花色苷含量的下降,此时葡萄酒红色色调减弱,黄色色调加深,而本研究发现部分酰化花色苷(乙酰化二甲基花翠素-3-O-葡萄糖苷、花翠素-3-O-乙酰化葡萄糖苷、香豆酰化3'-甲基花翠素-3-O-葡萄糖)对葡萄酒颜色起到和其他单体花色苷相反的影响。单宁的添加会对葡萄酒的感官造成积极的影响,同时形成不同的颜色特点的葡萄酒,而缩合单宁组特别是PTZ 组在葡萄酒辅色方面最突出,颜色最稳定,感官评价总分达到86.7 分,葡萄酒品质更好。
——“单宁”

