姜黄素通过调控HIF-1α/miR-760/LTBP2机制轴抑制口腔黏膜下纤维化的效果研究*
张 琳,谭 劲,刘一平,陈世娟,朱可可
(湖南中医药大学第一附属医院,湖南 长沙 410007)
口腔黏膜下纤维化是常见口腔疾病,表现为口腔黏膜出现固有层纤维组织变性和上皮层萎缩等病理变化,黏膜组织逐渐硬化,张口受限。该病不仅影响口腔功能,还极易发展为口腔癌[1]。我国湖南湘潭、台湾地区是此病的高发区域,可能与槟榔等长期刺激、维生素缺乏、遗传等因素有关。本病多采用外源性酶类、糖皮质激素、手术等方式治疗,但治疗效果有限[2-3]。
越来越多的研究[4-5]报道,天然药物对于口腔黏膜下纤维化的防治有积极作用。姜黄素是一种从姜科植物姜黄等的根茎中提取得到的黄色色素,具有丰富的药理活性。关于姜黄素在改善口腔黏膜下纤维化方面已有报道[6-7],但其分子层面的作用机制仍有待深入分析。缺氧诱导因子-1α(HIF-1α)信号通路在口腔黏膜下纤维化的发生发展中有重要的调控作用[8]。本研究将从HIF-1α信号通路角度,分析姜黄素抑制口腔黏膜下纤维化的作用机制,以期为姜黄素的临床应用提供依据。
1 材料与方法
1.1 实验动物 40只6~8周龄SPF级雄性SD大鼠,体质量200~240 g,购自湖南斯莱克景达实验动物公司,动物生产许可证号:SCXK(湘)2021-0005。饲养条件:温度22~25 ℃,相对湿度50%~70%,每12 h进行昼夜交替。适应性饲养3 d后进入实验。本研究已通过医学实验动物管理委员会批准(批准号202108106)。
1.2 药物与试剂 姜黄素(批号:2021063005)购自北京凯瑞基生物公司;槟榔碱(批号:S0244)购自美国Sigma公司;醋酸曲安奈德注射液(批号:210402,国药准字H20063226)购自上海旭东海普药业公司;转化生长因子β1(TGF-β1)ELISA试剂盒(批号:2022011530)、Ⅲ型胶原蛋白(ColⅢ)ELISA试剂盒(批号:2022030811)、干扰素γ(IFN-γ)ELISA试剂盒(批号:2021120518)均购自上海抚生实业公司;Trizol试剂(批号:c11562-005)购自美国Invitrogen公司;逆转录试剂盒(批号:21120504)、SYBR Green Master Mix(批号:21102010)均购自南京诺唯赞生物科技公司;HIF-1α、微小RNA-760(miR-760)、潜在转化生长因子结合蛋白2(LTBP2)引物由北京阅微基因公司提供;HIF-1α抗体(批号:ab51608)、LTBP2抗体(批号:ab158832)均购自美国Abcam公司。
1.3 主要仪器 iMark酶标仪(美国BIO-RAD);7500Fast荧光定量PCR仪(美国Life TechnoLogies);GelSMART凝胶成像仪(北京大龙兴创实验仪器公司)。
1.4 造模与分组 40只SD大鼠中随机取10只作为正常组,正常饲养不作处理;另30只大鼠采用槟榔碱诱导口腔黏膜下纤维化模型。即腹腔注射戊巴比妥钠麻醉大鼠,打开并固定大鼠口腔,暴露口腔颊黏膜,注入10 mg/mL槟榔碱溶液0.2 mL,每2 d注射1次,注射后再用医用棉签蘸取槟榔碱溶液在颊黏膜涂擦20次,1次/d,连续处理8周;若大鼠张口明显受限,颊黏膜苍白、发硬,且形成游离条索物,提示模型构建成功[9]。将上述模型大鼠随机分为模型组、姜黄素组和阳性对照组,每组10只。
1.5 实验给药 姜黄素组大鼠予400mg/kg姜黄素灌胃[10],阳性对照组大鼠予80 mg/mL曲安奈德皮下注射[11],正常组和模型组大鼠灌胃给予等体积生理盐水。1次/d,连续给药8周。
1.6 观察指标
1.6.1 大鼠张口度 于大鼠下中切牙施以2牛顿的开口力打开口腔,测量上、下前牙切缘的距离,即为张口度。
1.6.2 HE染色观察颊黏膜组织变化 对大鼠颊黏膜作大体评估,采用症状分级法,对颊黏膜色泽、纤维条索和光滑度进行评估,无症状、轻度、中度及重度分别评估0、1、2、3分。腹腔注射戊巴比妥钠麻醉大鼠,采集两侧颊黏膜组织,分为3份,其中1份固定于4%多聚甲醛,制备组织切片,行HE染色,观察颊黏膜组织病理变化,1份制备组织匀浆液待测,剩余1份放置于液氮待测。
1.6.3 ELISA法检测颊黏膜组织纤维化标志物表达 每组取5只大鼠颊黏膜组织,制备匀浆液,参照ELISA试剂盒操作,检测TGF-β1、ColⅢ和IFN-γ表达。
1.6.4 实时荧光定量PCR检测HIF-1α mRNA、miR-760 mRNA、LTBP2 mRNA水平 每组取5只大鼠颊黏膜组织,添加Trizol试剂提取总RNA,逆转录获取cDNA模板,再添加SYBR Green Master Mix、引物行实时荧光定量PCR扩增。HIF-1α上游引物5'-CCATTAGAAAGCAGTTCCGC-3',下游引物5'-TGGGTAGGAGATGGAGATGC-3';miR-760上游引物5'-ACACTCCAG CTGGGCGGCTCTGGGTCTG-3',下游引物5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCCCCACA-3';LTBP2上游引物5'-TTACAAGCAGAGACTCACT-3',下游引物5'-ACAACAGAAGAGACCAGAT-3'。反应条件为95 ℃预变性5 min,95 ℃变性15 s,60 ℃退火20 s,72 ℃延伸10 s,共40个循环。采用2-△△Ct法定量计算HIF-1α mRNA、miR-760 mRNA、LTBP2 mRNA水平。
1.6.5 蛋白印迹检测HIF-1α和LTBP2蛋白表达 每组取5只大鼠颊黏膜组织,添加裂解液提取总蛋白,测定浓度后定量取50 μg蛋白置于沸水浴变性,再上样至SDS-PAGE凝胶电泳,转膜后置于5%脱脂牛奶中封闭2 h,添加稀释比1∶1000一抗,4 ℃下摇床孵育过夜,次日再添加稀释比1∶5000二抗,37 ℃下摇床孵育40 min,显色后测量灰度值。
1.7 统计学方法 应用统计学软件SPSS 26.0处理,数据以(±s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠张口度和颊黏膜评分比较 与正常组比较,模型组大鼠张口度明显减小(P<0.05),颊黏膜评分明显升高(P<0.05);与模型组比较,姜黄素组和阳性对照组大鼠张口度均明显增大(P<0.05),颊黏膜评分均明显降低(P<0.05),且姜黄素组大鼠张口度大于阳性对照组(P<0.05),颊黏膜评分低于阳性对照组(P<0.05)。(见表1)
表1 各组大鼠张口度和颊黏膜评分的比较 (±s)

表1 各组大鼠张口度和颊黏膜评分的比较 (±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05。
组别n张口度/mm颊黏膜评分/分正常组107.52±0.560.00±0.00模型组103.18±0.34a2.20±0.63a姜黄素组105.26±0.68b c0.40±0.52b c阳性对照组 104.36±0.53b0.90±0.32b F 114.53447.594 P 0.0000.000
2.2 各组大鼠颊黏膜组织病理学改变情况 正常组大鼠颊黏膜上皮结构完整,未见炎症细胞浸润;模型组大鼠颊黏膜上皮结构萎缩,固有层下粉色纤维沉积显著,伴有大量的炎症细胞浸润;姜黄素组和阳性对照组大鼠颊黏膜固有层下粉色纤维沉积,上皮层结构较模型组明显改善。(见图1)
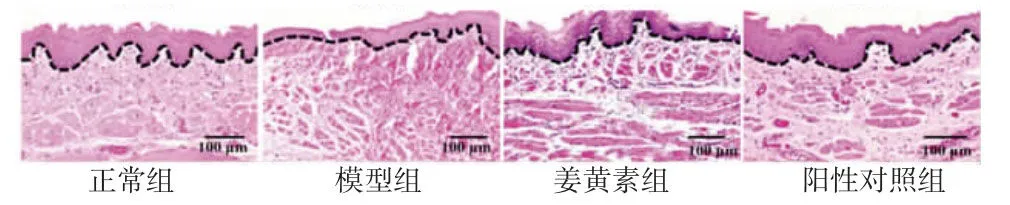
图1 各组大鼠颊黏膜组织病理切片图 (×100)
2.3 各组大鼠颊黏膜组织纤维化标志物表达比较 与正常组比较,模型组大鼠颊黏膜组织TGF-β1、ColⅢ和IFN-γ表达均明显升高(P<0.05);与模型组比较,姜黄素组和阳性对照组大鼠颊黏膜组织TGF-β1、ColⅢ和IFN-γ表达均明显降低(P<0.05),且姜黄素组大鼠颊黏膜组织TGF-β1、ColⅢ和IFN-γ表达均低于阳性对照组(P<0.05)。(见表2)
表2 各组大鼠颊黏膜组织纤维化标志物表达比较 (±s)
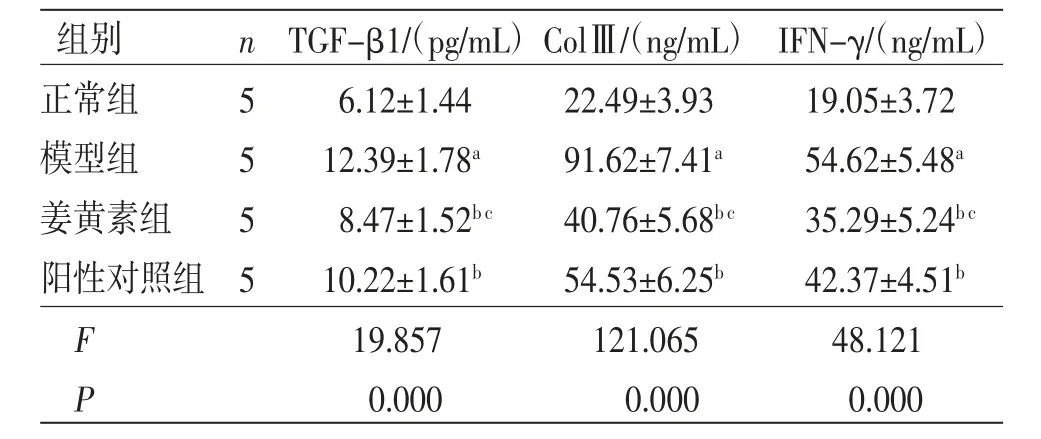
表2 各组大鼠颊黏膜组织纤维化标志物表达比较 (±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05。
组别n TGF-β1/(pg/mL)ColⅢ/(ng/mL) IFN-γ/(ng/mL)正常组56.12±1.4422.49±3.9319.05±3.72模型组512.39±1.78a91.62±7.41a54.62±5.48a姜黄素组58.47±1.52b c40.76±5.68b c35.29±5.24b c阳性对照组 510.22±1.61b54.53±6.25b42.37±4.51b F 19.857121.06548.121 P 0.0000.0000.000
2.4 各组大鼠颊黏膜组织HIF-1α mRNA、miR-760 mRNA、LTBP2 mRNA相对表达量比较 与正常组比较,模型组大鼠颊黏膜组织miR-760 mRNA、HIF-1α mRNA、LTBP2 mRNA相对表达量均明显升高(P<0.05);与模型组比较,姜黄素组和阳性对照组大鼠颊黏膜组织miR-760 mRNA、HIF-1α mRNA、LTBP2 mRNA相对表达量均明显降低(P<0.05),且姜黄素组大鼠颊黏膜组织miR-760 mRNA、HIF-1α mRNA、LTBP2 mRNA相对表达量均低于阳性对照组(P<0.05)。(见表3)
表3 各组大鼠颊黏膜组织HIF-1α mRNA、miR-760mRNA、LTBP2 mRNA 相对表达量比较 (±s)
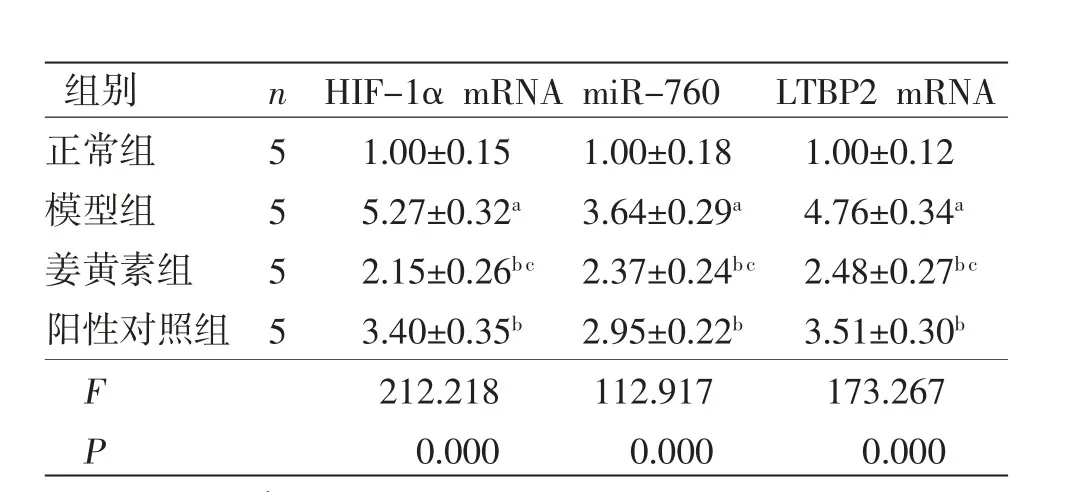
表3 各组大鼠颊黏膜组织HIF-1α mRNA、miR-760mRNA、LTBP2 mRNA 相对表达量比较 (±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05。
mRNA、LTBP2 mRNA 相对表达量比较 (images/BZ_26_835_2183_858_2229.png±s)组别n HIF-1α mRNA miR-760LTBP2 mRNA正常组51.00±0.151.00±0.181.00±0.12模型组55.27±0.32a3.64±0.29a4.76±0.34a姜黄素组52.15±0.26b c 2.37±0.24b c 2.48±0.27b c阳性对照组 53.40±0.35b2.95±0.22b3.51±0.30b F 212.218112.917173.267 P 0.0000.0000.000
2.5 各组大鼠颊黏膜组织HIF-1α、LTBP2蛋白相对表达量比较 与正常组比较,模型组大鼠颊黏膜组织HIF-1α、LTBP2蛋白相对表达量均明显升高(P<0.05);与模型组比较,姜黄素组和阳性对照组大鼠颊黏膜组织HIF-1α、LTBP2蛋白相对表达量均明显降低(P<0.05),且姜黄素组大鼠颊黏膜HIF-1α、LTBP2蛋白表达均低于阳性对照组(P<0.05)。(见表4、图2)

图2 各组大鼠颊黏膜组织HIF-1α、LTBP2 蛋白表达Western blotting 图
表4 各组大鼠颊黏膜组织HIF-1α 和LTBP2 蛋白相对表达量比较 (±s)
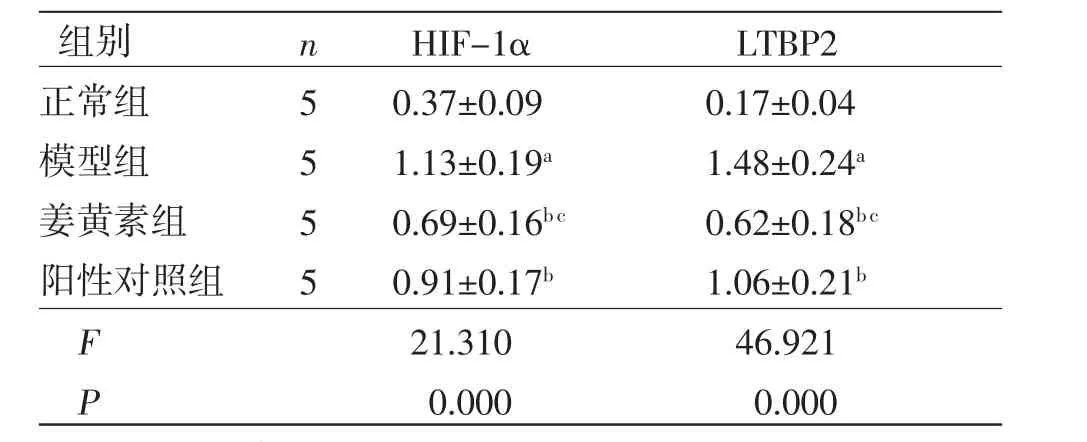
表4 各组大鼠颊黏膜组织HIF-1α 和LTBP2 蛋白相对表达量比较 (±s)
注:与正常组比较,aP<0.05;与模型组比较,bP<0.05;与阳性对照组比较,cP<0.05。
组别nHIF-1αLTBP2正常组50.37±0.090.17±0.04模型组51.13±0.19a1.48±0.24a姜黄素组50.69±0.16b c0.62±0.18b c阳性对照组50.91±0.17b1.06±0.21b F 21.31046.921 P 0.0000.000
3 讨论
研究[12]显示,槟榔碱是槟榔产品致病的主要因素。既往研究常用博来霉素诱导口腔黏膜下纤维化动物模型,但该药物注射还会导致肺部纤维化,与临床槟榔致病情况存在差异[13]。本研究采用颊黏膜注射槟榔碱+涂擦槟榔碱的方法,成功建立口腔黏膜下纤维化大鼠模型,模拟咀嚼槟榔情况,符合临床致病过程。结果显示,姜黄素可增大模型大鼠张口度,减轻颊黏膜组织病理损伤,且作用效果优于阳性对照药物曲安奈德,证实姜黄素可改善口腔黏膜下纤维化。
口腔黏膜下纤维化发病过程中涉及多种细胞因子的参与,如上皮间质转化、基质合成、胶原沉积等[14]。TGF-β1是重要的细胞分化、存活、增殖和行为诱导信号分子,可介导上皮间充质转化促进纤维化[15]。ColⅢ是组织纤维化细胞外基质的主要成分,参与纤维间隔的形成。其水平升高将加重组织纤维化程度[16]。IFN-γ主要参与宿主免疫调节。在各类纤维化模型中,IFN-γ含量与炎症反应密切相关[17]。本研究中,应用姜黄素干预后,大鼠颊黏膜组织中TGF-β1、ColⅢ、IFN-γ表达均明显降低,提示姜黄素能通过降低TGF-β1和IFN-γ因子表达,减少ColⅢ沉积,从而减轻口腔黏膜下纤维化。这与前期研究[10]报道相符。
多项研究[18-19]表明,口腔黏膜下纤维化病变导致局部血运受阻,组织缺氧将激活HIF-1α信号,诱导下游TGF-β1等因子转录,进一步促进纤维化。miR-760是一种新型肿瘤标志物。研究[20]显示,缺氧可诱导miR-760表达,加重心肌损伤。降低miR-760表达可介导靶基因,增强硫化氢对心肌缺血再灌注损伤的保护作用。miR-760与LTBP2存在靶向关系。LTBP2属于细胞外基质糖蛋白,主要表达于肺、皮肤和大血管组织中,作为TGF-β1潜在复合物参与组织纤维化及重塑过程[21]。LI H等[22]研究发现,LTBP2在肺纤维化体内、外模型中表达上调,是超增强子驱动致病的基因之一。本研究发现,姜黄素组miR-760 mRNA、HIF-1α mRNA、LTBP2 mRNA及HIF-1α蛋白表达均明显降低,这可能是姜黄素抑制口腔黏膜下纤维化的潜在机制。
综上所述,姜黄素可能降低HIF-1α、miR-760、LTBP2表达,降低转录因子TGF-β1和免疫调节因子IFN-γ表达,减少ColⅢ沉积,抑制口腔黏膜下纤维化。本研究为阐明姜黄素改善口腔黏膜下纤维化的作用机制提供了新证据,但由于条件和时间限制,姜黄素作用下HIF-1α、miR-760、LTBP2的具体调控途径还需要进一步研究。

