金水葶苓汤对肺癌移植瘤恶性胸腔积液模型小鼠的治疗作用及机制研究*
赵林涛,缑 娇,王松海,杨宝钢,郭弈飞,宋延平,杨晨光
(1.陕西省中医药研究院,陕西 西安 710003;2.陕西省中医医院,陕西 西安 710003;3.陕西中医药大学,陕西 咸阳 712046)
恶性胸腔积液(malignant pleural effusions,MPE)是指机体在病理状态下产生液体并积聚于胸膜腔内的病症,可导致呼吸困难、胸闷、气喘、难以平卧等症状。恶性胸腔积液几乎在所有恶性肿瘤患者的晚期出现,尤其以肺癌为主,11%~32%的进展期非小细胞肺癌患者会出现恶性胸腔积液。尽管目前治疗方案有所进展,但预后仍然很差,平均生存期仅4~9个月[1]。在临床上恶性肿瘤如果合并胸腔积液,就表示病变可能已经局部或全身扩散,预后非常差,是手术难以治愈的晚期疾病标志。这时治疗的主要目的转变为有效地控制胸腔积液,缓解临床症状,提高生活质量,延长生存期。目前MPE主要治疗方法有胸腔内置引流管、局部注射药物及胸膜固定术等,大多为姑息性对症治疗[2]。抑制原发灶和转移灶的发展,控制住胸腔积液产生,以及改善胸腔积液引流将可能是治疗MPE较为理想的方法。中医药利用不同于西医的思路,在MPE的治疗中逐渐发挥了重要作用。近年来许多学者进行了大量使用中医药治疗MPE的临床研究,结果表明中医药在治疗MPE方面确实具有一定优势,但是相关作用机制尤其是分子层面的研究却较少开展[3]。本研究拟复制小鼠肺癌MPE模型,使用金水葶苓汤进行干预,探讨本方抑制MPE的生成及作用的机制。
1 材料与方法
1.1 实验动物 SPF级8周龄雄性C57BL/6J小鼠83只,体质量18~22 g,购自西安交通大学医学部实验动物中心,动物生产许可证号:SCXK(陕)2018-001,动物合格证号:NO.1201。实验小鼠购回后适应性喂养7 d,小鼠身体状况良好,行为正常。动物室温度保持在20~25 ℃;相对湿度保持在45%~70%。保持门窗密闭,使用空气净化系统,送新风全口开启,送风机隔日换机1次。饲料和垫料由钴-60照射处理,每天清扫地面、笼具架和墙壁,并用紫外线消毒1次,实验前后认真洗手和用75%酒精棉球消毒。动物处死方式为颈椎脱臼法。实验研究方案通过陕西省中医药研究院实验动物伦理委员会审查,批准号:2022动物伦审第(20号)。
1.2 药物与试剂 金水葶苓汤,方药组成:熟地黄90 g,当归30 g,炒山药30 g,山茱萸30 g,茯苓30 g,猪苓30 g,泽泻30 g,葶苈子30 g,海金沙30 g,鸡内金10 g,砂仁0.5 g。中药饮片均购自陕西省中医医院,批号:20201215。以上药物经陕西省中医药研究院鉴定研究室鉴定为正品。将上述药物10倍水量煎煮2次,浓缩为生药质量浓度为1 g/mL药液,备用。顺铂(规格:10 mg,批号:20200223)购自齐鲁制药有限公司;牛血清(批号:U-02L20115)购自Biological industries公司;Lewis肺癌细胞株(Pro0cell CL-0140)购自武汉普诺赛生命科技有限公司;Lewis肺癌细胞专用培养基(批号:20201125)购自武汉普诺赛公司;胰酶(批号:20190910)、双抗(批号:20190822)购自solarbio公司;兔抗鼠AQP1抗体(批号:GR55316)、兔抗鼠VEGF抗体(批号:GR43312)购自abcam公司;二抗山羊抗兔(批号:2019A01126)购自北京中杉金桥生物技术有限公司;内参β-actin(批号:20200108)购自武汉三鹰生物技术有限公司。
1.3 主要仪器 Heracell 150i GP型CO2细胞培养箱(美国Thermo公司);TS100型倒置显微镜(日本尼康公司);蛋白转印系统(美国伯乐公司);ChemiDoc XRS型化学发光凝胶成像系统(美国伯乐公司);IMARK酶标仪(美国伯乐公司)。
1.4 造模与分组
1.4.1 细胞培养 从-80 ℃冰箱中取出Lewis肺癌细胞冻存管,放置于37 ℃恒温水浴锅中于1 min内使其迅速溶解,将溶解后的细胞混悬液转入离心管,1000 r/min(离心半径为10 cm)离心5 min,弃去上清液,加入1 mL培养液吹打,重悬,均匀接种于含4 mL培养液的培养瓶,Lewis肺癌细胞的完全培养液为含10%胎牛血清及双抗[青霉素(100IU/mL),链霉素(100IU/mL)]的Lewis肺癌细胞专用培养基,培养温度为37 ℃、培养环境为5%CO2。培养时,每2~3 d更换培养液,待细胞长至70%~80%时则进行传代。
1.4.2 造模与分组 取雄性C57BL/6J小鼠83只,按照随数字表法随机分为空白组、模型组、金水葶苓汤组、金水葶苓汤+顺铂组、顺铂组,其中模型组19只,其余各组16只。收集处于对数生长期生长状态良好的Lewis肺癌细胞,制备成密度为5.0×106个/mL的细胞悬液。接种前用75%乙醇消毒小鼠胸部右侧皮肤,用1 mL注射器吸取细胞悬液,轻轻摇动使细胞悬液混匀,从小鼠右侧胸部靠近腋中线,约平第6肋间隙,针头向上与胸壁成30°夹角,注射入胸腔,接种密度为2.5×106个/mL的细胞悬液,0.2 mL/只。根据前期研究的经验,于接种第8天从模型组随机抽取3只大鼠,解剖胸腔,观察发现3只大鼠均有一定的胸腔积液产生,提示造模成功。
1.5 实验给药 各组于肿瘤细胞接种造模3 d后给药,金水葶苓汤组小鼠灌胃给予金水葶苓汤,剂量为44.2 g(生药材)/kg,1次/d;金水葶苓汤+顺铂组小鼠腹腔注射顺铂,剂量为6 mg/kg,隔3 d注射1次,同时灌胃给予金水葶苓汤,剂量为44.2 g(生药材)/kg,1次/d;顺铂组小鼠腹腔注射顺铂,剂量为6 mg/kg,隔3 d注射1次;空白组、模型组灌胃给予等体积生理盐水,1次/d;灌胃体积均为20 mL/kg,连续给药10 d。给药结束后,每组取8只小鼠处死,检测MPE体积和肿瘤质量,每组剩余8只小鼠进行生存期观察。
1.6 观察指标
1.6.1 小鼠体质量在接种当天及第3、7、10、14天分别称量小鼠体质量。
1.6.2 小鼠MPE体积 给药结束后,处死小鼠,解剖小鼠,暴露横膈,用1 mL注射器抽取恶性胸腔积液,并测量其体积。
1.6.3 小鼠胸壁转移瘤计数、转移瘤质量 抽取胸腔积液后,剪开小鼠胸腔,观察胸腔肿瘤的发生情况,并在体视显微镜下计数前、侧、后胸壁转移瘤个数,然后剥离胸壁转移瘤并称其质量。
1.6.4 小鼠生存期 记录剩余各组小鼠自造模开始后直至自然死亡的生存时间,用GraphPadPrism 9软件绘制小鼠生存曲线。
1.6.5 Western blotting法检测壁层胸膜AQP1和胸腔积液中VEGF蛋白表达情况 各组分别取5只小鼠的壁层胸膜组织100 mg,胸腔积液200μL,加入RIPA,提取总蛋白,采用BCA法进行蛋白定量,取等量蛋白上样,用10%十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)凝胶电泳,随后转移至PVDF膜上,将PVDF膜孵育在新鲜的封闭缓冲液(5%脱脂奶粉)中,室温下1 h,然后用AQP1和VEGF抗体孵育(β-actin作为内参),4 ℃过夜。TBST洗涤3次,加入辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体(1∶2000),室温1 h,TBST洗膜,ECL发光液进行化学发光检测,化学发光凝胶图像仪扫描分析处理。采用Image J软件对条带进行灰度分析,以目的蛋白灰度值和内参灰度值的比值作为目的蛋白相对表达量。
1.7 统计学方法 采用SPSS 23.0软件进行统计分析,计量资料以“均数±标准差”(±s)表示,多组间比较采用单因素方差分析,重复测量数据使用重复测量资料的方差分析。非正态分布资料多组间比较采用Kruskal-Wallis H检验,两组间比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠体质量比较 接种时,各组小鼠体质量基本一致。接种后,时间因素对各组小鼠体质量的影响差异有统计学意义(F=37.651,P=0.000),即空白组小鼠体质量随时间推移呈上升趋势(P<0.05);模型组、金水葶苓汤组、金水葶苓汤+顺铂组和顺铂组小鼠体质量随着时间的推移均有所下降(P<0.05),以顺铂组体质量下降最为明显,而金水葶苓汤组和金水葶苓汤+顺铂组小鼠体质量下降较缓慢。各组小鼠体质量总体比较,差异有统计学意义(F=46.868,P=0.000)。与空白组比较,模型组小鼠接种第7天、第10天、第14天体质量明显降低(P<0.01);与模型组比较,顺铂组小鼠接种第10天、第14天体质量明显降低(P<0.05或P<0.01),金水葶苓汤组小鼠体质量明显升高(P<0.05);与顺铂组比较,金水葶苓汤组及金水葶苓汤+顺铂组小鼠体质量均有所改善,且差异有统计学意义(P<0.01);其余各组间小鼠体质量比较,差异无统计学意义(P>0.05)。分组因素与时间因素存在交互效应(F=7.672,P=0.000)。(见表1、图1)
表1 各组小鼠体质量比较 (±s,g)
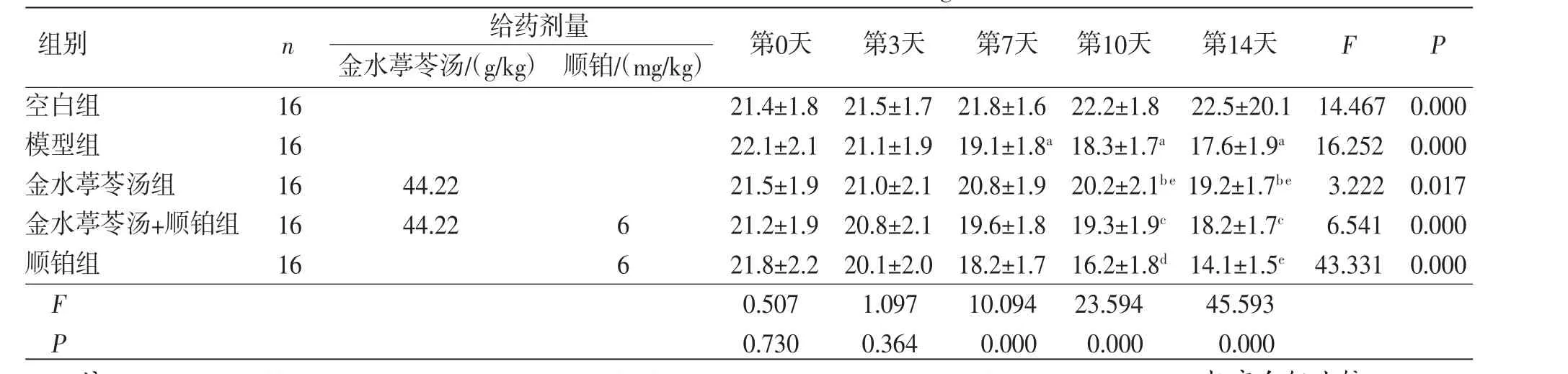
表1 各组小鼠体质量比较 (±s,g)
注:F时间主效应=37.651,P时间主效应=0.000;F分组主效应=46.868,P时间主效应=0.000;F交互效应=7.672,P交互效应=0.000;与空白组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01;与顺铂组比较,dP<0.05,eP<0.01。
给药剂量金水葶苓汤/(g/kg) 顺铂/(mg/kg)空白组1621.4±1.821.5±1.721.8±1.622.2±1.822.5±20.114.4670.000模型组1622.1±2.121.1±1.919.1±1.8a 18.3±1.7a 17.6±1.9a 16.2520.000金水葶苓汤组1644.2221.5±1.921.0±2.120.8±1.920.2±2.1be 19.2±1.7be 3.2220.017金水葶苓汤+顺铂组 1644.22621.2±1.920.8±2.119.6±1.819.3±1.9c 18.2±1.7c6.5410.000顺铂组16621.8±2.220.1±2.018.2±1.716.2±1.8d 14.1±1.5e 43.3310.000 F 0.5071.09710.09423.59445.593 P 0.7300.3640.0000.0000.000第0天第3天第7天 第10天第14天FP组别n

图1 各组小鼠体质量交互效应轮廓图
2.2 各组小鼠MPE体积比较 模型组小鼠可见有大量恶性胸腔积液。与模型组比较,金水葶苓汤组、金水葶苓汤+顺铂组、顺铂组小鼠MPE体积均明显降低(P<0.01或P<0.05),且金水葶苓汤+顺铂组、顺铂组小鼠MPE体积明显低于金水葶苓汤组(P<0.01)。(见图2)
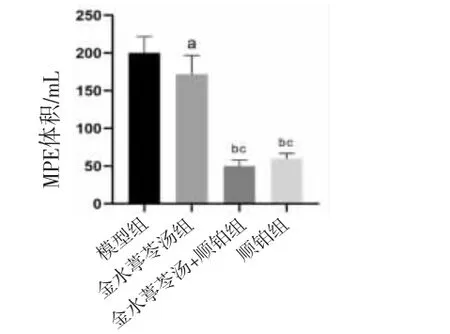
图2 各组小鼠MPE 体积比较 (±s,n=8)
2.3 各组小鼠胸壁转移瘤计数及转移瘤质量比较 与模型组比较,金水葶苓汤组、金水葶苓汤+顺铂组、顺铂组小鼠胸壁转移瘤数量及转移瘤质量均明显降低(P<0.01),且金水葶苓汤+顺铂组、顺铂组小鼠胸壁转移瘤数量及转移瘤质量均明显低于金水葶苓汤组(P<0.01)。(见图3~5)
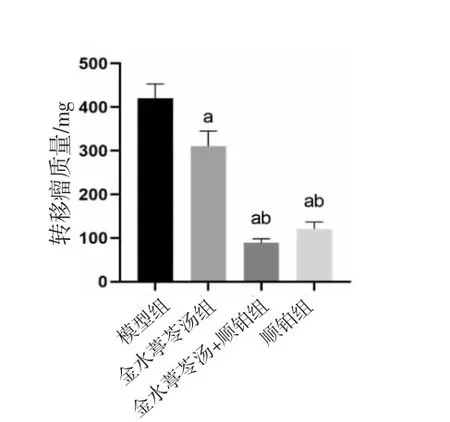
图4 各组小鼠胸壁转移瘤质量比较 (±s,n=8)
图5 肺癌小鼠解剖图
2.4 各组小鼠生存期比较 各组小鼠于第19天陆续出现死亡,金水葶苓汤+顺铂组小鼠生存期最长,生存中位数为28.5 d,其次分别为金水葶苓汤组(26.5 d)、顺铂组(24.0 d),生存期最短为模型组(21.5 d)。与模型组比较,金水葶苓汤组、金水葶苓汤+顺铂组、顺铂组小鼠生存期均明显延长(P<0.01或P<0.05),且金水葶苓汤+顺铂组小鼠生存期明显长于金水葶苓汤组、顺铂组(P<0.06)。(见图6)
2.5 各组小鼠壁层胸膜AQP1和胸腔积液中VEGF蛋白相对表达量比较 与模型组比较,金水葶苓汤组、金水葶苓汤+顺铂组、顺铂组小鼠壁层胸膜AQP1和胸腔积液中VEGF蛋白相对表达量均明显降低(P<0.01)。(见图7~8)

图7 各组小鼠壁层胸膜AQP1 和胸腔积液中VEGF蛋白表达Western blotting 图
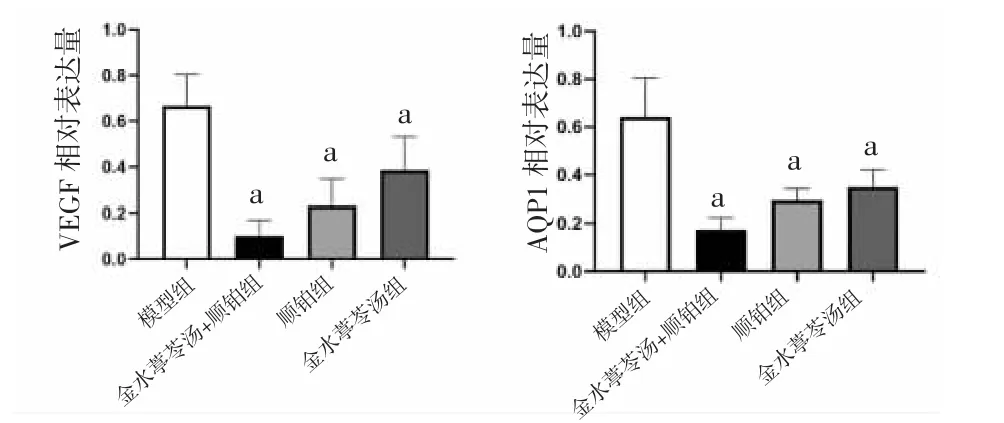
图8 各组小鼠壁层胸膜AQP1 和胸腔积液中VEGF蛋白相对表达量比较 (±s,n=5)
3 讨论
恶性胸腔积液在中医学中归属于“积饮”“悬饮”“支饮”等范畴。一般认为,胸腔积液的产生部位在肺,亦与脾、肾两脏关系密切。其主要病机为机体久病,日久伤正,而致正气亏虚。体虚日久可伤及脾肾。国内医家在临证时做了很多积极的探索,围绕气虚、阴虚和饮停这3种证候要素为基础进行辨证施治,认为血瘀水停是MPE重要的病因病机,并提出运用活血逐水法治疗MPE的理论。近年来,中药制剂(如榄香烯乳剂、鸦胆子油乳剂、艾迪注射液、复方苦参注射液等)联合化疗药物进行胸腔内灌注治疗等也取得了一定效果,但短期内复发率仍然很高[4],故探索新的治疗MPE的思路和方法对提高晚期癌症患者生活质量、减轻痛苦、延长生命具有积极地意义[5-6]。
本课题组在治疗MPE时按命门水火不足分型,取得了显著的效果,并初步确认了这一理论的价值[7]。MPE与腹水都是晚期肿瘤患者的常见合并症,有着“久病及肾”的共同病机,水饮为患的共同病理产物,以及预后凶险的共同趋势。前代医家所描述的命门水火亏虚而生水的临床表现中“嗽”“喘呼不能卧”“喘嗽不宁”等也是MPE的常见症状,笔者首次明确将此理论运用于MPE的治疗中,结果显示此法在防治非小细胞肺癌MPE方面有良好的疗效[8-9]。在临床经验的基础上,课题组凝练处方,形成以补益肝肾、利水化湿为治法,重用熟地黄为君药,治疗非小细胞肺癌MPE的金水葶苓汤。该方由熟地黄、当归、炒山药、枸杞子、山茱萸、海金沙、鸡内金、砂仁、葶苈子、茯苓、猪苓、泽泻等12味药物组成。此方的思路是MPE的核心病机在于命门真阴不足而致邪水横行,故治疗当峻补真阴,利水化湿。
现代研究表明,肿瘤血管生成和胸膜血管通透性增强是MPE形成的关键因素,肿瘤血管生成与MPE血管内皮生长因子(vascular endothelial growth factor,VEGF)有密切的关系[10]。VEGF可以促进血管内皮细胞增殖、分裂、迁移,从而诱导血管生成。VEGF可以由肿瘤细胞自分泌的IL-6通过信号转导和转录激活3(signal transducer and activator of transcription3,STAT3)通路促进表达,Stat3的激活还可以通过促进组织因子的表达来促进肿瘤细胞的增殖和血管生成进而促进MPE的形成[11]。当新生肿瘤血管壁的完整性受损且内皮细胞受损时,肿瘤血管具有较高的通透性,而血管通透性的增高不仅会导致血浆蛋白渗出,升高组织液浓度,抑制其回流,还会使正常组织的抗血管生成作用向促血管生成转化,从而促进MPE的生成[12]。水通道蛋白(aquqporin,AQPs)是近年来发现的在机体水液代谢中起着重要作用的跨膜转运蛋白,到目前为止共发现13个亚型。研究[13-15]显示,AQP1在小鼠胸膜间皮细胞上广泛表达,它与恶性肿瘤的生长、转移和癌性积液的形成关系密切。当MPE不断增加时,肺癌模型小鼠胸膜组织中AQPs-1基因的表达也不断增加,提示肺癌合并MPE与AQPs-1呈正相关。因此抑制AQPs-1的表达,可以减少恶性胸腔积液[16]。
本研究以胸腔注射Lewis细胞复制C57小鼠胸腔积液肺癌模型,观察金水葶苓汤及金水葶苓汤协同顺铂注射液对模型小鼠胸腔积液体积、胸壁转移瘤数量和转移瘤质量、生存时间的影响,同时本研究采用Western blotting法检测壁层胸膜中AQP1及胸腔积液中VEGF蛋白表达水平,评价金水葶苓汤对肺癌移植瘤胸腔积液小鼠的治疗作用。结果表明,经治疗后,金水葶苓汤组、顺铂组和金水葶苓汤+顺铂组小鼠体质量增长显著升高,胸腔积液体积降低,胸壁转移瘤数量和转移瘤质量减少,并且小鼠生存期延长,其中金水葶苓汤+顺铂组效果均优于金水葶苓汤组和顺铂组。本方可降低胸腔积液中VEGF及壁层胸膜中AQP1蛋白表达。金水葶苓汤可能的作用机制为通过降低模型小鼠VEGF蛋白表达,抑制STAT3通路激活,进而抑制胸膜毛细血管形成,抑制毛细血管通透性增加,从而减少胸腔积液形成。本方还可降低AQP1蛋白表达,减缓水液代谢和转运,抑制胸腔中的液体流入与流出失衡,进而抑制MPE生成。

