1 295 例静脉留置针不良事件分析及监管工作改进建议
李倩,孟艳秋 ,郭洁(通信作者)
1 郑州大学附属儿童医院·河南省儿童医院·郑州儿童医院 (河南郑州 450000);2 郑州市药物警戒中心 (河南郑州 450000)
静脉留置针作为头皮针的替代产品,主要由不锈钢针芯、外套管、塑料针座、针柄、隔离塞、延长管、肝素帽等部件组成。静脉留置针可随时打开静脉通道进行输液治疗,以减轻患者因反复穿刺带来的痛苦及护士的工作量,尤其在输注药物与抢救危重患者等方面发挥了重要作用,因而在临床上得到了广泛应用[1-3]。不同类型的静脉留置针由于使用材料、结构设计、制造工艺等环节差异性较大,具有一定的固有风险性。作为长时间植入人体的第三类医疗器械,静脉留置针的使用安全是临床普遍关注的重点问题[4-6]。国家药品监督管理局年度监测报告显示,2021 年度注输、护理类和防护器械不良事件报告达29 万余例,占总报告数量的49.85%,而静脉留置针作为使用最广泛的注输、护理类医疗器械之一,不良事件报告数量逐年增加。河南省静脉留置针生产企业众多,市场占有率较高,加强不良事件的收集、分析,对保障临床用械安全具有重要的现实意义。本研究通过整理河南省药品不良反应监测中心收集的河南省企业生产的静脉留置针不良事件报告,对不良事件的上报情况、患者情况、类型、表现进行统计学分析,最后针对静脉留置针不良事件监测提出改进建议,以控制潜在风险,保障患者用械安全。
1 资料与方法
1.1 资料来源
收集2020 年4 月至2021 年3 月河南省药品不良反应监测中心收到的河南省企业生产的静脉留置针不良事件报告,进行整理、汇总、分析,剔除错报、误报、重复上报及无效报告后共纳入1 295例不良事件报告。
1.2 方法
对1 295 例静脉留置针不良事件的上报情况、患者情况、类型、表现进行分析,探讨发生不良事件的原因,并针对静脉留置针不良事件监测工作提出改进建议,以降低不良事件发生风险。
2 结果
2.1 上报情况
1 295 例静脉留置针不良事件来自全国31 个省及直辖市,其中河南、河北、安徽、山东、湖南、四川、陕西7 个省上报数量较多,合计上报861 例(66.49%),见表1。

表1 1 295 例静脉留置针不良事件中上报数量较多的省
1295 例静脉留置针不良事件中,医疗机构上报1291 例(一级医院235 例、二级专科医院172 例、二级综合医院633 例、三级专科医院35 例、三级综合医院113 例、其他医院103 例),占99.69%;生产、经营企业上报4 例,占0.31%,见表2。
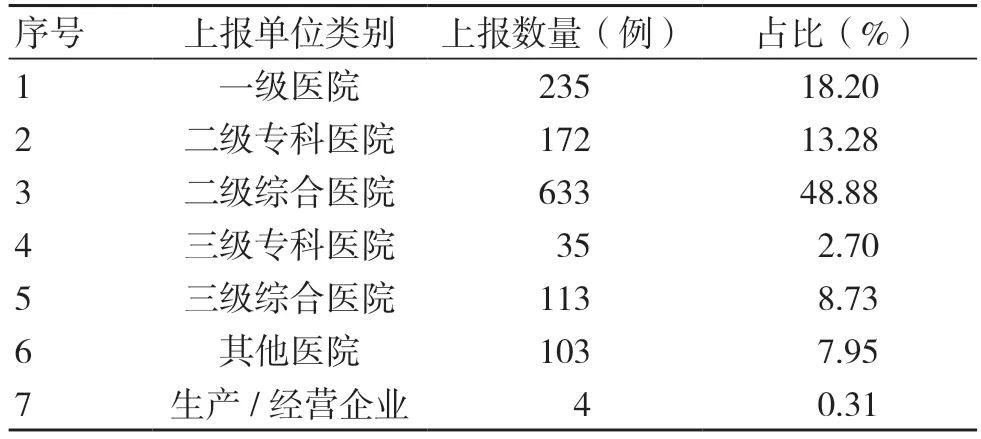
表2 1295 例静脉留置针不良事件上报单位分布情况
2.2 患者情况
1 295 例静脉留置针不良事件相关患者中,男577 例(占比44.56%),女545 例(42.08%),未标注性别173 例(13.36%);患者年龄主要集中在0~9、50~59、60~69、70~79 岁,合计占50.27%,见表3。
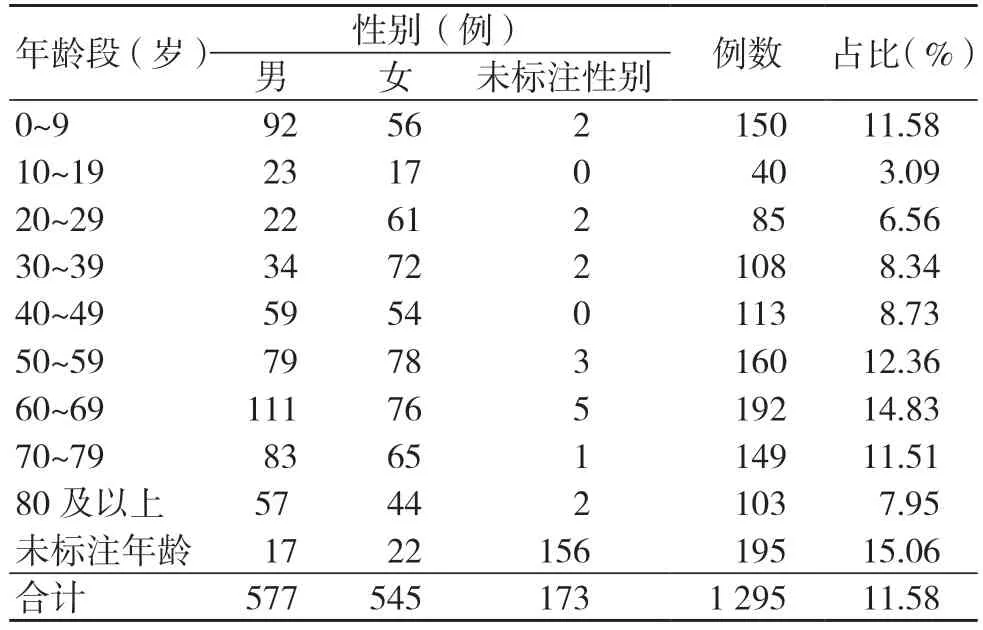
表3 1295 例静脉留置针不良事件相关患者情况
2.3 不良事件类型和表现
1 295 例静脉留置针不良事件根据具体表现可分为两类。(1)器械故障类:共计919 例,占70.97%,其中漏液(315 例,占24.32%)、堵塞(141 例,占10.89%)最常见。(2)患者伤害类:共计548 例,占42.32%,穿刺部位红肿(332 例,占25.64%)最常见,见表4。
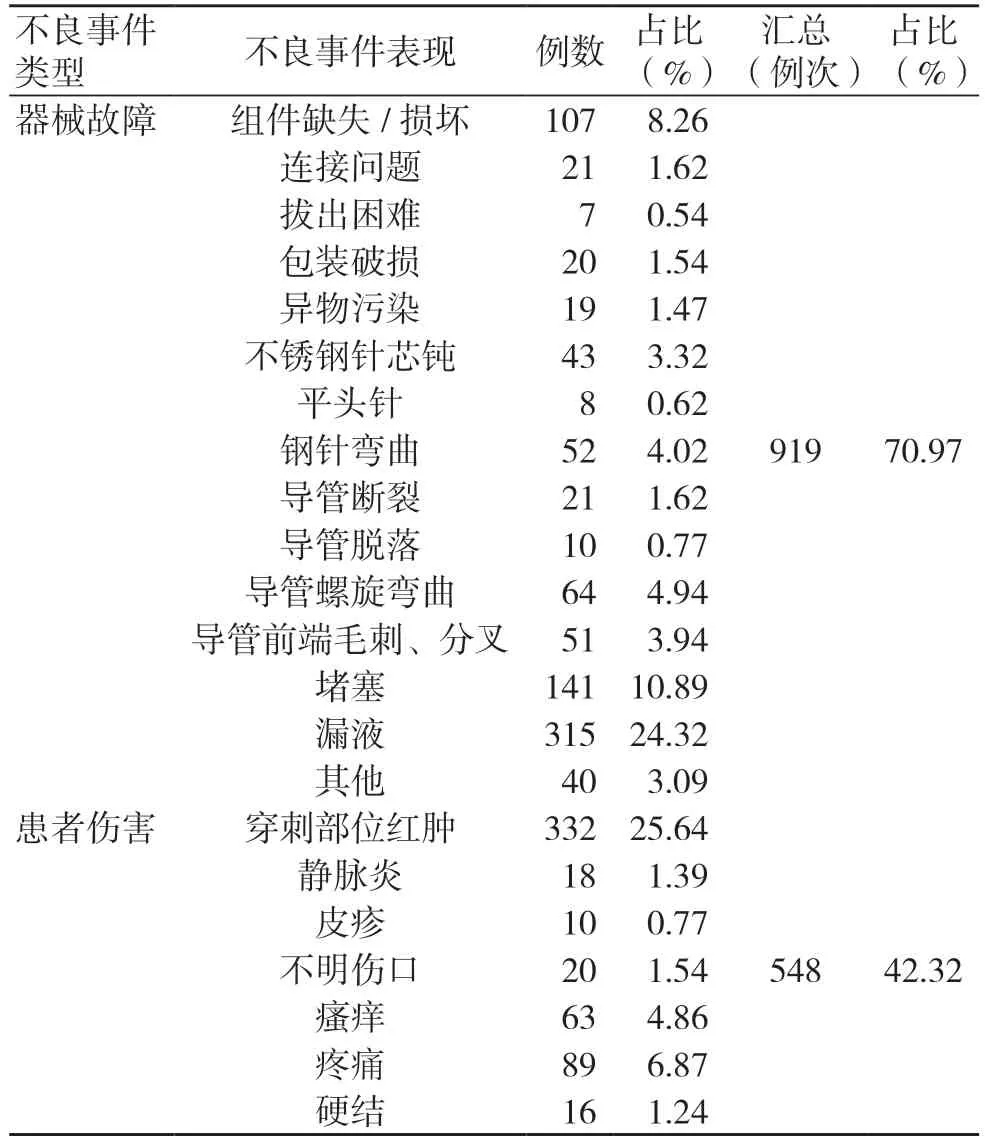
表4 1295 例静脉留置针不良事件类型和表现
3 讨论
3.1 上报情况和患者情况分析
1295 例静脉留置针不良事件的上报地域情况分析,河南、河北、安徽、山东、湖南、四川、陕西7 个省上报数量较多,占66.49%。这可能是由于其他6 个省距离河南省相对较近,河南省企业生产的静脉留置针市场占有率较高,使用基数较大导致不良事件上报数量相对较多。
从1295 例静脉留置针不良事件的上报单位分布情况来看,生产、经营企业上报率偏低(仅占0.31%),因此应加强对生产、经营企业相关政策的宣贯,鼓励其积极上报产品不良事件,有助于尽早发现产品风险信号。
1 295 例静脉留置针不良事件报告中,未标注性别173 例,未标注年龄195 例,可见不良事件报告规范化程度有待提升。规范化标注患者的性别、年龄,有利于系统分析不良事件发生概率是否与性别、年龄具有相关性。
此外,在审核静脉留置针不良事件报告中,发现器械故障、患者伤害相关术语不规范、描述不清晰等问题较多,需要耗费较多的人力、物力进行整理、归纳。因此,建议上报单位规范不良事件术语,这是进行大数据分析的重要基础[7-8],有利于风险信号的挖掘。
3.2 器械故障常见原因分析
3.2.1 漏液原因分析
导致漏液的原因主要为质量及操作问题[9-11]。质量问题包括员工装配时划伤软管、接头处连接不紧密、螺纹设计缺陷、三通或连接处胶水量较少等;操作问题包括二次配针导致导管破裂、肝素帽与三通处连接过紧,应力释放导致轻微开裂、正压接头与输液器连接过紧、超范围使用等。
3.2.2 堵塞原因分析
堵塞主要由质量、操作、患者、药物等因素导致[12-15]。质量问题包括装配过程中胶水使用过多、小密封圈堵塞输液通道、注塑过程存在缺陷等;操作问题包括冲管不彻底、封管操作不当、留置时间过长、穿刺原因造成软管扭曲等;患者因素包括血液黏稠度高、穿刺手臂活动幅度过大等;另外,输注脂溶性药物(如脂肪乳)或易结晶的药物(如甘露醇)也易造成导管堵塞。
3.3 患者伤害常见原因分析
穿刺部位红肿为最常见的患者伤害类型,主要由质量、操作、患者等因素导致[16-17]。质量问题主要包括生产过程的配针工序中,员工推送钢针时轻微划伤软管,导致软管有毛刺,使用时容易划伤患者血管;操作问题主要包括操作不熟练、技术不熟练、动作不稳等,导致留置针穿过血管壁而形成皮下血肿;患者因素主要包括血管条件、机体免疫力差,对导管材质过敏等。
4 不良事件监测工作建议
4.1 对医疗机构的建议
1 295 例静脉留置针不良事件报告中,医疗机构上报1 291 例,是不良事件上报的最重要组成部分。为做好医疗器械不良事件监测工作,提升风险信号挖掘,保障临床用械安全,建议医疗机构做好以下几点[18-20]:(1)加强培训宣贯,培养医务人员主动监测及上报的意识,提升医疗器械不良事件的判断能力;(2)设置奖惩机制,鼓励医疗器械不良事件上报,不良事件上报数量是医疗器械风险信号挖掘的基础;(3)提高不良事件上报质量,完整且高质量的不良事件报告对后期风险信号的提取具有重要作用;(4)严格按照医疗器械说明书进行临床操作,避免超范围使用。
4.2 对生产企业的建议
生产企业应注册为国家医疗器械不良事件监测信息系统用户,主动维护用户信息,主动报告医疗器械不良事件[21-22]。但目前生产企业上报的静脉留置针不良事件数量相对较少,因此建议生产企业正确认识医疗器械不良事件监测工作的重要意义,持续研究其上市医疗器械产品,评估风险情况,承担医疗器械不良事件监测的责任,根据分析评价结果采取有效控制措施。
4.3 对监管部门的建议
1 295 例静脉留置针不良事件报告中,存在器械故障、患者伤害术语不规范及描述不清晰等问题,给后续审核及评价工作造成较大困难。规范的不良事件术语是有效进行大数据分析、风险信号挖掘的重要基础。因此,建议国家、省级监测机构可组织专家对医疗器械重点品种的器械故障、患者伤害术语进行规范;另外,监管部门可依托医疗机构、生产企业开展医疗器械重点监测,主动收集不良事件报告等相关风险信息,撰写风险评价报告,持续提升用械安全。

