改良式宫体病灶处横H型切口治疗子宫腺肌病疗效观察*
李晓敏 赵惠杰 王继红 张玉洲 于 敏 刘一洁 河南省开封市妇产医院 475000
子宫腺肌病(Adenomyosis,AM)属临床妇科常见且多发病症,多见于30~50岁经产妇,临床表现多样,最常见症状如痛经、子宫增大、经量过多等,部分患者可表现出性交疼痛、习惯性流产、慢性盆腔疼痛等,若病情未获得及时有效控制,可表现为继发性贫血,危及患者生命安全[1]。既往,临床主要通过子宫切除手术治疗AM,虽能起到根治效果,但会致使患者围绝经期提前、生育功能丧失,存在一定局限性[2]。近年来,AM保守型手术治疗愈来愈受临床重视,其不仅具有显著疗效,且能有效避免子宫全切造成的不良影响,满足患者保留子宫意愿[3-4]。传统病灶挖除术、改良式宫体病灶处横H型切口切除术均是临床治疗AM常用保守手术方式,且治疗效果获得临床一度认可[5]。但应用上述哪种术式治疗AM患者效果更佳,临床尚未见报道。为此,本研究选取我院60例AM患者,旨在对比上述2种术式应用价值,现分析如下。
1 资料与方法
1.1 一般资料 经医学伦理会批准,选取我院2020年1月—2022年11月60例AM患者,按随机数字表法分成实验组(n=30)、对照组(n=30)。其中实验组年龄27~45岁,平均年龄(35.18±2.06)岁;病程3~14个月,平均病程(7.93±1.64)个月;孕次:0~2次,平均孕次(1.05±0.28)次;痛经程度:轻微10例,中度13例,重度7例。对照组年龄28~39岁,平均年龄(32.81±2.15)岁;病程3~15个月,平均病程(8.14±1.70)个月;孕次:0~2次,平均孕次(1.01±0.27)次;痛经程度:轻微9例,中度14例,重度7例。2组基线资料均衡可比(P>0.05)。纳入标准:符合AM相关诊断标准[6];经超声波、MRI、临床症状、体征、血清标记物检测等证实为AM;依从性良好;有生育需求;药物治疗无效或者不能接受药物治疗者;签署知情同意书。排除标准:严重恶性肿瘤;失访及不接受随访者;存在血液、免疫、内分泌系统病症;精神异常、认知功能不全;近3个月有激素药物治疗史;既往手术治疗史;过敏体质。
1.2 方法
1.2.1 对照组:接受病灶挖除术治疗,全麻,取腹腔镜或开腹手术,并依照具体情况,自病灶边缘作梭形切口,病灶尽可能完全切除,以1号线缝合浆肌层及子宫肌层,术毕清理创口,予以防止粘连药物,予以抗生素治疗。
1.2.2 实验组:接受改良式宫体病灶处横H型切口切除术治疗,腹腔镜或开腹手术术中探查,如果腺肌病病灶为局限型,于病灶基底部行横H型切开,直至全部把病灶切除,如穿透宫腔,切除部分内膜,修补内膜,分层缝合子宫,塑形子宫。如病灶为弥漫型,前后壁均有病灶,则前后壁均切开,宫底部横型切开,切除病灶,使浆肌层厚度保留0.5cm,再分层缝合。术毕清理创口,予以防止粘连药物,予以抗生素治疗。
1.3 观察指标 (1)2组术前及术后1个月、3个月以疼痛数字评价量表(NRS)[7]评分评估痛经情况,分值范围:0~10分,分值越低,痛经程度越轻微。(2)2组术前及术后1个月、3个月以盆底功能影响问卷简短版-7(PFIQ-7)[8]评分评估盆底功能,分值范围:0~100分,分值越高,盆底功能越差。(3)2组术前及术后1个月、3个月子宫体积、子宫内膜厚度,以B超检查,子宫体积=0.52×长径×前后径×横径。(4)2组术前及术后1个月、3个月月经量,以月经失血图(PBAC)[9]进行评估,依照卫生巾湿透面积予以评分,面积<1元硬币面积计1分,面积≥1元硬币面积计5分,统计患者月经期所有卫生巾总分(均使用同一品牌卫生巾)。(5)取2组术前及术后1个月、3个月静脉血3ml,3 000r/min离心5min,分离血清,以酶联免疫法测定子宫内膜抗体(EMAb)水平,以放射免疫法测定糖类抗原125(CA125)水平,当血清CA125>35U/ml即判定为阳性;以10例健康同龄女性血作为阴性对照,自492nm波长下测定血EMAb吸光度,当患者EMAb吸光度与阴性对照血EMAb吸光度比值>2.1即判定为阳性,统计2组血CA125、EMAb阳性率。(6)随访1年,统计2组妊娠率、复发率、子宫破裂率,其中复发判定标准如下:治疗后,痛经消失或一度缓解后再次出现,且程度同术前。
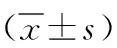
2 结果
2.1 NRS评分 2组术后1个月、3个月痛经NRS评分均较术前降低,且实验组较对照组低(P<0.05),见表1。

表1 2组NRS评分对比分)
2.2 PFIQ-7评分 2组术后1个月、3个月PFIQ-7评分均较术前升高,但实验组较对照组低(P<0.05),见表2。

表2 2组PFIQ-7评分对比分)
2.3 子宫体积、子宫内膜厚度 2组术后1个月、3个月子宫体积、子宫内膜厚度较术前缩小,且实验组较对照组小(P<0.05),见表3。

表3 2组子宫体积、子宫内膜厚度对比
2.4 PBAC评分 2组术后1个月、3个月PBAC评分均较术前降低,且实验组较对照组低(P<0.05),见表4。

表4 2组PBAC评分对比分)
2.5 血清CA125、EMAb阳性率 2组术后1个月、3个月血CA125、EMAb阳性率均较术前降低,且实验组较对照组低(P<0.05),见表5。
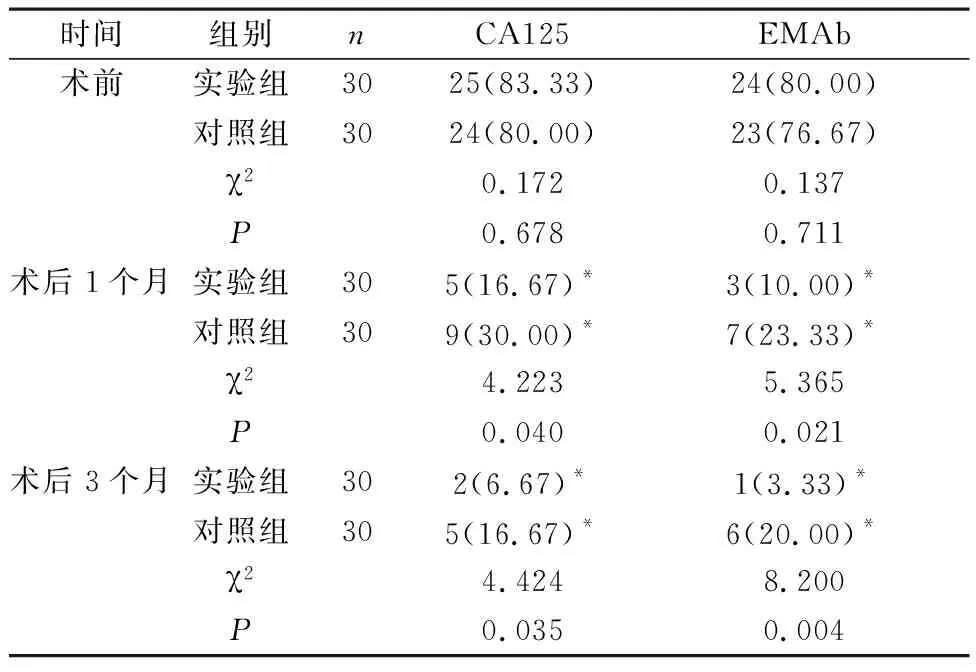
表5 2组血清CA125、EMAb阳性率对比[n(%)]
2.6 妊娠率、复发率、子宫破裂率 实验组复发率、子宫破裂率均较对照组低,妊娠率较对照组高(P<0.05),见表6。
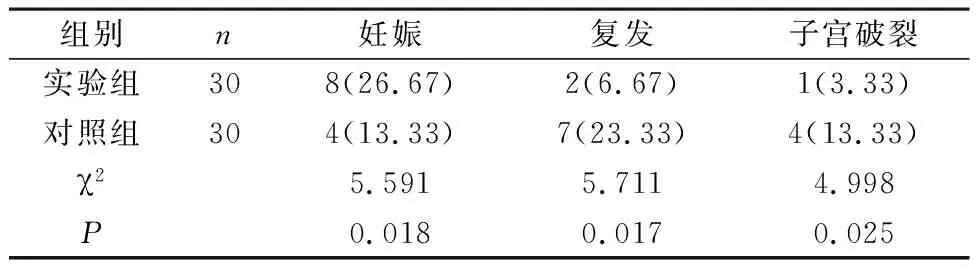
表6 2组妊娠率、复发率、子宫破裂率对比[n(%)]
3 讨论
AM特点是子宫内膜组织良性浸润子宫肌层,在激素影响下发生出血,呈现局限性或弥漫性病变[10-11]。临床针对AM治疗手段主要包括药物及手术治疗,其中前者优势在于能有效保留子宫,但难以有效消除病灶,停药后易复发,且存在较多副作用,而通过手术进行子宫全切,其优势在于能达到根治性治疗目的,但患者生育能力亦随之丧失,加之近年来AM发生率逐渐增加,且趋于年轻化,致使该治疗手段逐渐不被患者所接受[12]。故积极寻找一种既能有效保留患者子宫,又安全有效的治疗手段显得尤为重要。AM病灶挖除术是种保守型治疗手段,能在切除病灶的同时,保留子宫,但对于多发性或弥漫性AM而言,由于病灶与周围组织间界限不明显、边界不清等因素影响,导致其治疗难以将病灶完全切除,故易致使术后复发率偏高、妊娠率偏低等问题发生。与病灶挖除术治疗AM患者相比,应用改良式宫体病灶处横H型切口切除术治疗具有诸多优势:(1)其充分考虑机体子宫解剖结构,通过横H型切口切除和多重缝合,可有效切除大部分子宫体,最大程度切除病灶,进一步缓解患者痛经、月经过多等病情,降低术后复发风险,提升妊娠率;(2)成形子宫时,通过多重缝合,两侧浆肌层紧密重叠,能有效避免死腔形成,不仅能起到压迫止血效果,还可增加子宫壁厚度,减少手术对子宫的损伤,降低术后子宫破裂发生风险;(3)仅将部分子宫内膜切除,所保留的子宫内膜约占正常内膜的1/3,因此能在保证宫腔完整性的同时,减少月经量,降低对盆底功能的影响。本研究数据可见,术后1个月、3个月实验组痛经NRS、PFIQ-7、PBAC评分均较对照组低,子宫体积、子宫内膜厚度较对照组小,且复发率、子宫破裂率均较对照组低,妊娠率较对照组高(P<0.05),由此说明,应用改良式宫体病灶处横H型切口切除术治疗AM患者更有助于缓解痛经、减少月经量、提升妊娠率、减少复发及子宫破裂,且对盆底功能影响更小。
此外,本文数据还显示,术后1个月、3个月实验组血清CA125、EMAb阳性率均较对照组低(P<0.05),CA125是高分子糖蛋白,主要来源于体腔上皮表面抗原,多分布于腹膜、输卵管、宫颈上皮及子宫内膜上,与AM关系密切,肌间异位子宫内膜分泌CA125能力较强,可致使其释放入血,造成其呈高表达状态,测定其水平,可一定程度上反映患者病变程度;EMAb以子宫内膜为靶产生的抗体,其能引发多种免疫效应的自身抗体,可用于AM鉴别诊断[13]。由此证实,应用改良式宫体病灶处横H型切口切除术治疗AM患者具有肯定效果。笔者认为,这可能在于该术式与传统手术相比病灶切除更彻底有关。
综上所述,相较于AM病灶挖除术,应用改良式宫体病灶处横H型切口切除术治疗AM患者更有助于缓解痛经,减少月经量,降低CA125、EMAb阳性率,提升妊娠率,减少复发、子宫破裂,同时对盆底功能影响更小。

