靶向代谢组学技术在肝硬化病情评估和预后判断中的应用研究*
吴江雷 刘先华 黄 胜
江西省湖口县人民医院 1 消化内科 2 检验科 332599
肝硬化作为消化系统的慢性疾病,具有较高的发病率,但其起病隐匿,临床早期可无特异性症状以及体征[1]。肝硬化可由各种病因导致免疫系统的慢性损害,临床上多表现为腹痛、腹泻、乏力、食欲减退、消化不良等非特异性表现。肠道菌群是一个复杂的生态系统,当肠道菌群失衡时,会损害胃肠黏膜屏障的完整性,导致病菌及其产物进入肝脏,促进炎症因子的释放,加剧肝纤维化的发展[2]。从消化内科的发展趋势来看,肠道靶向微生物标志物可作为肝炎疾病进展的有力诊断工具,靶向代谢组学具有特异性强、定量测序准确、检测灵敏度高等优点,通过新一代的MS/MS质谱串联技术,可以更快地实现实时动态监测,同时增强代谢产物的检测数量[3-4]。但目前的研究大多存在于动物研究中[5],需通过大量的人类样本研究,为临床疾病预防提供理论支持。基于此,本研究考虑将靶向代谢组学技术应用于乙型肝炎肝硬化患者的肠道菌群检测中,探讨其对病情评估以及预后判断的临床效果,推动消化内科临床研究水平的发展进步。
1 资料与方法
1.1 一般资料 经我院伦理委员会审批同意后,选取2020年7月—2022年7月于我院确诊的81例乙型肝炎肝硬化患者作为研究对象,根据肝硬化的病程发展将其分为代偿期组45例与失代偿期组36例,另选取同期于我院进行体检的健康志愿者40例作为对照组。对照组:年龄23~60岁,平均年龄(45.89±7.02)岁,男29例,女11例。代偿期组:年龄27~61岁,平均年龄(45.38±7.33)岁,男34例,女11例。失代偿期组:年龄28~62岁,平均年龄(46.12±7.52)岁,男27例,女9例。三组一般资料比较差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)符合乙型肝炎肝硬化诊断标准[6]。(2)年龄18~65岁。(3)近1个月未使用抗生素药物。(4)近1个月未服用肠道微生态调节剂等胃肠道药物。(5)对照组志愿者的身体各项检查正常。(6)患者及家属均知晓本研究并签署知情同意书。排除标准:(1)存在除乙型肝炎病毒外的其他病毒、细菌、真菌感染。(2)合并胃肠道疾病者。(3)哺乳期、孕期妇女。(4)存在特殊饮食习惯者,如素食者。(5)合并代谢性疾病患者。(6)合并肝肾功能损害患者。
1.2 方法 代偿期组和失代偿期患者均接受基础的抗病毒治疗。留取所有受试者治疗结束时粪便标本3~5g,置于-80℃冰箱保存待检;样本采集过程应避免污染。统一对三组研究人员的粪便样本进行肠道菌群检测,根据细菌引物进行扩增,采用Illumina Miseq高通量测序方法进行肠道菌群测序,并提取高质量DNA序列,采用物种分类学和分类单元聚类分析(Operational taxonomic unit,OTU)分析其群落结构和Alpha指数。测量步骤:(1)提取DNA,完成后使用1%琼脂糖凝胶电泳。(2)使用聚合酶链反应(Polymerase chain reaction,PCR)扩增仪(TransGen AP221-02:TransStart Fastpfu DNA Polymerase)进行扩增,扩增完成后在2%琼脂糖中进行电泳检测。(3)PCR产物荧光定量检测。(4)Illumina PE250文库构建。对荧光定量检测结果进行overlap关系拼接、质控和过滤,完成后进行OTU聚类分析和物种分类学分析。在上述分析的基础上,再根据菌群丰富度将乙型肝炎肝硬化患者分为高丰度组和低丰度组,对比两组菌群丰富度与预后发展的相关性。
1.3 观察指标 (1)菌群分类学组成:对比三组人员肠道内所有菌群的分类学组成[7],门分类包括厚壁菌门、拟杆菌门、变形菌门、放线菌门、酸杆菌门,属分类包括双歧杆菌属、肠杆菌属、布劳特氏菌属、瘤胃菌属、链球菌属。(2)菌群多样化指数:根据Alpha多样性反应对比三组人员的肠道菌群情况[8],Chao1指数和ACE指数反映肠道菌群丰富度,Shannon指数和simpson指数反映肠道菌群多样性,肠道菌群失衡度参数(Cirrhosis dysbiosis index of genus,CDIG):CDIG指数=原籍有益菌群相对丰度(梭菌属+梭菌属)/非原籍有害菌属相对丰度(嗜血杆菌属+链球菌属+罗斯氏菌属+韦荣氏球菌属)。(3)病情进展与肠道菌群的相关性:将三组人员的菌群属水平与疾病进展进行相关性分析。(4)菌群丰度与预后发展的相关性:将肝硬化患者进行亚分组后,对比高丰度组和低丰度两组患者的菌群丰度与预后发展的相关性,预后情况根据患者的疾病进展进行评定,代偿期乙型肝炎肝硬化分为Ⅰ期和Ⅱ期。失代偿期乙型肝炎肝硬化根据生化指标以及病情严重程度分为A、B、C三级。两组患者6个月后通过门诊回访,再次评定患者疾病发展情况,患者进展1级以上或发展为肝癌甚至死亡记为预后不良。预后不良率=(总例数-稳定例数)/总例数×100%。
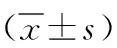
2 结果
2.1 三组菌群分类学组成比较 门分类中, 三组人员肠道内的主要菌群为厚壁菌门、放线菌门、变形菌门以及拟杆菌门,其中厚壁菌门占比更高;在属水平上,对照组与两组肝硬化患者的肠道微生物组成有所不同,两组肝硬化患者较对照组双歧杆菌占比有所下降,链球菌属占比上升。详见表1。
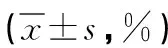
表1 三组菌群分类学组成比较
2.2 三组菌群多样化指数比较 代偿期组与失代偿期组患者的丰富度指数Chao1、ACE以及CDIG指数均较对照组降低,且失代偿期组降低更明显(P<0.05),但三组患者的多样性指数Shannon、simpson差异不明显(P>0.05)。详见表2。

表2 三组菌群多样化指数比较
2.3 病情进展与肠道菌群的相关性分析 病情进展与Chao1、ACE以及CDIG指数呈负相关(P<0.05),与Shannon、simpson指数的无显著相关性(P>0.05)。详见表3。
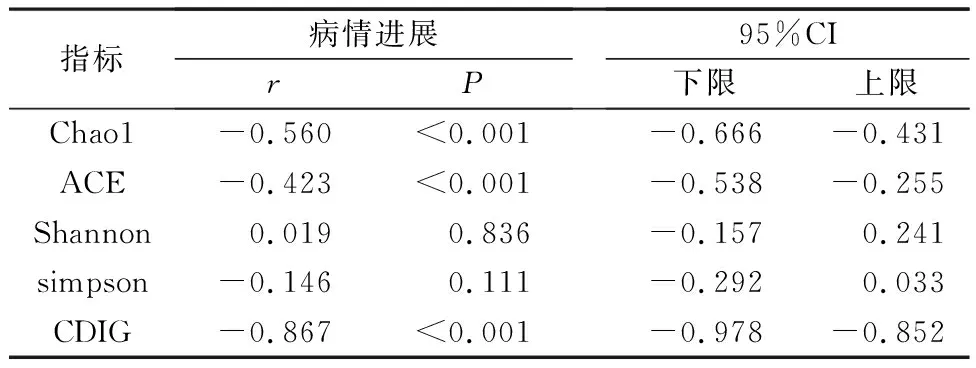
表3 病情进展与肠道菌群的相关性分析
2.4 菌群丰度与预后发展的相关性分析 Kapian-Meier生存曲线分析显示6个月后高丰度组预后良好效果高于低丰度组[Log Rank(Mantel-Cox)=7.014,P=0.008],详见图1。
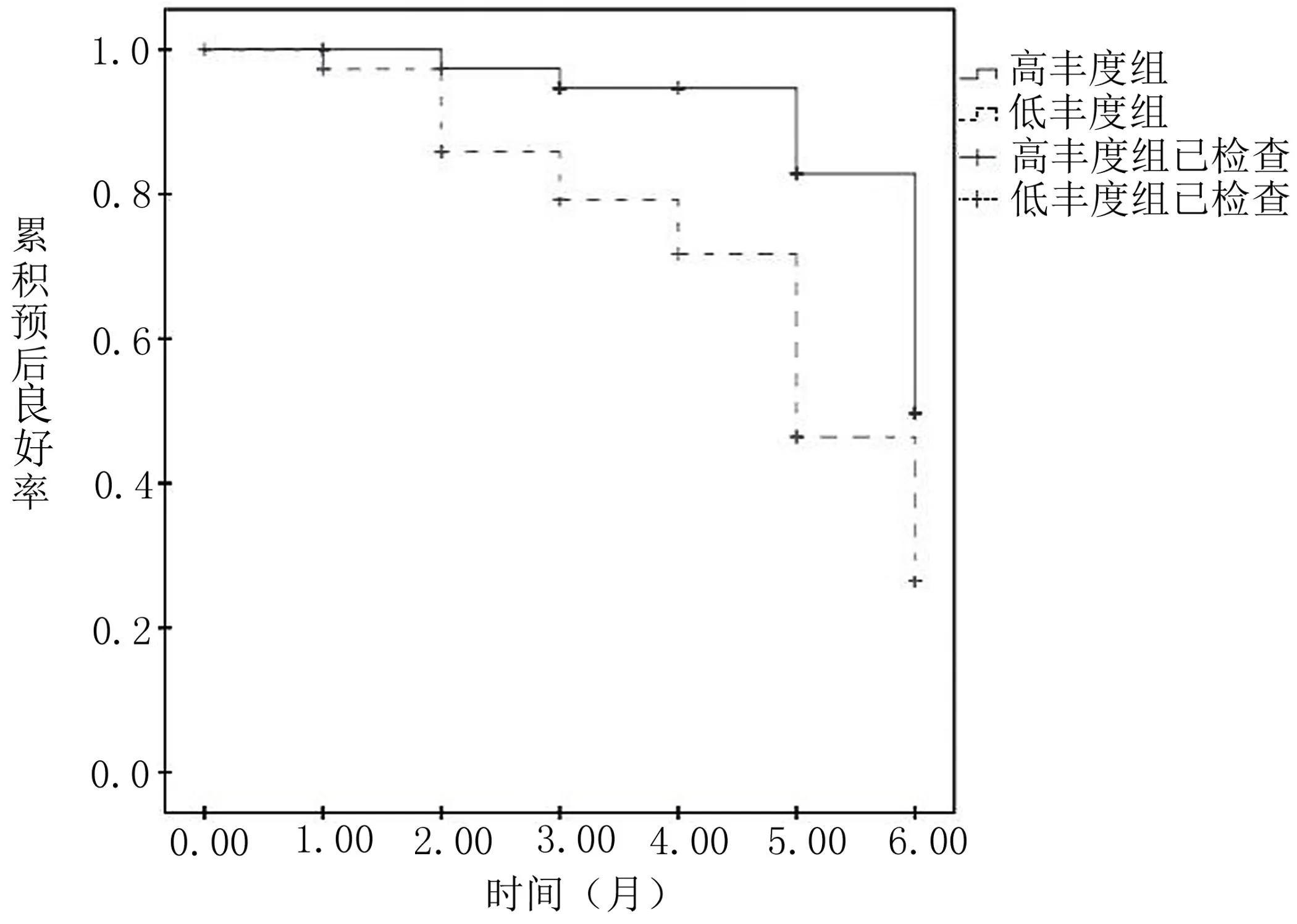
图1 菌群丰度与预后发展的相关性分析
3 讨论
肠道菌群在生理状况下可与机体维持平衡状态,保证人体正常、稳定的代谢、免疫、防御功能,肠道菌群状况与肠道免疫功能的和平共生关系保障着肠道吸收营养和限制细菌、病毒等通过门静脉系统进入肝脏的有效作用[9]。生物标志物可以反映机体的生理变化,提示某种特定物质功能或结构上的改变,而其提供的信息可用于早期疾病诊断、疗效评价、预后评估中具有重要意义。在消化内科的发展过程中,靶向肠道微生物标志物可称为病毒性肝炎发展诊断的有力工具。而靶向代谢组学技术作为代谢组学研究的重要组成部分,使得生物标志物的检测和代谢产物的量性分析成为可能,通过研究生物结构、性质相似的代谢产物,为相关疾病的研究提供高效的解决方法。
本研究发现,肠道内的主要菌群为厚壁菌门、放线菌门、变形菌门及拟杆菌门,其中厚壁菌门占比更高,在属水平上,对照组与两组肝硬化患者的肠道微生物组成有所不同,双歧杆菌在三组中占比最高,但两组肝硬化患者较对照组占比有所下降,链球菌属占比上升,表示通过靶向代谢组学技术可较直观地检测出乙型肝炎肝硬化患者的肠道菌群的种类组成。随着现代分析技术的发展[10],代谢组学得以快速发展,靶向代谢组学作为其重要组成部分,靶向代谢组学的质谱检测技术已被广泛应用于物质检测中。本研究中采用的串联质谱检测可以更容易观察肠道菌群的差异性,利于对相关毒性菌群的寻找,同时只需对样本进行简单的处理,即可直接进行样本检测。
本研究利用靶向代谢组学技术对肝硬化患者进行肠道菌群检测发现,两组肝硬化患者的丰富度指数Chao1、ACE以及CDIG指数均低于对照组,其中失代偿期组降低更加明显,且疾病进展与Chao1、ACE以、CDIG指数呈正相关,表明肠道菌群可用于肝硬化患者的病情评估。在调节肠壁内外物质运输过程中,肠道屏障的完整性发挥着重要作用,当肠道菌群失衡时,肠道黏膜屏障受损,病菌及其产物会进入门静脉系统,最终到达肝脏,激活肝脏免疫系统,释放促炎细胞因子,加剧肝纤维化的发展[11]。乙型肝炎肝硬化患者的肠道因受到病毒的侵害,导致肠道黏膜屏障不能有效阻止有毒菌群侵害肝脏,导致肝纤维化的进一步发展,加重疾病发展,因此病情越严重的患者,肠道菌群丰度就越低,肠道菌群失衡越严重。
本研究根据肠道菌群丰度将肝硬化患者进行亚分组后还发现,低丰度组患者的预后不良率高于高丰度组,表示肠道菌群的丰度情况可用于肝硬化患者的预后判断中。肠道菌群在正常生理状况菌群丰度较高,肝硬化患者若不能及时纠正肠道菌群的丰富性,则会加重肠道菌群的失衡,导致疾病进展得越快。相关研究在肝衰竭患者的肠道微生物研究中也发现,菌群丰度越低,疾病进展越迅速[12]。在今后的研究中应以肠道菌群失衡治疗作为肝硬化患者的研究方向,提供更安全、有效的防治方法,改善患者预后情况。
综上所述,靶向代谢组学技术揭示了肠道菌群在肝硬化病情评估和预后判断的有效作用,为临床选择生物标志物和预防治疗提供了可靠的数据支持。本研究的不足之处在于样本量较小,且为单中心研究,研究普遍性受限,后期需进行多中心的大样本研究,进一步验证本研究结论。

