半夏有效成分环阿屯醇对小鼠心肌缺血再灌注损伤的保护作用及机制研究
梁雅婷,姜雅宁,孙永宁
(上海中医药大学附属市中医医院,上海 200040)
冠心病在全球的发病风险居高不下,目前主要的治疗手段有药物治疗、经皮冠状动脉介入治疗、冠状动脉旁路移植术等。但是通过血运重建恢复心肌供血的同时,还会引起血管内皮细胞功能异常、氧自由基大量生成、炎性因子被激活等情况,使梗死面积扩大,心肌坏死程度进一步加重。这种由血液再灌注导致的心肌二次受损称为心肌缺血再灌注损伤(Myocardial ischemia reperfusion injury,MIRI)[1],临床上患者常出现心肌顿抑、心肌细胞凋亡坏死、内皮功能障碍、微血管功能障碍等不良状况,严重影响患者预后[2]。MIRI较高的发病率和致死率成为临床治疗的难题,虽然相关手术技术及抗血栓药物不断发展,但目前仍未发现能有效避免MIRI的方法,寻找减轻MIRI的方法对提高患者预后具有重大意义。
在寻找减少MIRI发生率和减轻MIRI程度药物的过程中,中医药正逐渐受到广大研究者的重视,成为学术热点。中医认为MIRI多为本虚标实,虚乃致病之本,瘀、痰、热、毒是致病之标,常以活血、祛瘀、理气、清热、化痰为主。半夏作为张仲景经典胸痹方的重要组成药物,其潜在的药理作用机制有待发掘。半夏的有效成分之一环阿屯醇为一种植物甾醇类化合物,同时也是多种甾醇类化合物生物合成的关键前体物质之一,具有抗炎[3-7]、抗肿瘤[8-12]、抗氧化[7,13-16]、抗菌[6]、抗阿尔茨海默症[17]等多种活性。在其他疾病领域,环阿屯醇因其优越的抗氧化性开展了较多的研究,并拥有不少相关的研究成果,但关于环阿屯醇对MIRI的作用和影响的研究较少。本文探索环阿屯醇对MIRI的影响及其作用机制,以期为临床减轻MIRI提供新的理论参考。
1 材料
1.1 实验动物
1~3日龄的SD雄性大鼠乳鼠,购自上海斯莱克实验动物有限公司,实验动物许可证号为SCXK(沪)2017-0005。6周龄的C57BL/6J雄性小鼠,购自上海吉辉实验动物饲养有限公司,实验动物许可证号为SCXK(沪)2017-0012。动物实验在上海中医药大学附属市中医医院动物房完成,小鼠自由饮水摄食,饲养于通风良好、温度为25 ℃和相对湿度为55%的实验室动物房内。动物实验严格遵循3R原则,通过动物伦理委员会审查,伦理审查编号:2022006。
1.2 试剂与药物
环阿屯醇(B25804,纯度≥98%)购自上海源叶生物科技有限公司。SB203580(HY-10256,纯度=99.96%)购自MCE。CCK-8试剂盒(K1018)购自APExBIO。p38 MAPK(ab170099)、α-tubulin(ab52866)抗体均购自Abcam;p-p38 MAPK(AF4001)、IL-6(DF6087)、TNF-α(AF7014)抗体购自Affinity Biosciences;Goat anti-Rabbit IgG(H+L)Highly Cross-Adsorbed Secondary Antibody(A-31573)购自Invitrogen Thermo Fisher Scientific。小鼠肌酸激酶同工酶(CK-MB)(MC014)、乳酸脱氢酶(LDH)(ML001)、白细胞介素-6(IL-6)(MI001)、肿瘤坏死因子-α(TNF-α)(MT035)、心肌肌钙蛋白I(cTnI)(MC040)ELISA试剂盒均购自上海歌凡生物科技有限公司。
1.3 仪器
超速离心机(75006590)购自美国Thermo Fisher公司;酶标仪(Synergy NEO2 HTS)购自美国Biotech公司;小动物超声仪(Vevo 2100)购自加拿大Visual Sonics公司;小动物麻醉机(R500)购自深圳瑞沃德公司;小鼠心肌缺血再灌注模型手术包(e159264)购自深圳瑞沃德公司;化学发光荧光影像分析仪(1708265)购自美国Bio-Rad公司。
2 方法
2.1 分组及造模
选用1~3日龄的SD大鼠乳鼠提取原代心肌细胞,将原代心肌细胞随机分为对照(Control)组,缺氧/复氧(Hypoxia/Reoxygenation,H/R)组,环阿屯醇低剂量组(3 μmol·L-1),环阿屯醇高剂量组(10 μmol·L-1)和SB203580组(15 μmol·L-1)。将提取出来的原代心肌细胞在搏动状态良好稳定后根据不同分组进行预给药24 h处理,对照组、H/R组不做给药处理。随后将H/R组和各给药组放置于缺氧培养箱,在95%N2、5%CO2气体浓度下行缺氧培养3 h后,放置于正常培养箱中进行复氧培养3 h,以此构建原代心肌细胞缺氧复氧模型。
将购买的50只6周龄C57BL/6J小鼠在动物房常规适应性饲养1周后,小鼠随机分成对照(Control)组,模型(Ischemia/Reperfusion,I/R)组,环阿屯醇低、中及高剂量组,每组10只。在手术前7 d连续给药,环阿屯醇低、中、高剂量组分别腹腔注射0.2、0.5、1.0 mg·kg-1的环阿屯醇[18],Control组和I/R组分别给予等量生理盐水。连续给药结束后,将C57BL/6J小鼠置于小动物呼吸机上,使用异氟烷麻醉。空气泵流量设为300~500 mL·min-1,诱导浓度调节为3%~4%。待小鼠初步麻醉后,将维持浓度设置为1%~1.5%。采取仰卧位固定,安装好心电监护仪。剃除动物左胸侧被毛,酒精棉球擦拭剃毛处消毒。在胸骨左侧第3、4肋间沿胸大肌边缘做一长1 cm左右切口,钝性扩张皮肤,暴露肌肉层,穿破胸间肌并扩张肋骨,快速挤出心脏。找到冠状动脉左前降支(Left anterior descending artery,LAD),选用6-0丝线,结扎LAD。观察心室壁暗红色改变,将心脏推回原位,并挤出胸腔内气体,关上胸腔。30 min后,缓慢拉出结扎线,恢复心肌血流供应,再灌注24 h后,检测各小鼠心肌功能,眼球取血,脱颈处死小鼠,进行其余组织取材,检测各项指标。
2.2 原代心肌细胞活力水平、凋亡水平及IL-6水平检测
细胞活力水平检测:将接种于96孔板中的原代心肌细胞进行不同分组的干预后造模。弃上清,将CCK-8溶液和无血清的培养基用1∶10的比例配置混匀后,加入96孔板中。37 ℃孵育1.5 h后,用酶标仪检测在450 nm波长处的OD值,并对各组数据进行均一化处理。
流式技术检测凋亡水平:将接种于6孔板中的原代心肌细胞进行不同分组的干预后造模,按照Annexin-V-FITC细胞凋亡检测试剂盒操作说明检测各组心肌细胞的凋亡水平。
IL-6水平检测:将接种于6孔板中的原代心肌细胞进行不同分组的干预后造模,取各组原代心肌细胞上清,根据ELISA试剂盒操作,检测各组IL-6水平的变化。
2.3 小鼠心肌功能测定
将C57BL/6J小鼠置于小动物呼吸机上,使用异氟烷麻醉。空气泵流量设为300~500 mL·min-1,诱导浓度调节为3%~4%。待小鼠初步麻醉后,将维持浓度设置为1%~1.5%。采取仰卧位将小鼠固定于小动物超声仪检测板上,使用超声探头对小鼠心肌功能进行检测。使用Vevo LAB 2.1.0软件,分析统计各组小鼠左心室射血分数(Left ventricular ejection fraction,LVEF)、小鼠心输出量(Cardiac output,CO)、左心室缩短分数(Left ventricular fractional shortening,LVFS),评价其心肌功能。
2.4 小鼠心肌梗死面积的测定
脱颈处死小鼠,剪下小鼠心脏,于0~4 ℃ PBS溶液中冲洗转移,除去多余的组织,在-20 ℃冰箱冷冻30 min后,取出变硬的心脏进行切片。将切片置于1%TTC染液中37 ℃避光水浴30 min,每5 min轻微晃动容器,使其充分染色。心脏切片用PBS溶液洗涤3~5 min,用10%中性甲醛固定心脏切片6 h,进行拍照。采用Image J软件进行统计,计算方法为:梗死面积比=梗死区域面积/心脏面积(IA/HA)。心肌梗死区不能被TTC染液染色,呈白色,其余部分可被TTC溶液染色,呈红色。
2.5 小鼠心肌组织HE染色
小鼠心脏取材后,将心脏组织放置于4%的多聚甲醛中固定24 h,用石蜡包埋。将固态石蜡包埋组织进行切片,脱蜡后将组织切片置于乙醇中进行水化,PBS漂洗后用苏木精染色5 min。将组织置于1%的盐酸乙醇溶液中去除多余的苏木精染料,使用1%氨水返蓝,伊红染色3 min后,对组织切片进行梯度脱水处理,直至成透明状。后用中性树脂进行封片,干燥72 h后在显微镜下对心肌组织进行观察。
2.6 小鼠血清CK-MB、LDH、IL-6、TNF-α和cTnI水平检测
小鼠再灌注24 h后眼球取血,室温放置30 min后,在离心机上3 500 r·min-1离心15 min,取血清,按照试剂盒说明书检测血清中CK-MB、LDH、IL-6、TNF-α和cTnI水平,在酶标仪上检测其OD值,统计分析结果。
2.7 Western blot检测
取原代心肌细胞,用PBS清洗2~3次后,加入裂解液并置于冰上慢摇裂解30 min;各组小鼠心肌组织用PBS清洗2~3次后,加入磁珠和裂解液在低温下研磨并裂解30 min。用移液枪将裂解液转移至离心管中,4 ℃、12 000×g离心10 min,取上清。BCA法进行蛋白定量,测定蛋白浓度。添加上样缓冲液,95~100 ℃加热5 min使蛋白变性。每组取20 μg蛋白进行电泳,将样本置于10%SDS-PAGE中,一阶段使用电压80 V大约25~35 min使样品跑至分离胶处,二阶段改变电压到100 V,当样品上样Marker和溴酚蓝跑到底端绿线处时停止电泳,进行转膜。以400 mA恒流转膜15~30 min,转膜完毕后取出转移后的PVDF膜,置于快速封闭液中,在摇床上慢摇封闭30 min。将膜置于一抗中(p38 MAPK,1∶1 000稀释;p-p38 MAPK,1∶1 000稀释;α-tubulin,1∶10 000稀释;TNF-α,1∶1 000稀释;IL-6,1∶1 000稀释),置于4 ℃冰箱内慢摇孵育过夜。加入TBST缓冲液,置于摇床上洗膜10 min,洗膜3次。加入二抗,稀释倍数为1∶1 000,室温下慢摇避光孵育1 h。将膜置于化学发光检测仪中检测蛋白表达,并采用Image J软件对图像进行分析。
2.8 统计学分析
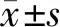
3 结果
3.1 环阿屯醇预处理对原代心肌细胞活力的影响
使用不同浓度环阿屯醇对心肌细胞进行预干预,后制备H/R模型,寻找最佳环阿屯醇浓度。使用CCK-8检测各浓度环阿屯醇对H/R心肌细胞的影响,结果显示,3 μmol·L-1和10 μmol·L-1的环阿屯醇干预对H/R心肌细胞的保护效果最佳(P<0.05,P<0.01),见图1。
注:与0 μmol·L-1组比较,
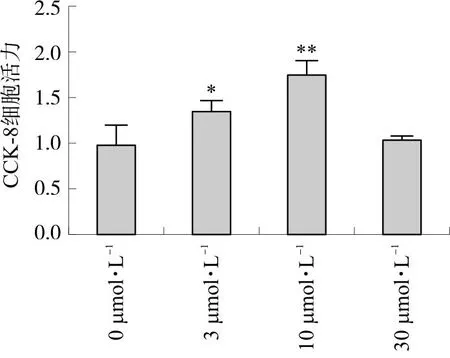
对各组心肌细胞进行CCK-8检测,实验结果表明,与Control组相比,H/R组心肌细胞活力明显下降(P<0.05)。而与H/R组相比,3 μmol·L-1环阿屯醇组无显著差异,10 μmol·L-1环阿屯醇组和SB203580组心肌细胞活力均有明显提高(P<0.05)(图2)。结果显示,环阿屯醇预处理能够有效提高原代心肌细胞在缺氧复氧损伤下的细胞活力,降低损伤带来的影响。
注:与Control组相比,*P<0.05;与H/R组相比,
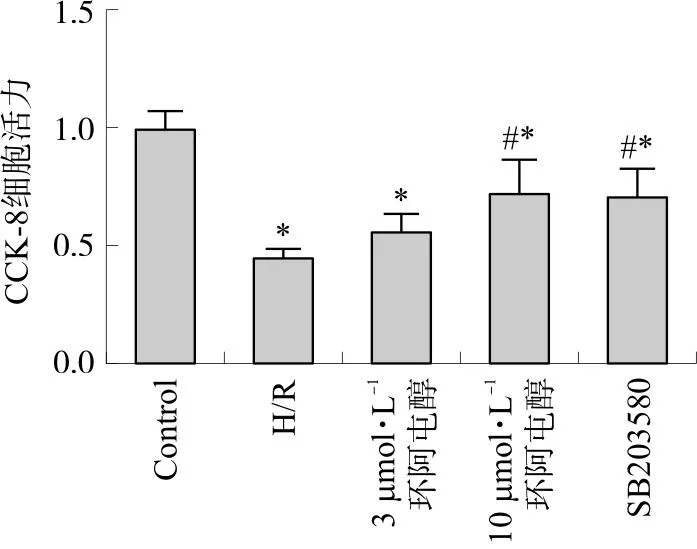
3.2 环阿屯醇预处理对原代心肌细胞凋亡的影响
由上结果可知,10 μmol·L-1的环阿屯醇作用效果更佳,故用该浓度进行细胞凋亡实验。实验结果显示,与Control组相比,H/R组细胞凋亡率增加(P<0.05),与H/R组相比,环阿屯醇预处理后心肌细胞凋亡率有所下降(P<0.05)(图3)。
注:与Control组相比,*P<0.05;与H/R组相比,
3.3 环阿屯醇预处理对心肌细胞IL-6水平、p-p38 MAPK/p38 MAPK比值的影响
与Control组相比,H/R组的IL-6水平明显升高(P<0.01),与H/R组相比,环阿屯醇和SB203580都可以不同程度地降低IL-6水平,差异具有统计学意义(P<0.01)。实验结果证明,环阿屯醇保护SD大鼠乳鼠原代心肌细胞的作用可能通过减少炎性反应而实现(图4)。
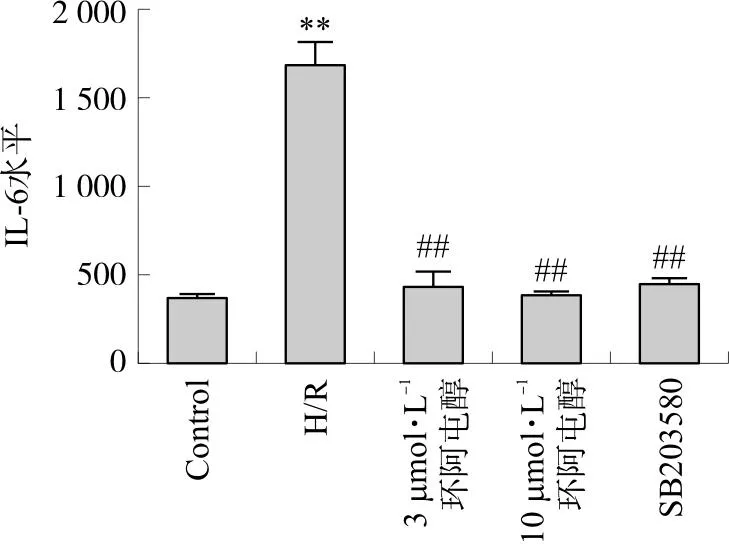
注:与Control组相比,**P<0.01;与H/R组相比,
与H/R组相比,环阿屯醇和SB203580预处理可以降低p-p38 MAPK/p38 MAPK的比值(P<0.05,P<0.01)(图5)。结果显示,环阿屯醇预处理能有效抑制缺氧复氧损伤下原代心肌细胞p38 MAPK的磷酸化。
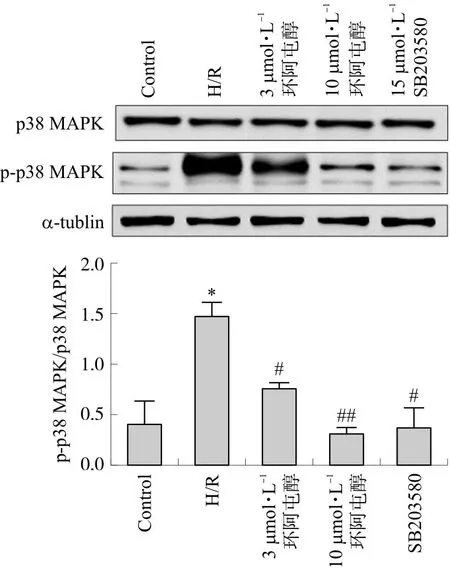
注:与Control组相比,*P<0.05,与H/R组相比,
3.4 环阿屯醇预处理对MIRI小鼠心功能的影响
与Control组相比,I/R组的LVFS、CO和LVEF均有明显下降(P<0.05),说明I/R组小鼠心功能下降;与I/R组相比,环阿屯醇预处理组的LVFS、CO和LVEF有不同程度的提高,且不同浓度环阿屯醇干预下其作用效果各有不同,其中以高剂量组的提高效果最佳(P<0.05,P<0.01)(表1)。结果提示,环阿屯醇预处理能够有效提高MIRI小鼠心脏的LVFS、LVEF及CO值,保护心功能。
表1 环阿屯醇预处理对小鼠LVFS、LVEF及CO的影响
3.5 环阿屯醇预处理对MIRI小鼠心肌梗死面积的影响
各组随机选取4只小鼠做心肌梗死面积检测。TTC染色结果表明,与Control组相比,I/R组小鼠IA/HA显著升高(P<0.05)。与I/R组相比,中、高剂量环阿屯醇小鼠的IA/HV有明显降低(P<0.05)。
研究结果证明,MIRI会增加心肌梗死面积,而环阿屯醇预处理能有效降低心肌梗死面积,且作用效果具有一定剂量依赖性。见图6和表2。
表2 各组IA/HA统计结果
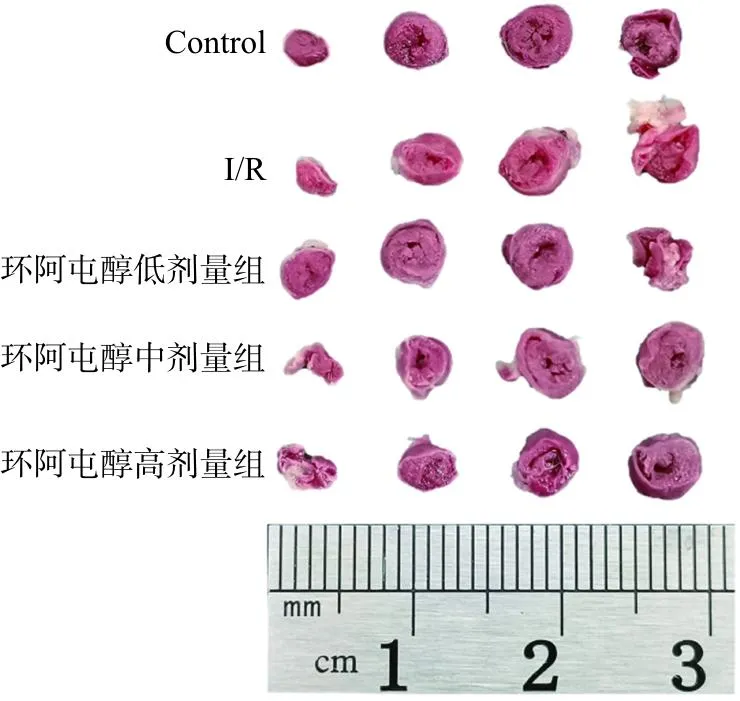
图6 各组小鼠TTC染色示意图
3.6 各组小鼠心肌组织的HE染色结果
HE染色结果显示,Control组小鼠的心肌组织结构完整,排列整齐,界限清晰;I/R组小鼠的心肌组织结构较为凌乱,心肌纤维发生断裂,且有炎性细胞浸润;环阿屯醇各剂量组则随着用药浓度的增高,心肌纤维断裂减少,且组织结构相对完整,排列整齐(图7)。
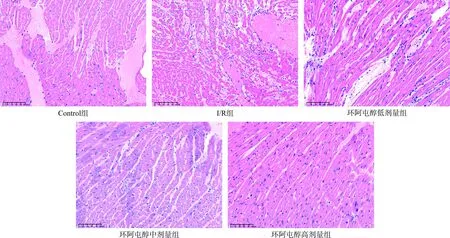
图7 各组小鼠HE染色示意图(×800)
3.7 环阿屯醇预处理对小鼠血清CK-MB、LDH、IL-6、TNF-α和cTnI水平的影响
各组随机选取5只小鼠血清做检测,与Control组相比,I/R组小鼠血清中CK-MB、LDH、IL-6、TNF-α和cTnI的水平均升高(P<0.05);而与I/R相比,环阿屯醇预处理组血清中CK-MB、LDH、IL-6、TNF-α和cTnI的水平均有不同程度的降低(P<0.05)(表3~4)。结果表明,环阿屯醇预处理能在一定程度上抑制小鼠血清中相关炎性因子的表达,减少MIRI小鼠的炎性反应,对小鼠心肌组织起到一定的保护作用。
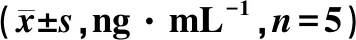
表3 环阿屯醇预处理对小鼠血清CK-MB、LDH水平的影响
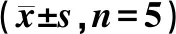
表4 环阿屯醇预处理对小鼠血清IL-6、TNF-α和cTnI水平的影响
3.8 环阿屯醇预处理对小鼠心肌组织p-p38 MAPK/p38 MAPK、IL-6、TNF-α蛋白表达量的影响
与I/R组相比,高剂量环阿屯醇预处理可以降低p-p38 MAPK/p38 MAPK的比值(P<0.05),同时降低IL-6、TNF-α的表达(P<0.05)(图8)。结果显示,环阿屯醇预处理能抑制MIRI小鼠心肌细胞p38 MAPK的磷酸化。
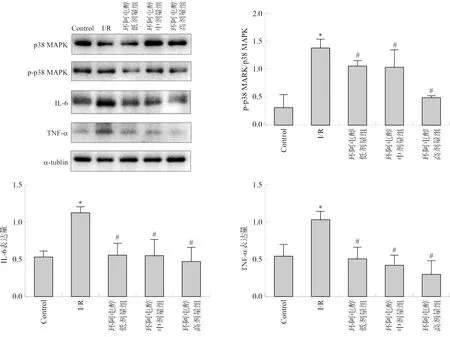
注:与Control组相比,*P<0.05,与I/R组相比,
4 讨论
血运重建为目前最常见的治疗冠心病的方式,但是随之而来的MIRI会严重降低临床治疗效果,甚至产生更加严重的后果。MIRI常导致心脏功能紊乱、心肌损伤标志物增高、炎性反应、心肌细胞凋亡坏死等现象,最终造成不可逆性的心肌损伤。本研究发现环阿屯醇能够有效减少小鼠MIRI。
心脏功能的强弱与MIRI损伤程度密切相关,LVFS、CO及LVEF是反映心脏功能的重要指标。MIRI常导致LVFS、LVEF和CO降低,损害心功能[19-20]。本实验结果证明,环阿屯醇可以有效提高MIRI小鼠的LVFS、LVEF和CO,改善心功能,保护心肌组织。
CK广泛存在于心肌细胞中,而正常状态下CK-MB的含量在心肌组织中占比极低,当心肌组织受损时,CK-MB含量将会剧增。LDH在心肌组织中含量最高,心肌再灌注时,不断堆积的氧自由基(ROS)会进一步引起心肌组织脂质过氧化,导致心肌组织进一步损伤,使CK-MB、LDH等大量漏出。故在临床诊断中常以CK-MB和LDH的水平反映心肌梗死病变[21-23]。本实验通过测定小鼠血清中CK-MB和LDH的含量,评估各组小鼠MIRI的情况。实验结果显示,环阿屯醇预处理可以降低心肌缺血再灌注小鼠血清中CK-MB和LDH含量,说明环阿屯醇可以有效减轻MIRI,达到保护心肌组织的作用。
炎性反应在MIRI过程中普遍存在,当组织缺血时,大量的炎性细胞聚集于血管内皮周围,激活免疫应答,释放炎性物质[24]。再灌注时,大量炎性细胞随血液进入组织,进一步加剧炎性反应,造成心肌组织的二次损伤。减少炎性反应可以减轻血管内皮及心肌细胞的损伤,降低MIRI的发生率和发展速度。本实验研究表明,环阿屯醇预处理可以降低MIRI小鼠血清中的CK-MB、LDH、IL-6、TNF-α和cTnI水平,减少心肌组织IL-6、TNF-α的表达,说明环阿屯醇可能通过减少心肌缺血再灌注过程中炎性反应的发生,从而有效保护心肌组织。
MAPK是一种体内常见的丝氨酸/苏氨酸蛋白激酶,它可以把信号由细胞表面传送到细胞内部,被细胞因子、激素、神经递质等细胞间交流方式激活,是细胞发生增殖、生长、分化及凋亡[25]等生物活性反应的重要成员。在MIRI过程中,p38 MAPK凭借其活跃的生物活性,参与调节炎性反应、氧化应激、钙超载及细胞凋亡等[26]。SB203580为较优秀的p38 MAPK磷酸化抑制剂,本实验用其与环阿屯醇作对比,以评估环阿屯醇对抑制p38 MAPK磷酸化的作用[27-28]。研究结果显示,环阿屯醇预处理可以减少p-p38 MAPK的表达量,降低p-p38 MAPK/p38 MAPK的比值。
综上,环阿屯醇预处理对MIRI有明显的保护作用。环阿屯醇可以有效提高心肌细胞活力,改善缺血再灌注后心肌收缩功能,减少CK-MB和LDH的水平,降低炎性因子的释放,降低p-p38 MAPK/p38 MAPK的比值。但本研究未能深度挖掘出环阿屯醇影响p38 MAPK磷酸化的上下游相关因子。目前尚未有被广泛承认的针对治疗MIRI的有效药物,因此本文仅用了不同剂量的环阿屯醇进行对比,后续实验中将对此继续进行深入研究和探讨。

