托里消毒散通过调控NF-κB信号通路对大鼠皮瓣缺血再灌注损伤的影响
陈浩,张天琦,马骁,付秋悦,张杉,严肃,陈刚
(1.南京中医药大学附属医院/江苏省中医院整形外科,江苏 南京 210029;2.宜兴市中医院整形外科,江苏 宜兴 214200)
皮瓣移植作为修复创面和皮肤缺损的重要手段[1],在整形外科、血管外科、显微外科及骨科等领域应用广泛,而其最常见的并发症——缺血再灌注损伤,常常会引起皮瓣坏死,给患者及其家庭造成一定经济和心理负担。在临床上,术后发生皮瓣缺血再灌注损伤的患者往往体衰无力,局部难以温养,而其局部紫暗、刺痛等特点,满足血瘀的表现,故将其病理特点概述为“气虚血瘀”。针对其特点,我们运用补托法代表方——托里消毒散对出现皮瓣缺血再灌注损伤的患者进行治疗,发现该方可有效防治皮瓣缺血再灌注损伤。托里消毒散出自《外科正宗》[2],由人参、川芎、白芍、黄芪、白术、茯苓、当归、金银花、白芷、甘草、桔梗、皂角刺组成。但目前针对托里消毒散治疗机制方面的研究报道较少。NF-κB作为防治皮瓣缺血再灌注损伤的经典通路,在皮瓣缺血再灌注损伤过程中发挥着重要作用。因此本研究拟在构建大鼠背部任意皮瓣缺血再灌注损伤模型的基础上,通过分析皮瓣的成活率、检测NF-κB通路的p-p65和p-IκBα蛋白指标,TNF-α、IL-1β与IL-6炎性因子的表达情况和皮瓣表皮Ki67及CD31表达,探讨托里消毒散对大鼠皮瓣缺血再灌注损伤的保护作用及其机制,为托里消毒散治疗皮瓣缺血再灌注损伤的临床应用提供新的科学依据。
1 材料与方法
1.1 实验动物
选取健康SD大鼠40只,雌雄各半,体质量(250±20)g,购自江苏华创信诺医药科技有限公司,实验动物许可证号:SCXK(苏)2020-0009。饲以条杆状动物饲料,自由饮水,环境保持20~25 ℃、恒湿(50±5)%,自然采光。动物实验规程经南京中医药大学实验动物伦理委员会批准(ACU210127)。
1.2 实验药品和试剂
NF-κB p65抗体(货号:AF1234)、p-NF-κB p65(Ser276)抗体(货号:AF5875)、IκBα抗体(货号:AF1282)、p-IκBα(Ser32)抗体(货号:AF1870)、Ki67抗体(货号:C2312S)、CD31抗体(货号:AG5142)购自于碧云天;大鼠血清 TNF-α(货号:MTA00B-1)、IL-6(货号:SM6000B) 和 IL-1β(货号:DY401)ELISA检测试剂盒购自R&D System。
1.3 主要仪器及设备
超低温冰箱(捷盛,型号:DW-86W208);酶标仪(美国伯乐,型号:680);显微镜(德国宝视德,型号:88-55008);水浴锅(泰斯特,型号:DK-98-Ⅱ);超净工作台(博科,型号:BBS-DDC);实时荧光定量PCR仪(优云谱,型号:YP-PC)。
1.4 模型制备
参照改良McFarlane[3]皮瓣模型的方法在大鼠背部制备任意皮瓣:以大鼠尾侧两髂嵴连线为蒂、大鼠背脊为中轴线,在大鼠背部设计2 cm×8 cm的矩形皮瓣。异氟烷吸入麻醉后,沿既定设计线切开皮肤及皮下组织,彻底分开皮下及皮下肉膜层组织,阻断皮瓣与皮下组织的血运联系,由颅侧向尾侧掀起皮瓣,彻底止血后,使用0号丝线原位缝合,术后6 h出现不同程度的缺血损伤,视为造模成功。Sham组大鼠背部皮瓣形成后,立刻缝合。见图1。
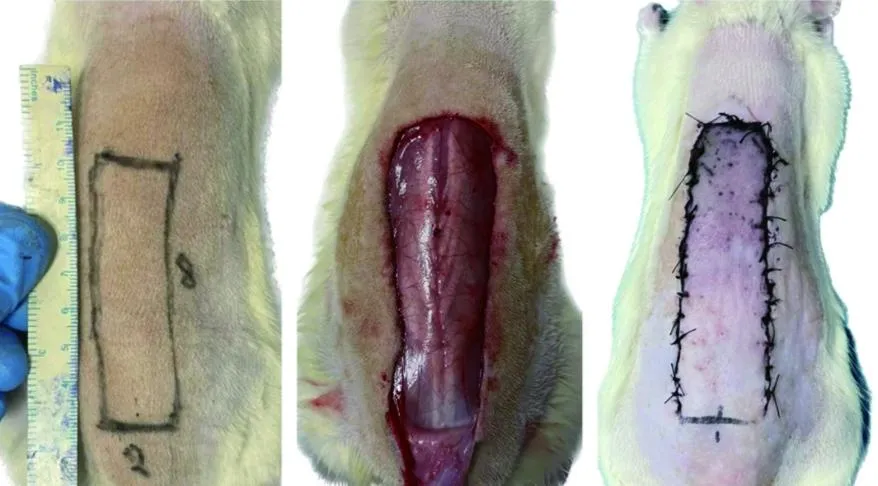
图1 大鼠背部皮瓣缺血再灌注模型制备
1.5 分组
大鼠随机分为假手术组(Sham组)、模型组(Model组)和托里消毒散高剂量组(MDX-H组)和托里消毒散低剂量组(MDX-L组),每组10只。
1.6 实验步骤
托里消毒散由人参3 g,黄芪3 g,当归3 g,川芎3 g,白芍3 g,白术3 g,茯苓3 g,金银花1.5 g,白芷1.5 g,甘草1.5 g,桔梗1.5 g,皂角刺1.5 g组成,药材均购自南京中医药大学附属医院,采用传统机器水煎法提取后将其浓缩,制成生药含量为5 g·mL-1的溶液,冷却后储存于2~6 ℃备用。给药前,将托里消毒散药液分别稀释为高剂量2.5 g·mL-1和低剂量1.25 g·mL-1。
MDX-H组与MDX-L组在术后当天起,予以2 mL托里消毒散药液灌胃给药,Sham组和Model组大鼠灌胃等体积生理盐水。每日1次,连续用药14 d,观察皮瓣情况。
术后第14天将大鼠用异氟烷麻醉后脱颈处死,裁剪皮瓣组织并使用液氮保存,待送检。
1.7 计算皮瓣成活率
术后第14天用数码照相机拍摄皮瓣情况,用Image-J软件分析系统计算皮瓣成活面积和总面积,皮瓣成活率=皮瓣成活面积/总面积×100%。
1.8 HE染色观察皮瓣组织
皮瓣标本经10%中性缓冲甲醛固定后脱水,石蜡包埋,连续切片,切片厚4 μm,HE染色,采用显微镜观察各组动物皮瓣组织病理变化。
1.9 ELISA法检测血清IL-1β、IL-6与TNF-α水平
在第14天通过尾静脉采血法采集必要血样,使用低温分离机3 000 r·min-1离心10 min,分离各组大鼠血清2 mL。按照试剂盒说明书步骤,采用ELISA法检测血清IL-1β、IL-6与TNF-α水平。
1.10 Western blot检测p-p65和p-IκBα蛋白表达
用匀浆器将冷冻组织磨碎后,于低温环境中加入组织裂解液,提取背部皮瓣组织总蛋白,并用紫外分光光度计测定总蛋白浓度,绘制蛋白浓度标准曲线;取蛋白上样与聚丙烯酰胺凝胶电泳蛋白上样缓冲液混匀后,沸水加热进行蛋白变性,后置于-20 ℃冰箱中保存;在聚丙烯酰胺凝胶中加入等体积蛋白上样,100 V恒压电泳、250 mA恒流转膜、封闭后,加入1∶1 000比例稀释的一抗置于4 ℃环境下孵育过夜;一抗孵育后,PBST洗膜3次,然后加入1∶3 000比例稀释的二抗,室温下孵育60 min;二抗孵育后,PBST洗膜3次,并曝光显影;最后,使用Image J图像分析软件分析p-p65和p-IκBα蛋白表达。
1.11 检测Ki67和CD31表达
通过Ki67和CD31标记来观察皮肤基底层细胞及组织血管化程度。将孔板中的细胞悬液加入流式管中,随后加入配制好的固定/破膜液作用30 min。加入Ki67抗体,置于室温避光处理30 min,后用1%多聚甲醛溶液固定,上机分析。加入一抗(CD31)4 ℃孵育过夜,二抗室温避光孵育1 h,经DAB显色剂显色,封片后使用显微镜下拍照并记录内皮细胞标志蛋白质CD31的表达情况。
1.12 统计学方法
2 结果
2.1 托里消毒散对大鼠背部任意皮瓣缺血再灌注损伤成活率的影响
Model组术后水肿明显,有较多炎性液体渗出,皮瓣边缘坏死严重,14 d后仍未见脱痂,且毛发生长不良。与Model组相比,MDX-H组与MDX-L组术后出现少量水肿,有少量炎性物质渗出,脱痂时间提前,14 d后皮瓣缺血坏死情况得到明显改善,皮瓣坏死面积显著减少。见图2。
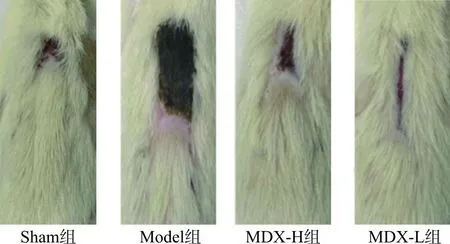
图2 大鼠第14天皮瓣观察情况比较
与Model组比较,14 d后MDX-H组、MDX-L组大鼠皮瓣成活率增加(表1),差异具有统计学意义(P<0.05),但MDX-H组与MDX-L组比较,皮瓣成活率差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠皮瓣成活率比较
2.2 托里消毒散对大鼠背部任意皮瓣缺血再灌注损伤组织病理变化的影响
据皮瓣上缘的组织HE染色结果显示,相比于Sham组正常的皮肤结构,Model组的皮瓣表面覆盖由坏死组织和炎性渗出物形成的厚痂,痂皮内侧可见少量的颗粒细胞层,棘细胞层细胞偏小,排列稍松散且不完整;可见有肉芽组织及浸润的炎性细胞。相比于Model组,MDX-H组和MDX-L组治疗后可有效改善缺血皮瓣组织的病理特征,组织切片上可见完整的表皮层和真皮层,同时可见初步形成的毛囊结构,炎性细胞浸润数量明显减少。与MDX-L组比较,MDX-H组组织结构更完整,水肿及炎性浸润程度更轻。见图3。

注:红色箭头代表浸润的炎性细胞。
2.3 托里消毒散对大鼠背部任意皮瓣缺血再灌注损伤皮瓣组织中NF-κB信号通路的影响
与Sham组比较,Model组大鼠皮瓣组织中p-p65和p-IκBα蛋白表达显著增高(P<0.001);与Model组比较,MDX-H组和MDX-L组大鼠皮瓣组织中p-p65和p-IκBα蛋白表达水平显著降低(P<0.001)。见图4。
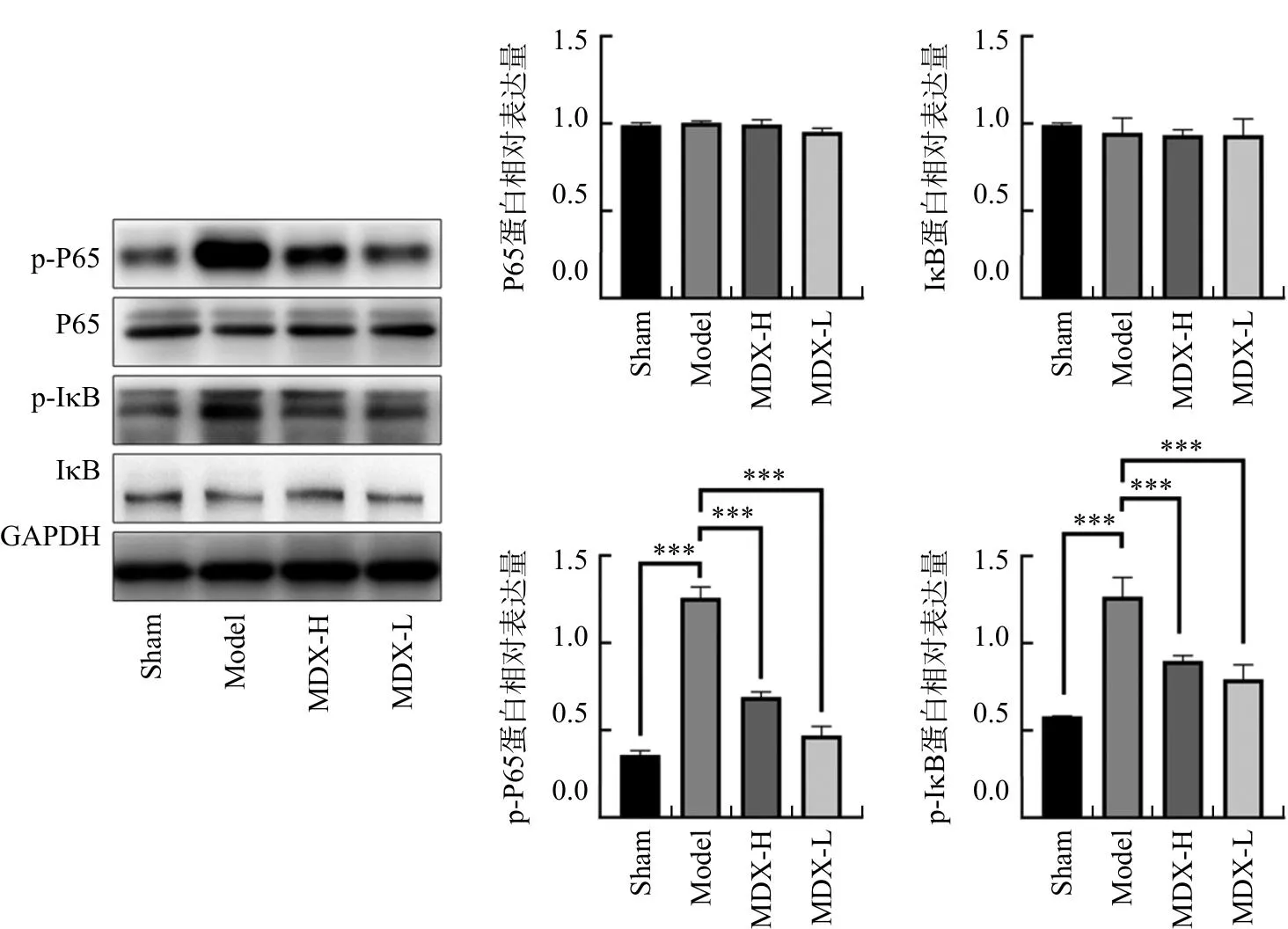
注:与Model组比较,
2.4 托里消毒散对大鼠血清炎性因子的影响
与Sham组相比,Model组大鼠血清IL-1β、IL-6和TNF-α表达水平显著升高(P<0.001,P<0.000 1);与Model组相比,MDX-H组和MDX-L组大鼠血清IL-1β、IL-6和TNF-α表达水平显著降低(P<0.05,P<0.01,P<0.001,P<0.000 1)。见图5。
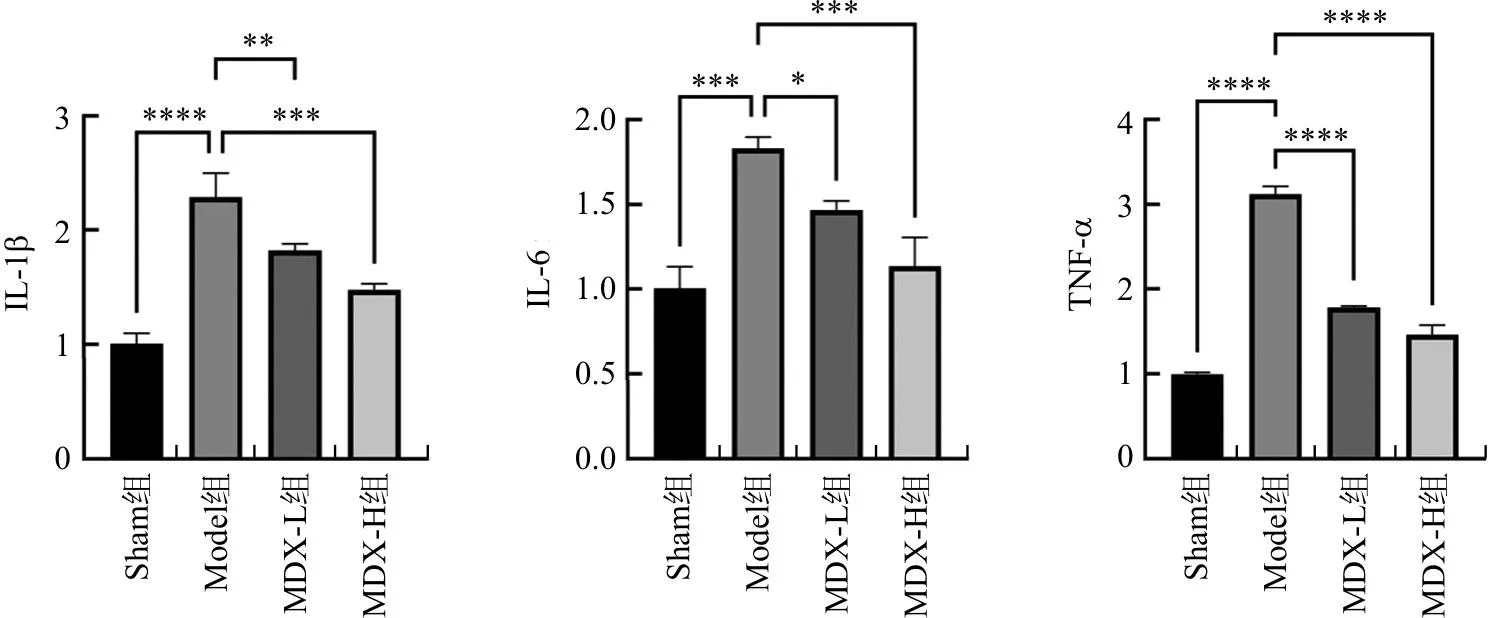
注:与Model组比较,
2.5 托里消毒散对大鼠背部任意皮瓣缺血再灌注损伤皮瓣组织上皮化与血管形成的影响
在Sham组皮瓣组织中,Ki67在表皮和毛囊细胞均有表达。Model组缺血再灌注损伤皮瓣组织伤口下没有形成完整的表皮结构,并且未见新生毛囊组织。MDX-H组和MDX-L组表皮基底层细胞中有较高Ki67的表达,真皮层可见新生毛囊组织,提示给药治疗后加快了皮瓣组织损伤后的再上皮化。CD31是一种内皮细胞标志物,可用于免疫组织化学染色以确认组织血管化程度。相比于Sham组,Model组皮瓣尚有较强的CD31的染色,提示Model组尚处在血管分化和生长阶段,但其并没有形成相对完整的血管结构;而MDX-H组和MDX-L组血管化程度相对较高,与Sham组在结构上更为接近,提示MDX-H组和MDX-L组的皮瓣发生缺血再灌注损伤后,血管的分化和生长速度加快。 见图 6。
3 讨论
皮瓣移植技术作为治疗以皮肤缺损为主要表现的开放性损伤的主要手段,在整形外科、显微外科及骨科等领域广泛应用[4-7]。而皮瓣缺血再灌注损伤可导致皮瓣坏死,给家庭和社会造成了一定的负担[5]。临床上仍缺乏安全有效、成本低且可耐受的防治皮瓣缺血再灌注损伤的治疗方法。
通过外科手术技巧预防皮瓣缺血坏死经过多年研究,尚无突破性进展;各种改善微循环的药物、生长因子、血管活性药物、局部红外线照射、外用辅料[4]等,都有其副作用及局限性。故建立具有针对性的辅助治疗措施,以期减少皮瓣缺血再灌注损伤引起的皮瓣坏死,是目前研究的重点。
中医学并无“皮瓣缺血再灌注损伤”这一病名,近现代医家总结其临床病理变化集中表现为血瘀之证[8],即血液运行郁滞,形成瘀积。病人表现为局部色黑色暗,痛有定处,甚至形成肿块,触之较硬。查体亦可发现,病人常见唇舌紫暗甚至舌有瘀点、瘀斑,皮瓣周遭往往肌肤甲错,皆为血瘀之象。皮瓣缺血再灌注损伤的病理表现为局部血液循环受阻或血管再生障碍以及血栓形成等,与血瘀之病机不谋而合。亦有研究表明[8-10],运用活血化瘀、补气行血等法,可提高大鼠皮瓣的生存面积。故将皮瓣缺血再灌注损伤归类为血瘀范畴。患者年老气虚或术后体虚而血运无力,瘀阻经脉,蕴结为浊毒,久而化热,败坏肌表,发而为病。本课题组认为其病机为“气虚血瘀,浊瘀侵损”。
陈实功言:“托里消毒散治胃气虚弱或因克伐不能溃散,服之未成即消,已成即溃,腐肉自去新肉自生。”[2]本方重用人参、黄芪,取其甘温益气之性,旨图托疮生肌之效。当归、川芎二药养血活血行气,与人参、黄芪相配,俾气旺血充,以期生肌长肉。白芷、甘草、金银花在扶正透脓之中,兼能透解热毒;白芍、白术、白茯苓三白相配,补气健脾、养血调经;皂角针、桔梗消肿托脓外排,以辅生肌。
李玉珠[11]研究发现,托里消毒散四种中药提取物均可促进细胞的增殖;李依洋等[12]则猜测,托里消毒散精简方中黄酮、皂苷、香豆素、甾体类等成分可能为该方主要的药效物质,这些成分可能通过调节免疫、抗炎、促血管新生等作用进而促进糖尿病大鼠创面的愈合。刘建等[13]发现托里消毒散联合化腐生肌膏能够有效促进老年髋骶部Ⅳ度褥疮患者疮口愈合,降低证候积分;刘慧等[14]用托里消毒散内服联合九华膏外用治疗非哺乳期乳腺炎溃后期,发现在缩小创面、改善创面脓腐情况且减轻疼痛症状等方面,优于其他治疗方案。王飞等[15]研究发现,黄芪甲苷可通过抑制TLR4/NF-κB信号通路发挥抗炎作用,能明显降低皮瓣缺血再灌注大鼠血清炎性因子TNF-α、IL-6和IL-1β表达水平和组织过氧化反应,提高抗氧化酶SOD活性;马红伟等[16]研究发现,人参皂苷通过提高生长因子含量,下调Wnt/β-catenin信号通路内相关蛋白表达加速创面愈合。
NF-κB家族[17]作为炎症反应的核心,也是皮瓣缺血再灌注损伤的主要致病因素,该信号通路是机体病理改变过程中的关键,在介导炎性分子表达中非常重要。研究发现,该信号通路在脑[18]、肾[19]等实质器官,以及创面、皮瓣[20]的缺血再灌注损伤已有一定研究。缺血再灌注损伤还可以引起组织内产生并释放出大量的炎性因子(如IL-1β、IL-6、TNF-α)[5],直接诱导皮肤细胞的凋亡与坏死。而本研究结果显示,通过检测NF-κB通路的p-p65和p-IκBα蛋白指标以及大鼠血清炎性因子IL-1β、IL-6和TNF-α的表达水平,可以在一定程度上证明托里消毒散治疗可抑制NF-κB通路介导的组织炎性反应,减轻缺血皮瓣的炎症情况,缓解大鼠皮瓣缺血再灌注损伤。
Ki67是细胞增殖活性的标志物,通常高表达于皮肤表皮的基底层细胞[21]。此外,血管生成在缺血皮瓣的损伤修复过程中至关重要,血管为其修复提供祖细胞、氧气和营养物质,以维持缺血皮瓣中各种细胞的增殖和重塑。CD31常用于免疫组织化学染色以确认组织血管化程度[22]。而本研究所见的表皮基底层细胞Ki67的表达,提示托里消毒散给药治疗后加快了皮瓣组织损伤后的再上皮化,CD31的标记也提示托里消毒散治疗加快了损伤后的末梢血管的再生。
综上,托里消毒散可能通过调控NF-κB信号通路、抑制炎症反应、加速缺血再灌注损伤组织上皮化和血管生成等方面,从而发挥改善皮瓣缺血再灌注损伤的作用。同时,本文的样本量较小,高、低剂量组结果较为接近,且中药复方具有的多成分、多通路、多靶点等特点也要求我们进一步探索。因此,之后的研究计划中将考虑扩大样本量并探索该方剂最佳剂量及浓度,同时研究其具体成分、其他潜在通路及相关靶点,以期更好地为托里消毒散治疗皮瓣缺血再灌注损伤的临床应用提供更佳的指导意见。
——浅析美国短篇小说《宰恩的召唤》中的爱情观

