IL-37、FFA与HbA1c水平在T2DM患者中的表达及其相关性分析
申 敏,李 真,张 红,陈正涛,刘庆华△
1.山东省泰安荣军医院检验科,山东泰安 271000;2.山东第一医科大学附属第二医院检验科,山东泰安 271000;3.山东第一医科大学附属第二医院血液内科,山东泰安 271000;4.山东第一医科大学实验动物学院,山东泰安 271000
流行病学调查表明,2型糖尿病(T2DM)发病率呈逐年上升趋势,近几年有人提出T2DM是一种慢性炎症性疾病,主要通过多种组织释放炎症细胞因子而诱发[1],白细胞介素(IL)-1家族近年来发现的新成员——IL-37,通过抑制炎症细胞因子的产生而发挥抗炎作用,在各种炎症反应主导的疾病过程中起到保护性作用[2-4],但是在T2DM中的作用机制还不清楚。血清游离脂肪酸(FFA)是脂肪代谢的中间产物,是人糖脂代谢紊乱的危险因素。本研究通过对T2DM患者血清IL-37、FFA和糖化血红蛋白(HbA1c)水平的检测及其相关性的分析,探索3项指标在T2DM疾病过程中的作用,以期为T2DM患者的诊断及治疗提供新思路。
1 资料与方法
1.1一般资料 选择2019年5—11月山东第一医科大学附属第二医院(以下简称本院)收治的130例T2DM患者为T2DM组,其中男65例,女65例;年龄24~85岁,平均(56.9±11.7)岁。(1)纳入标准:①年龄≥18岁;②均符合《中国2型糖尿病防治指南(2017年版)》诊断标准[5]。(2)排除指标:①糖尿病酮症酸中毒(DKA)、高血糖高渗综合征、乳酸中毒等糖尿病急性并发症;②合并慢性炎症性疾病、恶性肿瘤;③存在肝肾衰竭、免疫性疾病,心功能3~4级;④合并糖尿病足(DF)、糖尿病肾病(DKD)5期等糖尿病严重并发症;⑤2个月内处于急性应激状态,如接受外科手术,存在活动性感染等。另选取本院100例体检者作为健康对照组,其中男52例,女48例;年龄25~75岁,平均(51.1±12.1)岁。T2DM组与健康对照组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。根据2018年初美国内科医师学会(ACP)更新的关于T2DM HbA1c控制目标的指南将T2DM患者按照HbA1c水平分为HbA1c<7%组与HbA1c≥7%组。所有研究对象均自愿参与本研究,并签署知情同意书,本研究经本院医学伦理委员会批准。
1.2方法 所有受试者空腹10~12 h后,清晨抽取静脉血标本7 mL。取2 mL静脉血标本 3 000 r/min离心10 min分离血清,置于—80 ℃冰箱保存,用于IL-37水平检测[酶联免疫吸附试验(ELISA)、上海蓝基生物科技有限公司生产试剂);取3 mL静脉血标本采用Beckman OlympusAU5800全自动生化分析仪检测以下生化指标:总胆固醇(TC,酶法)、甘油三酯(TG,酶法)、高密度脂蛋白胆固醇(HDL-C,直接法)、低密度脂蛋白胆固醇(LDL-C,直接法)、FFA(酶法)、空腹血糖(FPG,六糖激酶法)、载脂蛋白A1(APOA1,酶法)、载脂蛋白B(APOB,酶法)。提取乙二胺四乙酸二钾(EDTA-K2)抗凝静脉血2 mL,采用日本ARKRAY公司的HA-8180分析仪,采用高效液相离子色谱法检测HbA1c水平。

2 结 果
2.1T2DM组与健康对照组各项指标比较 T2DM组IL-37、FPG、FFA、TC、TG、HbA1c、LDL-C、APOA1、APOB水平明显高于健康对照组,HDL-C水平低于健康对照组,差异均有统计学意义(P<0.05)。见表1。
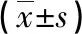
表1 T2DM组与健康对照组各项指标比较
2.2HbA1c<7%组与HbA1c≥7%组各项指标比较 HbA1c <7%组FPG、FFA、IL-37、APOA1水平明显低于HbA1c≥7%组,差异有统计学意义(P<0.05);HbA1c <7%组与HbA1c≥7%组TC、TG、HDL-C、LDL-C、APOB水平比较,差异无统计学意义(P>0.05)。见表2。
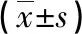
表2 HbA1c <7%组和HbA1c≥7%组各项指标比较
2.3T2DM患者血清IL-37水平与FFA、HbA1c水平的相关性分析 T2DM患者血清IL-37水平与FFA、HbA1c水平均呈正相关(r=0.617、0.682,P<0.05)。见图1、2。

图1 IL-37水平与FFA水平的相关性

图2 IL-37水平与HbA1c水平的相关性
3 讨 论
IL-37是2000年KUMAR等[6]发现的IL-1家族的新成员,正常生理情况下,IL-37可以表达在人类的许多细胞中,但健康的人体细胞中IL-37水平很低,它可以被Toll样受体激活剂和促炎症因子激活,如IL-1β、转化生长因子(TNF)-α和干扰素(IFN)-γ[7]。通过抑制炎症细胞因子的产生,IL-37可发挥抗炎效果[8-10]。IL-37在调节免疫系统稳态方面起着不可缺少的作用,参与炎症和自身免疫性疾病的发病机制,激活后维持高水平表达,具有广泛的免疫抑制活性。有研究表明,IL-37的抗炎效果对脂肪组织炎症的调节和肥胖引起的胰岛素抵抗有一定的作用[11]。作为抑制炎症调节代谢途径的抗炎细胞因子,有研究报道IL-37在糖尿病中异常表达[12]。在机制上,IL-37可逆转有核细胞中训练免疫(TI)的免疫代谢变化和球蛋白翻译后的修饰特征,从而抑制细胞因子的产生以应对感染。因此,IL-37作为TI的抑制剂出现,并可作为免疫介导的潜在治疗靶点[13]。
血清FFA是一种中性脂肪的分解产物,是胰岛β细胞刺激分泌偶联的必需物质[14],FFA参与人体多项代谢调控,与T2DM的发生、发展有密切关系,能在一定程度上反映T2DM患者体内的脂肪代谢状况。FFA代谢失调是引起胰岛素抵抗和T2DM的重要事件,根据Randle循环(葡萄糖-脂肪酸循环),FFA对葡萄糖的优先氧化在胰岛素敏感性和糖尿病代谢紊乱中起重要作用[15]。本研究表明,T2DM患者IL-37、FPG、FFA、TC、TG、HbA1c、LDL-C、APOA1、APOB水平明显高于健康对照组,HDL-C水平明显低于健康对照组,差异均有统计学意义(P<0.05)。FFA和葡萄糖的慢性过载可直接或通过增加活性氧的产生间接触发炎症通路,观察到的慢性低水平代谢性炎症可能由内皮细胞活化和胰岛素抵抗引起[16]。同时,IL-37水平的升高也表明T2DM组已经出现了不同程度的炎症,这说明它们之间存在着紧密的联系。 HbA1c <7%组FPG、FFA、IL-37、APOA1水平明显低于HbA1c≥7%组,差异有统计学意义(P<0.05),这表明T2DM患者如血糖控制不佳(HbA1c≥7%组)会出现糖脂代谢障碍和不同程度的炎症,且IL-37、FFA水平随T2DM病情加重而升高,FFA水平的慢性升高可导致脂质代谢调节障碍,引起脂毒性,说明IL-37、FFA在疾病过程中发挥免疫抑制、调节炎症反应的作用[17],炎症细胞因子间的不平衡可能是T2DM的发病机制之一。过量的血糖和FFA通过氧化应激和内质网应激刺激机体产生大量的炎症细胞因子和趋化因子,持续的高血糖导致机体单核巨噬细胞合成分泌功能异常,炎症介质大量释放到血液中,形成机体微炎症状态,FFA水平可客观反映T2DM患者机体微炎症程度[18-19]。本研究结果表明T2DM组患者血清中IL-37水平升高,体内存在大量炎症介质,因此,IL-37和FFA水平共同反映了身体的炎症程度和T2DM病情的严重程度。
本研究相关性分析结果显示,T2DM患者血清IL-37水平与FFA水平呈正相关(r=0.617,P<0.05)。而且在许多炎症性疾病的发生和发展过程中IL-37都参与其中,说明IL-37水平和FFA水平分别能客观反映T2DM患者的机体炎症程度和脂毒性程度。HbA1c<7%的T2DM患者IL-37水平较低,而HbA1c≥7%的T2DM患者IL-37水平升高,表示IL-37水平与T2DM疾病的严重程度有很大的关系。相关性分析结果显示,IL-37水平与HbA1c呈正相关(r=0.682,P<0.05),提示IL-37水平与T2DM关系密切。
综上所述,临床上迫切需要能有效降低T2DM并发症发病风险的早期预警标志物,以实现对T2DM的早发现、早治疗,减轻患者并发症发生的风险和病死率。本研究结果显示,IL-37是一个潜在的预测T2DM和病情观察的新指标,尤其是其与FFA的联合检测,值得进一步深入研究,为T2DM 的分层治疗、提高临床疗效、降低医疗资源消耗提供参考依据。

