高敏丙型肝炎病毒核糖核酸在丙型肝炎中的诊断价值
戴倩梅,丁体龙△,代雪枫,于 莉,陈 策
中国人民解放军联勤保障部队第九O二医院:1.中心实验室;2.感染科,安徽蚌埠 233015
丙型肝炎是较常见的病毒性肝炎之一,发病率仅次于乙型肝炎。丙型肝炎病毒核糖核酸(HCV-RNA)是判断丙型肝炎活动性的最重要指标。由于技术原因,普通HCV-RNA的检测下限一般为500 IU/mL,HCV-RNA阴性患者丙型肝炎病毒(HCV)仍可能处于活动期,传染性也可能仍然较强,不能准确反映HCV在体内的复制状态。高敏HCV-RNA检测是近年来发展起来的一项新技术,将HCV-RNA的检出下限提升至15 IU/mL,甚至10 IU/mL,为丙型肝炎的疗程监测和治疗终点的判断提供了很大的帮助。有关高敏HCV-RNA研究的相关报道较少,本研究采用赛沛全自动医用聚合酶链反应(PCR)分析系统检测48例HCV抗体阳性患者和40例HCV抗体阴性的健康体检者血清中HCV-RNA水平,计算灵敏度和特异度,与普通PCR法检测的HCV-RNA和HCV核心抗原进行比较,探讨高敏HCV-RNA在丙型肝炎诊断和病情监测中的应用价值,现将结果报道如下。
1 资料与方法
1.1一般资料 选择2020年5月至2022年10月于本院门诊及住院的48例慢性丙型肝炎患者作为观察组,男32例,女16例;年龄11~78岁,平均(49.0±11.3)岁;HCV抗体均为阳性,符合《丙型肝炎防治指南(2015年更新版)》的诊断标准[1]。另选择同期本院健康体检中心40例健康体检者作为对照组,其中男25例,女15例;年龄18~69岁,平均(47.6±12.6)岁;HCV抗体均为阴性。所有研究对象乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体、梅毒螺旋体抗体检测结果均为阴性,无精神病史;1周内未使用抗病毒药物和保肝降酶药物。所有研究对象均充分了解并同意参与本研究,本研究开展前获得本院医学伦理委员会批准(伦理批号20200302001),对所有研究对象的个人资料和检查结果予以保密。
1.2方法
1.2.1标本采集 采集所有研究对象空腹静脉血5 mL,以2 000 r/min转速分离血清,—80 ℃低温冰箱保存待检。
1.2.2高敏HCV-RNA检测的性能验证 参照CNAS-GL037《临床化学定量检验程序性能验证指南》(2019版)对赛沛全自动医用PCR分析系统(GeneXpert)检测HCV-RNA进行性能验证。(1)正确度验证:采用HCV血清(冻干)标准物质S3(4.40×105IU/mL)和阴性血浆制成验证标本,稀释成GeneXpert检测单位,每个浓度单位10份标本,分别为HCV1(44 000 IU/mL)、HCV2(4 400 IU/mL)、HCV3(440 IU/mL)、HCV4(44 IU/mL)、HCV5(11 IU/mL),统计所有标本的检测结果。(2)精密度验证:采用HCV2作为精密度验证标本,重复检测3次,并计算精密度。(3)线性区间验证:采用HCV血清(冻干)标准物质S3(4.40×105IU/mL)和阴性血浆制成验证标本,稀释成GeneXpert检测单位,每个浓度单位3份标本,分别为HCV1(44 000 IU/mL)、HCV2(4 400 IU/mL)、HCV3(440 IU/mL)、HCV4(44 IU/mL)、HCV5(11 IU/mL),将检测定值结果绘制成线性图。将HCV1、HCV2、 HCV3、 HCV4、HCV5检测定值的平均值取对数值后,与理论靶值结果作图,验证不同浓度的线性相关性。(4)可报告范围验证:采用HCV血清(冻干)标准物质S3(4.40×105IU/mL)和阴性血浆制成验证标本,稀释成GeneXpert检测单位为HCV LoD(4.4 IU/mL)上机检测,统计检测结果。(5)特异度验证:采用溶血血浆和脂血血浆将HCV血清(冻干)标准物质S3(4.40×105IU/mL)分别稀释成4 400 IU/mL和440 IU/mL两个可检测浓度,每份标本重复检测3次,计算平均值和标准差。(6)灵敏度验证:采用HCV血清(冻干)标准物质S3(4.40×105IU/mL)和阴性血浆制成验证标本,稀释成GeneXpert检测单位为HCV LoD(4.4 IU/mL)上机检测,统计检测结果。
1.2.3HCV抗体检测 HCV抗体采用酶联免疫吸附试验检测试剂盒检测,试剂盒购自华大吉比爱生物技术有限公司,严格按照试剂盒说明书操作。
1.2.4高敏HCV-RNA检测 GeneXpert购自美国赛沛(Cepheid AB)生物技术有限公司,型号为XVI Dx,所用试剂为Xpert HCV Viral Load,由瑞典赛沛(Cepheid AB)生物技术有限公司生产,检测下限值为10 IU/mL。试验前,对高敏HCV-RNA进行了性能验证,性能验证试验所用标本购自北京康彻斯坦生物技术有限公司,HCV血清(冻干品)标准物质,国家标准物质证书:GBW(E)090142,浓度编号S3,靶值4.40×105IU/mL,不确定度为±0.5×105IU/mL,参考范围为(3.90~4.90)×105IU/mL(对数值:5.59~5.69)。
1.2.5普通HCV-RNA检测 采用厦门安普利生物技术有限公司的全自动核酸提纯系统(Anadas9850)、荧光定量PCR分析系统及其配套的核酸提取试剂(批号:A105420220713)、扩增试剂(批号:A2020202220811),由专人严格按照设备及试剂盒说明书操作。
1.2.6HCV抗体及HCV核心抗原检测 HCV抗体及HCV核心抗原检测采用酶联免疫吸附试验,试剂盒由山东莱博生物科技有限公司提供,批号:202209005,由专人严格按照试剂盒说明书操作。
1.3统计学处理 采用简明统计V14.0软件进行数据处理及统计学分析。计数资料以百分率表示,组间比较采用χ2检验。线性范围验证采用不同浓度的标准品取对数与预期浓度对数值进行回归方程,计算R2。以P<0.05为差异有统计学意义。
2 结 果
2.1高敏HCV-RNA性能验证结果
2.1.1正确度验证结果 HCV1、 HCV2、 HCV3、 HCV4、HCV5检测结果的对数值与理论值偏差都在±0.5之内,符合标准物质说明书正确度要求(检测值与理论值取对数偏差不超过±0.5)。
2.1.2精密度验证结果 HCV2重复检测3次结果分别为4 255、4 683、4 435 IU/mL,变异系数分别为-3%、6%、1%,都在±10%以内,检测重复性良好,试剂盒精密度符合要求。
2.1.3线性区间验证结果 不同浓度标准物质检测结果计算得到回归方程Y=1.022 5X—0.131 2,︱r︱>0.98,斜率>0.95验证通过,线性预测结果可靠,一致性好。见图1。GeneXpert检测提供的说明书中表示HCV VL Assay在0.8~8.0 log 10 IU/mL范围内呈线性,R2>0.997,在0.994~0.998以内,所有基因型均呈线性反应。
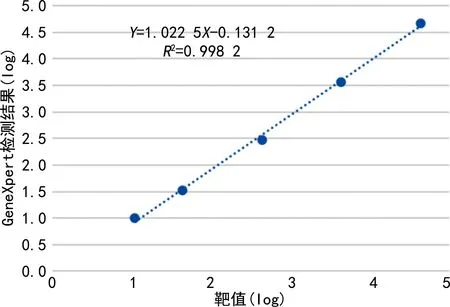
图1 GeneXpert HCV-RNA检测值与靶值线性相关关系
2.1.4可报告范围验证结果 HCV LoD(4.4 IU/mL)的检测结果为HCV-RNA<10 IU/mL,GeneXpert可检测浓度为104IU/mL,最大稀释倍数为104倍,检测上限值为108IU/mL。可报告范围为10~108IU/mL,符合可报告范围要求,最低检出限和最高检出限符合验证标准。
2.1.5特异度验证结果 溶血血浆和脂血血浆稀释后的标准物质与定值比较,变异系数均在±10%以内,特异度高,试剂盒特异度验证符合标准。
2.1.6灵敏度验证结果 HCV LoD(4.4 IU/mL)的检测结果为HCV-RNA<10 IU/mL,最低检测下限为10 IU/mL,灵敏度验证符合要求。
2.2高敏HCV-RNA与普通HCV-RNA在丙型肝炎诊断中的灵敏度及特异度比较 高敏HCV-RNA诊断灵敏度为91.67%,特异度为92.50%,诊断试验四格表见表1,普通HCV-RNA 诊断灵敏度为68.75%,特异度为100.00%,诊断试验四格表见表2。高敏HCV-RNA诊断丙型肝炎的灵敏度明显高于普通HCV-RNA,特异度略低于普通HCV-RNA,差异有统计学意义(P<0.05)。
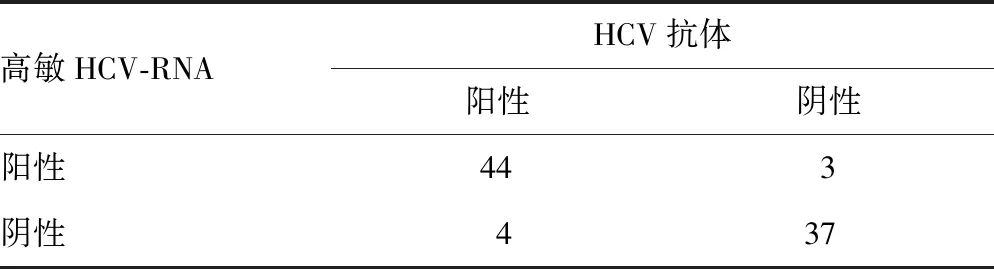
表1 高敏HCV-RNA诊断丙型肝炎结果(n)

表2 普通HCV-RNA诊断丙型肝炎结果(n)
2.3高敏HCV-RNA与HCV核心抗原在丙型肝炎诊断中的灵敏度及特异度比较 HCV核心抗原诊断灵敏度为66.67%,特异度为97.50%,诊断试验四格表见表3。高敏HCV-RNA诊断丙型肝炎的灵敏度明显高于HCV核心抗原,特异度略低于HCV核心抗原,差异有统计学意义(P<0.05)。

表3 HCV核心抗原诊断丙型肝炎结果(n)
3 讨 论
HCV-RNA检测结果主要用于判断HCV的复制情况,是丙型肝炎传染性强弱的重要标志,也可用于丙型肝炎抗病毒治疗方案的选择和治疗后的预后判断[2]。传统的HCV-RNA检测方法主要采用荧光定量PCR法检测,检测下限值一般为500 IU/mL。由于实验环境中可能存在RNA酶而导致扩增抑制,造成假阴性结果,或者扩增产物的污染易造成假阳性结果[3]。目前常用的核酸提取方法分为磁珠提取法和柱提法。有研究发现,磁珠提取法比柱提法敏感度更高,尤其在低病毒载量标本的检测中优势明显[4],具有较高的临床应用价值。随着分子诊断技术的不断进步,HCV-RNA的检测下限值不断被刷新。GeneXpert运用半巢式定量PCR+微流控技术,整合标本制备、核酸扩增和检测3个步骤于一个独立的试剂盒中,并将其自动化,使标本处理既方便又快捷,整个标本处理过程可在2 min内处理完毕。核酸提取过程则在试剂盒的不同通道中完成,可最大限度地减少污染的发生。为了比较高敏HCV-RNA与普通HCV-RNA在诊断丙型肝炎中的灵敏度,课题组采用GeneXpert和厦门安普利Anadas9850同时检测了48例HCV抗体阳性患者和40例HCV抗体阴性的健康体检者的HCV-RNA,结果显示高敏HCV-RNA的灵敏度明显高于普通HCV-RNA,差异有统计学意义(P<0.05)。HCV核心抗原是丙型肝炎诊断的另一敏感指标,可能会通过影响基因组的表达调控,从而影响细胞的增殖分化[5]。本研究结果显示,高敏HCV-RNA诊断丙型肝炎的灵敏度明显高于HCV核心抗原,差异有统计学意义(P<0.05)。与鞠伟[6]的研究结论相类似,提示高敏HCV-RNA在丙型肝炎病原学诊断中优势最为明显。
由于常规PCR法检测HCV的灵敏度较低,在临床上易造成部分患者的漏诊和漏治。欧洲肝病协会在有关丙型肝炎防治指南中推荐采用高敏HCV-RNA(检测下限15 IU/mL)作为急慢性丙型肝炎的诊断指标[7],对于治疗方案的拟订和预后判断具有重要的指导意义。目前,临床上常用的丙型肝炎抗体检测方法有酶联免疫吸附试验、金标法和化学发光法等[8]。一般来说,酶联免疫吸附试验的阳性检出率比金标法高,具有较高的灵敏度和特异度,磁微粒化学发光法与酶联免疫吸附试验比较,其灵敏度更高,检测时间更短,可提高临床丙型肝炎检测的准确度[9]。但由于窗口期的存在,HCV感染后3~4周才能检测到HCV抗体,或者由于患者本身的免疫缺陷,导致机体不能产生抗体或抗体产生的量达不到检测标准,都会导致HCV抗体假阴性,本研究对照组40例HCV抗体阴性者中,HCV-RNA阳性有3例,可能属于上述情况。常规PCR检测HCV-RNA,由于灵敏度不够,在HCV抗体阴性患者中鉴别是否有HCV感染优势不明显。而高敏HCV-RNA则可在HCV急性感染的早期检出,提示高敏HCV-RNA检测在HCV抗体阴性人群中有较大意义,可用于义务献血人群丙型肝炎的筛查。
HCV-RNA与丙氨酸氨基转移酶(ALT)水平可能存在一定的相关性,有研究发现,血清ALT水平较高的患者,HCV-RNA相对较高,二者呈正相关(P<0.05)[10-12]。ALT主要存在于肝细胞中,可少量释放于血液中,一般不高于40 IU/L。病毒性肝炎的急性期或药物性肝炎导致肝细胞大量坏死时,ALT可大量释放入血液中,所以ALT是反映肝细胞损伤的重要标志物。有研究发现HCV-RNA高水平组[(1×106~1×108)copy/mL]谷氨酰转移酶(GGT)、天门冬氨酸氨基转移酶(AST)、ALT等肝功能指标水平均明显高于低水平组[(1×103~1×105)copy/mL]和中等水平组[(1×105~1×106)copy/mL][13]。也有学者认为,血清ALT水平与HCV-RNA存在相关关系,但ALT异常率与HCV-RNA之间无相关性[14]。HCV-RNA与ALT的关系将是本课题组未来的研究方向。
丙型肝炎HCV-RNA载量与多个血清学指标相关。据报道,HCV-RNA载量与T细胞亚群明显相关,与CD8+水平呈正相关,与CD4+、CD4+/CD8+水平呈负相关[15-16];HCV-RNA载量与血清白细胞介素(IL)-6、IL-10、IL-32及免疫球蛋白(Ig)G、IgA、IgM水平存在显著正相关[17];血常规中红细胞分布宽度/血小板比值(RPR)及血小板/淋巴细胞比值(PLR)与慢性丙型肝炎肝硬化代偿期的发生、纤维化进展程度相关[18-19];HCV-RNA水平与血小板计数(PLT)和血小板压积(PCT)呈负相关,与血小板分布宽度(PDW)、平均血小板体积(MPV)和血小板比值指数评分(APRI)呈现正相关[20];抗核抗体的产生与丙型肝炎肝功能指标和HCV-RNA载量有关[21]。以上研究提示HCV-RNA与血清学指标联合检测有助于判断丙型肝炎病情。
综上所述,HCV-RNA一定程度上可反映肝脏的损伤情况,高敏HCV-RNA的灵敏度明显高于普通HCV-RNA和HCV核心抗原检测,在丙型肝炎的临床诊断中具有十分重要的应用价值。

