拉曼光谱用于细菌快速药敏检测的研究进展
杨文旭,张心宇,刘 旭 综述,刘 禹 审校
哈尔滨医科大学附属第四医院检验科,黑龙江哈尔滨 150000
细菌感染每年导致全球800多万人死亡,占所有报告的与感染有关的死亡人数的50%以上[1]。在得到准确的药敏结果前,30%~50%的细菌感染患者接受的一线抗菌药物治疗无效,而且每延迟1 h给予正确的抗菌药物治疗,患者的存活率就会下降10%[2-4]。为了缩短药敏检测时间,各种快速药敏检测(RAST)方法被开发出来,如基于光学、电阻抗、微流控、质谱及拉曼光谱等原理的技术,这些技术主要是基于细菌生长或代谢表型的药敏检测。但由于不同细菌繁殖速度存在差异,基于细菌生长的技术可能受限,在抗菌药物作用下,细菌代谢表型的变化会更快。以细菌代谢表型检测为目的的基于拉曼光谱的药敏检测技术已被证明是有前途的RAST替代方案[5-7]。本文分析细菌耐药性的流行病学现状和RAST发展现状,进一步讨论基于细菌代谢表型检测的拉曼光谱在RAST方面的研究进展,为RAST的研究提供新思路。
1 RAST发展现状
1.1基于光学原理的RAST方法 ZHANG等[8]通过大体积溶液散射成像(LVSI)系统直接对临床尿液标本成像,并使用单细胞分裂跟踪方法分析尿液病原菌图像,在60 min内就得到了药敏结果,与金标准药敏结果完全一致。CANSIZOGLU等[9]开发了一种快速超灵敏探测器(RUSD)药敏检测平台,可以检测到极低细胞密度的细菌,在2~4 h内可测得常用抗菌药物对金黄色葡萄球菌、铜绿假单胞菌和大肠埃希菌的最低抑制浓度(MIC)。
1.2基于电阻抗原理的RAST方法 HANNAH等[10]用琼脂糖基水凝胶沉积物修饰丝网印刷电极,将敏感和耐药的金黄色葡萄球菌菌株置于含有抗菌药物的电极上,利用电化学阻抗谱(EIS)和差分脉冲伏安法(DPV)监测细菌生长并建立生长曲线,在45 min内即可区分敏感菌和耐药菌。PITRUZZELLO等[11]基于电阻抗可直接检测活细菌代谢的原理,研究抗菌药物处理下单个细菌的电反应,可在30~60 min内测得药敏结果。
1.3基于微流控技术的RAST方法 LI等[12]开发了一种在单细胞水平进行快速病原体分类和药敏试验的适应性微流控系统,通过结合可调微流体阀和实时光学检测,细菌被捕获并根据其物理特征进行分类,在单细胞水平监测它们在抗菌药物作用下的生长,最短30 min就可以确定细菌的耐药性。KANDAVALLI等[13]也提出了一种在微流控芯片中基于单细胞水平的药敏检测方法,该研究使用4种抗菌药物和7种细菌的混合标本进行检测,可在2 h内确定混合标本中各种细菌的药敏谱。
1.4其他RAST方法 ZHANG等[14]通过核苷酸胶体染料(SYBR Green Ⅰ)和碘化丙啶(PI)染色,在30~60 min内检测到100株肺炎克雷伯菌临床分离菌株对4种不同抗菌药物的耐药性。KLLAI等[15]提出了一种基于流式细胞术的RAST方法,在培养4 h后就能观察到细菌的生长,药敏结果的准确率在87%以上。LI等[16]采用基质辅助激光解吸/电离时间飞行质谱法(MALDI-TOF MS)检测了大肠埃希菌在有无黏菌素条件下的生长状况,大肠埃希菌与抗菌药物孵育2 h后,根据敏感株和耐药株之间的相对生长值测定了黏菌素的MIC。YANG等[17]以肺炎克雷伯菌和环丙沙星为细菌-抗生素模型,采用RNA测序技术确定了细菌暴露于抗菌药物后的RNA标志物用于药敏检测,肺炎克雷伯菌暴露于环丙沙星10 min就可检测到RNA标志物的变化,然后通过实时定量PCR在11株肺炎克雷伯菌分离株中进行验证,准确度良好。
2 拉曼光谱的基本原理及优势
拉曼光谱基于非弹性散射原理,是一种非侵入性光谱技术,可用于分子表征和成像,具有高空间分辨率。在生物学中,它特别适用于生物分子的鉴定和细胞的光谱特征分析[18]。传统的拉曼光谱信号强度低、抗干扰能力弱,检测时需要较长的积分时间[19-20],限制了其在RAST中的应用。
表面增强拉曼光谱(SERS)相比于自发拉曼光谱,有高灵敏度的优点[21],其基于离域电子集体相干振荡导致的激光与电磁场耦合,在金属纳米结构之间的间隙连接处或纳米间隙处通过局部表面等离子体共振产生“热点”,从而产生强大的局部电磁场聚焦增强[22],可以将吸附在金或银纳米粒子上分子的拉曼信号增强1010~1014倍[23]。
共聚焦拉曼光谱(CRS)能有效消除焦平面外的信号干扰,其空间分辨率、信噪比、精度等性能均高于普通拉曼光谱,它与显微技术联用,结合可移动的扫描平台,可在三维空间中精确定位样品和成像[24]。受激拉曼光谱(SRS)是一种无损的、无标记的振动光谱学方法,通过相干激发分子键振动并保留光谱指纹,克服了传统的自发拉曼散射固有缺点,可实现高速、高化学特异检测[25-26]。此外,SRS成像比传统自发拉曼成像速度快1 000 倍以上,且不受样品自发荧光干扰[27]。
3 拉曼光谱技术在RAST领域中的应用
3.1基于单细菌分子表型的RAST 基于单细菌分子表型的RAST可以省去细菌增殖所需时间。目前,基于单细胞水平的快速分子表型的药敏检测,主要依赖于活细菌对重水(D2O)的代谢摄入,生成细菌内部的生物分子,比如脂质和蛋白质等,通过检测C-D峰的强度可以实现抗菌药物MIC的快速检测。
C-D峰位于拉曼光谱的2 040~2 300 cm-1波段,该波段通常在未进行D2O标记的细菌中无可检测到的拉曼峰,具有高特异性。见图1[28]。此外,在含有D2O的培养基中生长的细菌C-D峰的强度变化与活细菌的代谢活性呈正相关[5,7,29-31]。
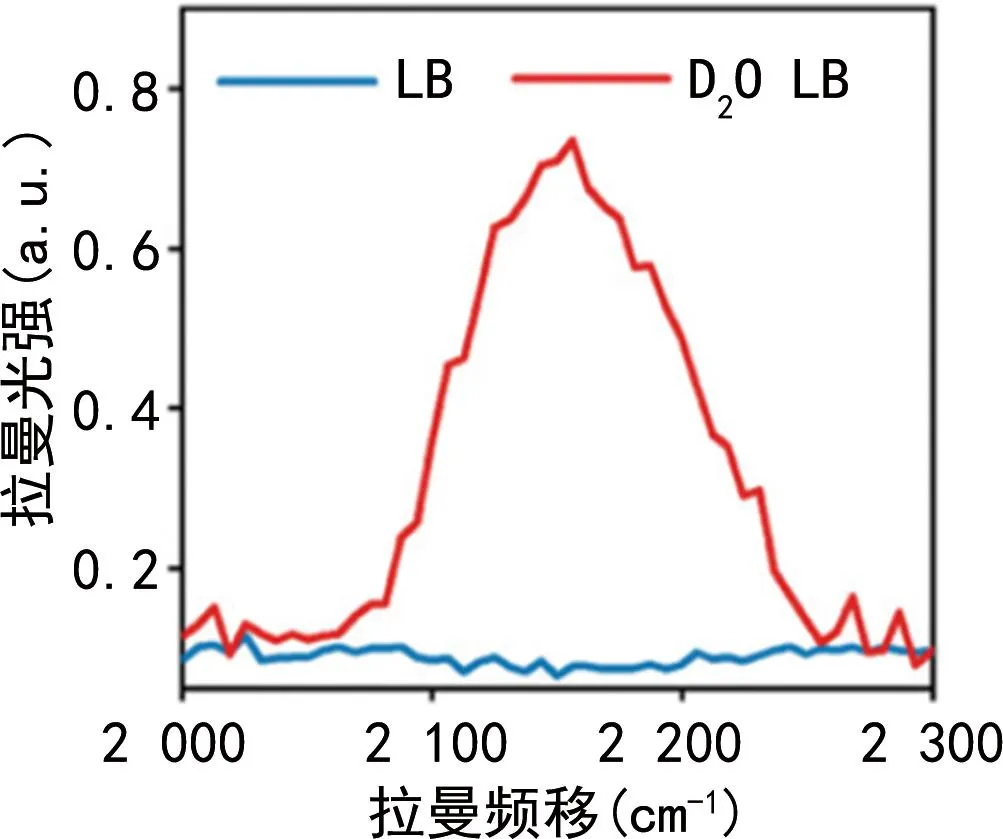
图1 铜绿假单胞菌在正常和含D2O的培养基中培养
任何活细菌的代谢都需要水,因此,在含有D2O的培养基中生长的活细菌都会生成代谢表征的C-D峰,这决定了C-D峰可作为分辨单细菌细胞代谢活动的通用生物标志物。在基于培养的药敏检测方法中,细菌增殖一代的时间比开始出现代谢表征的时间长,而且不同种细菌的生长时间差异也会使药敏时间难以缩短,因此,基于C-D峰的单细胞拉曼药敏检测方法在RAST领域中有着极好的应用前景。
在目前的研究中,运用单细胞拉曼技术进行MIC的快速测定大致分为3步:(1)细菌在含有不同浓度梯度抗菌药物的培养基中先孵育1~2 h;(2)按体积比向培养基中加入D2O(目前报道30%~100% D2O浓度),同时保证培养基浓度和药物浓度与初始一致,继续孵育30 min左右;(3)根据耐药组和敏感组的相对C-D比,即C-D/(C-H+C-D)来设定cut off值以测定MIC。
3.1.1运用CRS技术进行RAST TAO等[32]证明了基于D2O活菌代谢标记的单细胞拉曼光谱可以检测细菌对抗菌药物的反应,2 040~2 300 cm-1波段的C-D拉曼带可作为单细菌代谢活性的通用生物标志物。YANG等[5]开发了适用于临床尿液标本直接药敏检测的单细胞拉曼光谱技术,基于活菌的D2O代谢掺入,通过相对C-D比设置S/R截止值用于药敏结果判读,达到了从接收尿液标本到结果读取总检测时间缩短至2.5 h,且准确度高的效果。YUAN等[33]将31株伊丽莎白菌分别与8种不同浓度抗菌药物和40% D2O共孵育,4 h即可测定抗菌药物的MIC,除头孢吡肟外,其他7种抗菌药物的单细胞拉曼药敏结果与金标准药敏结果一致率为94%。在该研究中,头孢吡肟所测药敏结果与金标准结果不一致可能是因为不生长但代谢活跃的细菌存在,这种特性可能会影响药敏结果的准确性,也会成为细菌感染治疗后复发的根源[33]。因此,临床可以通过单细胞拉曼药敏检测技术来评估抗菌药物疗效,更好地指导临床给药。
3.1.2运用SRS技术进行RAST 快速准确的药敏试验对于多药耐药菌的安全、有效和环境友好型治疗至关重要[34]。ZHANG等[20]利用飞秒受激拉曼散射成像对经过70% D2O培养基和不同浓度抗菌药物孵育后的细菌进行单细胞成像,在不到2.5 h测定了14种抗菌药物对临床常见8种病原菌的MIC值,与金标准药敏结果的符合率为94.6%。此外,该研究制备了模拟尿液和血液标本,通过直接过滤的方法分离细菌进行药敏检测,准确度良好。此外,ZHANG等[28]在单细胞水平上,通过SRS成像监测抗菌药物作用下的D2O活菌代谢掺入,在2.5 h内测得抗菌药物的单细胞代谢失活浓度。该方法还适用于尿液或血液等复杂生物标本的直接RAST。
3.2基于多细菌分子表型的RAST 虽然基于单细菌分子表型的RAST方法具有一定优势,但由于细菌是活体,同种菌的不同个体状态在不同时间或空间可能不同,这会影响药敏结果的准确性。因此,有研究者开发了基于多细胞水平分子表型检测的RAST方法,这种方法主要依赖于SERS技术。CHANG等[35]开发了集成膜过滤和SERS活性衬底的微流控系统,微通道内腔室的膜可过滤和浓集细菌,注射泵将培养基、抗菌药物和洗涤液等注入其中,在过滤室中培养细菌,细菌释放的代谢物被输送到附着SERS衬底的微通道中进行检测,药敏检测时间明显缩短。FU等[36]筛得一种带负电荷的适配子,与细菌特异性结合,利用粗糙金属纳米颗粒的信号放大作用,测定了大肠埃希菌O157∶H7和金黄色葡萄球菌在不同浓度抗菌药物作用下的拉曼光谱,首次发现735 cm-1可作为标志峰位置,基于此峰强度的变化,在1 h内可测得药物的MIC。HILTON等[37]将纳米银颗粒印在SERS纸传感器上,利用便携式拉曼光谱仪对不同β-内酰胺类抗菌药物耐药的大肠埃希菌进行检测,在2.5 h内即可完成大肠埃希菌的耐药分析。新型RAST技术汇总见表1。

表1 新型RAST技术汇总
4 结论与展望
基于细菌生长和代谢表型的RAST技术相较于传统药敏方法的检测时间明显缩短,其中,运用拉曼光谱技术在细菌代谢表型水平进行RAST具有很好的应用前景。
虽然微流控、电阻抗和SYBR Green Ⅰ活菌染色等技术平均药敏检测时间为1 h左右,但适用的细菌和抗菌药物都比较局限,也无法识别菌群中的异耐药菌,而且检测结果的准确性缺乏大标本量的验证。此外,这些基于生长的药敏检测对细菌的初始接种量有要求,而且细菌在刚接种到培养基中会经历1~3 h的迟缓期,很难检测到数量上的微弱变化,还易受到细菌本身状态和环境等因素的影响。
基于RNA测序的药敏检测目前只对环丙沙星作用于大肠埃希菌有研究,虽然其属于细菌代谢表型检测的RAST,但操作复杂,初始菌量要求高,难以满足临床要求。基于单细菌和多细菌代谢表型的RAST技术准确度高、灵敏度高,但仍有许多不足之处:(1)缺乏大规模临床分离株和抗菌药物的验证;(2)缺乏标准化的检测流程、不能做质控和室间比对等;(3)细菌个体的异质性会影响单细菌药敏检测的准确性;(4)对于SERS的药敏检测,增强基底合成复杂,容易受到残留培养基和其他成分的干扰,可重复性低等;(5)适用的标本类型局限于纯培养菌落、尿液和全血标本,而对于复杂的痰液、粪便等标本的直接药敏检测鲜有研究。
未来还需要对基于细菌生长和代谢表型检测的RAST技术进行大量的临床分离株和抗菌药物验证,并对检测结果的准确性进行评估;其次是标本处理流程的标准化,做好质控和室间比对,提高检测的可重复性和临床适用性;进行拉曼光谱药敏检测时要引入合适的内标,消除复杂因素对检测的影响,也可以将拉曼光谱与电阻抗、微流控、化学染色等技术相结合,开发更快、更准确、重复性更好的RAST方法,实现在复杂标本中直接进行细菌快速鉴定及药敏检测。

