质量监测指标在血站实验室ABO血型检测中的应用
贾俊杰,刘正敏,王 瑞,胡京辉,甄 伟
北京市红十字血液中心,北京 100088
依照血站相关行业标准和技术要求,实验室必须对献血者血液标本进行ABO和RhD血型检测,且要求血型定型试验结果正确。检测能力和检测过程的稳定性可影响并决定血型结果的准确性。《血站实验室质量管理规范》[1]要求实验室“必须建立和持续改进实验室质量体系,并负责组织实施和严格监控”;《CSBT004-2019血站血液检测实验室质量监测指标》[2]提出实验室通过对质量监测指标的有效监控,可评估检测过程的稳定性;可发现检测过程中潜在的风险因素,以便及时采取适当的纠正措施;可监控纠正、验证和改进措施的有效性。本研究回顾性分析连续10年ABO血型检测质量监测指标,旨在评价血型检测过程的稳定性和检测能力,为血型检测的质量改进提供方向和数据支持。
1 材料与方法
1.1标本来源 本中心2012—2021年2 733 642例献血者标本。
1.2仪器与试剂 使用主要仪器包括Beckman PK7300全自动血型分析仪、Miele清洗消毒机、梯形微孔板;使用主要试剂包括抗-A/抗-B标准抗血清(上海血液生物医药有限责任公司)、ABO试剂标准红细胞(上海血液生物医药有限责任公司)。
1.3方法 收集2012—2021年ABO血型检测过程中总标本数、错型数、标本血型与血液制剂血型不一致数、送检血型血清学实验室标本数及回馈结果。统计和分析4项质量监测指标,包括特殊血型检出率(特殊血型检出标本数/血型检测标本数)、标本血型与血液制剂血型不一致率(标本血型与血液制剂血型不一致标本数/血型检测标本数)、采血部门血型检测错误率(实验室确认采血部门血型检测错误标本数/血型检测标本数)、送检血型与确认结果符合率(确认为非正常ABO血型的标本数/实验室送检血型标本总数),对ABO血型检测过程进行分析与评价。
1.4统计学处理 采用SPSS19.0统计软件进行数据处理及统计学分析。计数资料以例数或百分率表示,组间比较采用χ2检验,趋势性分析采用χ2趋势分析。以P<0.05为差异有统计学意义。
2 结 果
2.1ABO血型系统特殊血型检出情况 2012—2021年特殊血型检出率(中位数)为0.030%,各年度特殊血型检出率比较,差异有统计学意义(χ2=75.612,P<0.01),其中2018年特殊血型检出率最高,2013年最低。整体上看,连续10年特殊血型检出率呈上升趋势(χ2=18.935,P<0.01),进一步分析发现2012—2016年位于中位数之下,2017—2021年位于中位数之上,2017—2021年呈下降趋势(χ2=8.606,P<0.01)。见图1。
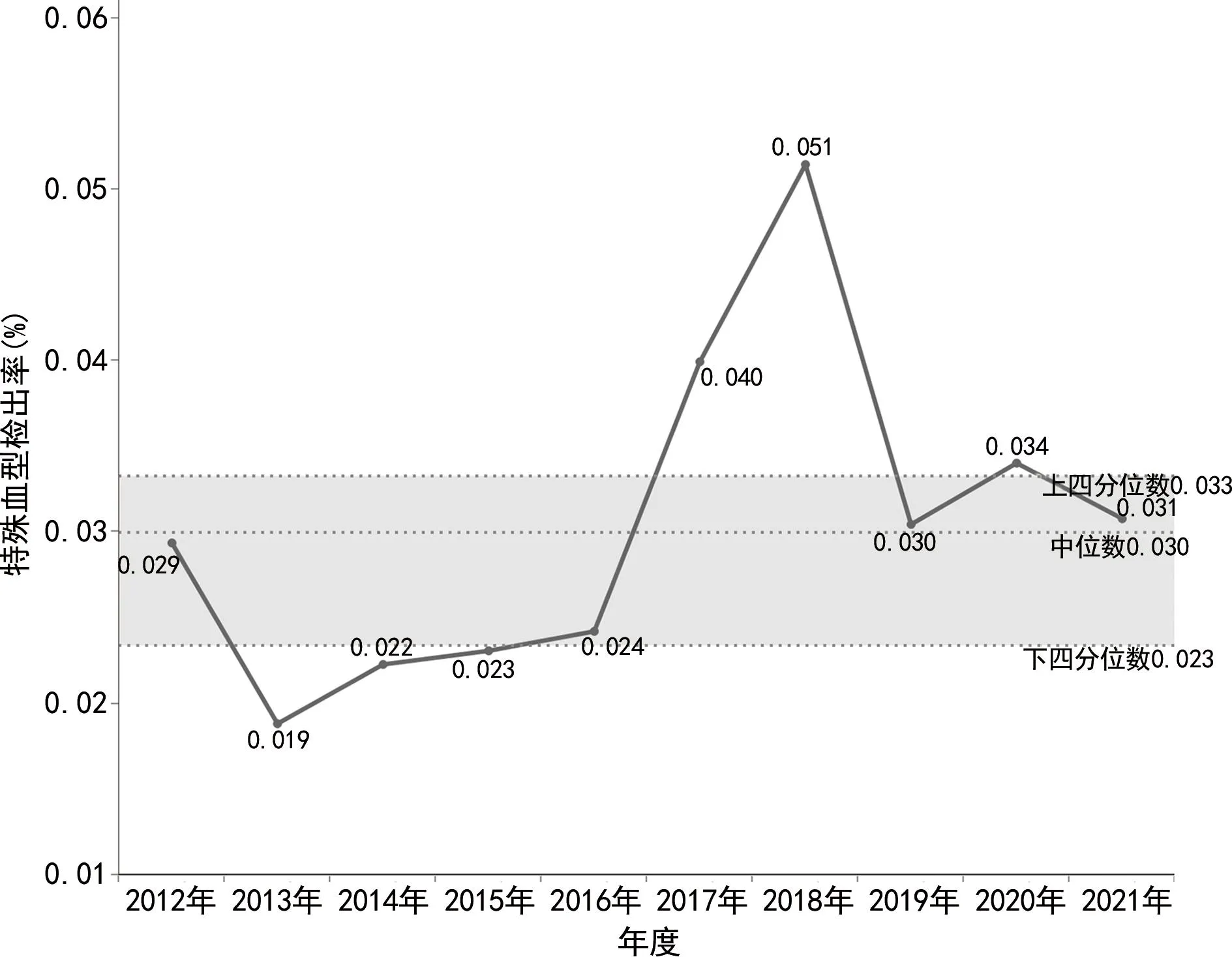
图1 2012—2021年特殊血型检出率
2.2采血环节ABO血型结果情况
2.2.1标本血型与血液制剂血型不一致率 2012—2021年标本血型与血液制剂血型不一致率为0.04,各年度标本血型与血液制剂血型不一致率比较,差异有统计学意义(χ2=15.787,P<0.01),呈线性递减趋势(χ2=11.178,P<0.01)。见图2。2012—2015年标本血型与血液制剂血型不一致率σ值均为优秀(5.74~5.98),见表1;2016—2021年连续6年未出现标本血型与血液制剂血型不一致情况,发生率为0。
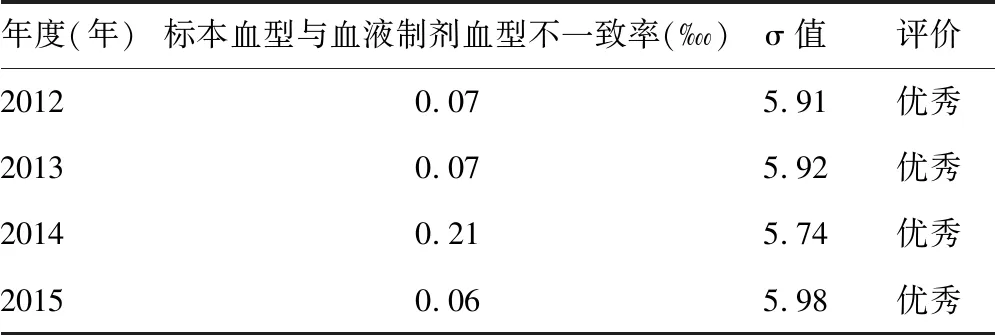
表1 标本血型与血液制剂血型不一致率σ值水平
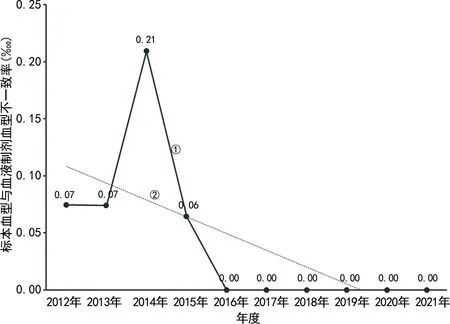
注:①标本血型与血液制剂血型不一致率();②线性(标本血型与血液制剂血型不一致率()。
2.2.2采血部门血型检测错误率 2012—2021年采血部门血型检测错误率为0.55,各年度采血部门血型检测错误率比较,差异有统计学意义(χ2=18.247,P<0.05),呈线性递减趋势(χ2=8.143,P<0.01)。见图3。
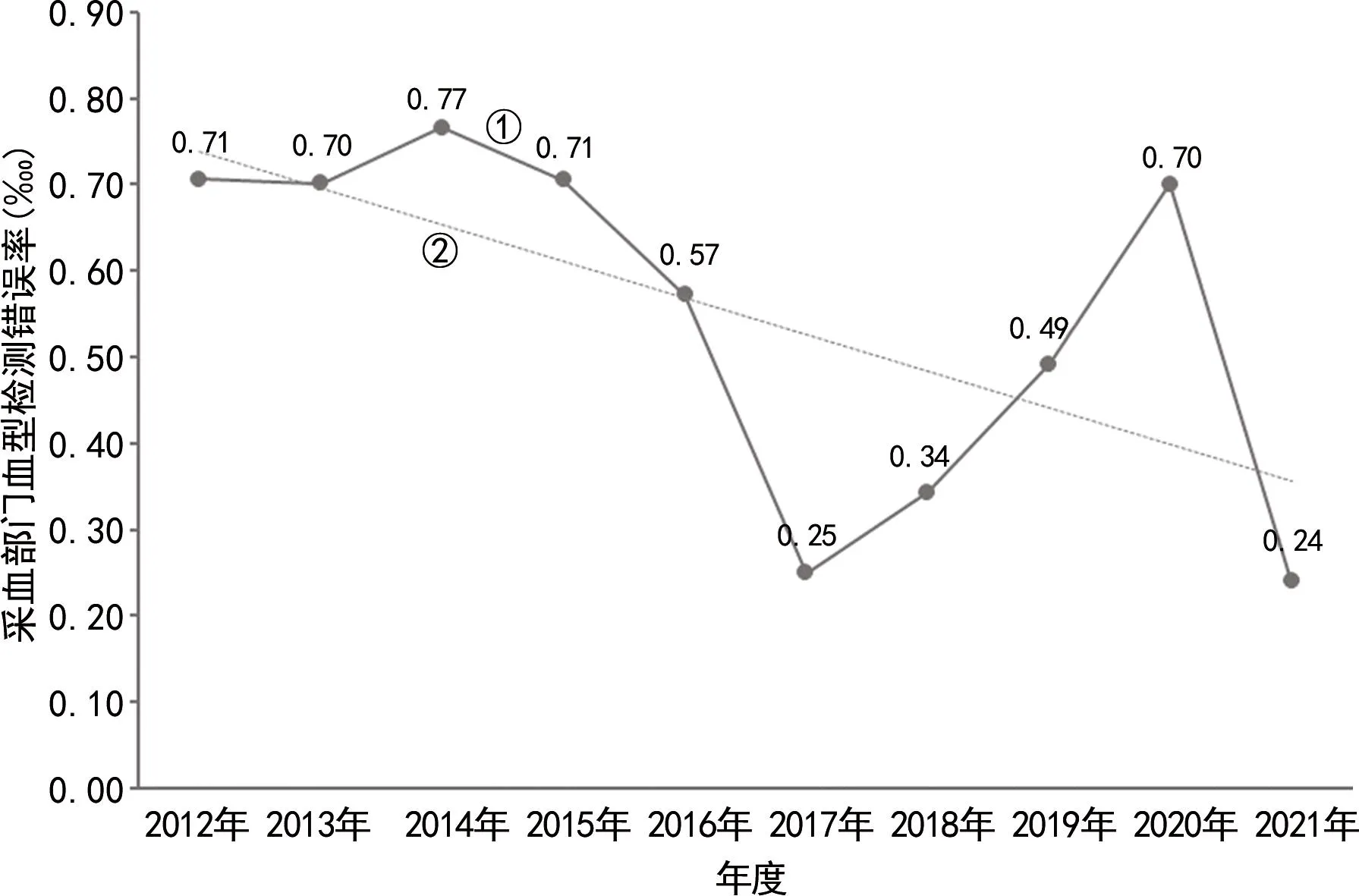
注:①采血部门血型检测错误率();②线性(采血部门血型检测错误率()。
2.3ABO送检血型与确认结果符合率 2012—2021年送检血型与确认结果符合率为78.24%,各年度送检血型与确认结果符合率比较,差异无统计学意义(χ2=11.993,P>0.05),无明显趋势变化(χ2=0.879,P>0.05)。见表2、图4。
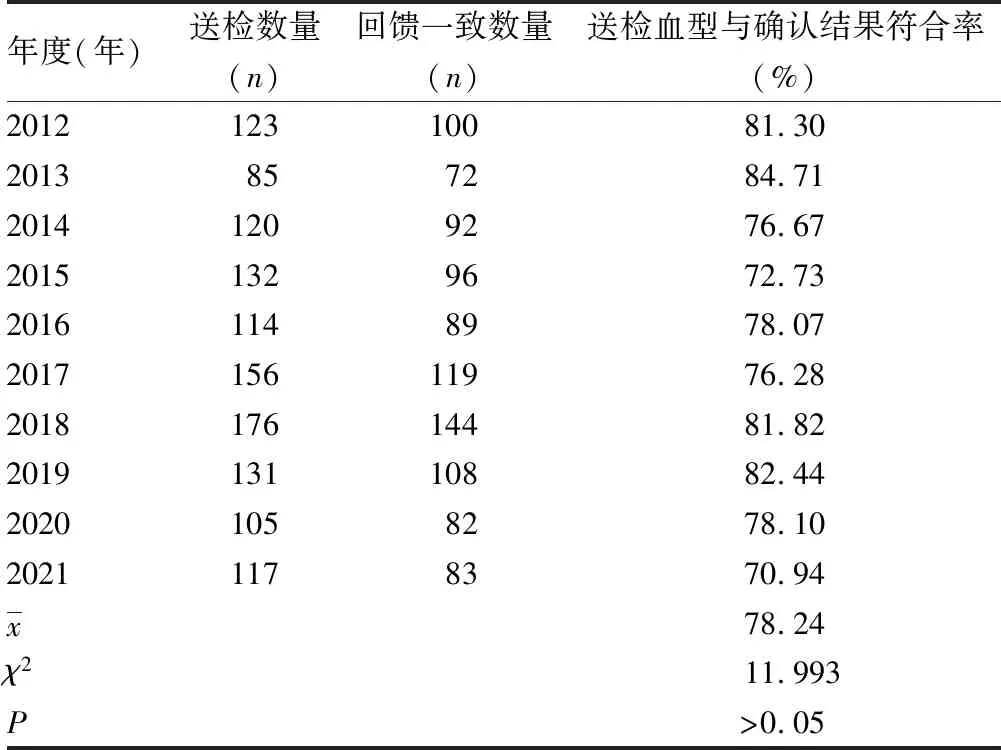
表2 2012—2021年送检血型与确认结果符合率
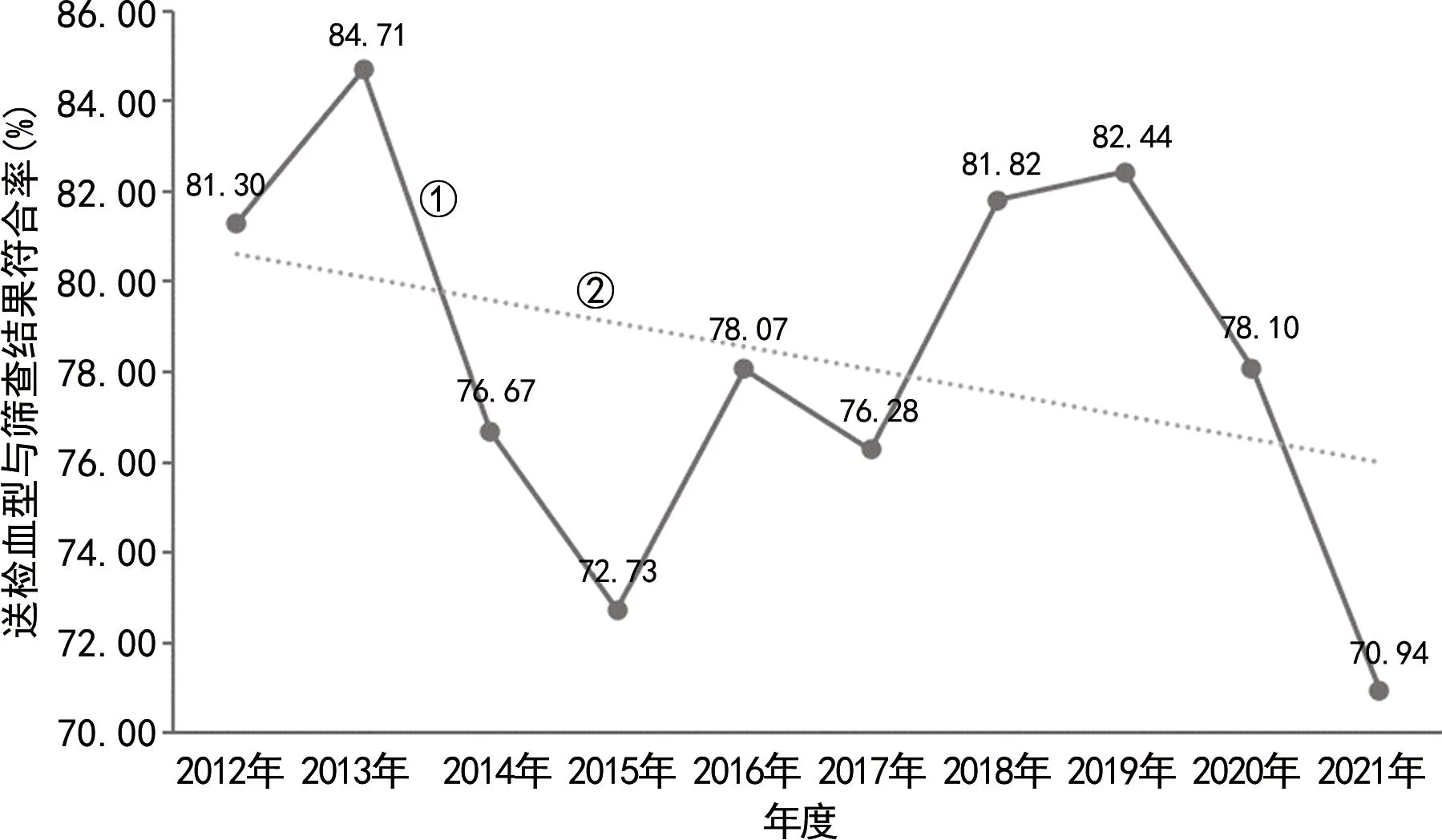
注:①送检血型与筛查结果符合率(%);②线性(送检血型与筛查结果符合率(%)。
3 讨 论
ABO血型系统在临床输血中具有重要意义,血站实验室出具正确的ABO血型检测报告是确保临床输血安全的重要前提[3-5],血型错误可能会导致致命性输血反应[6-8]。因此,对血型检测建立质量监测指标是质量管理的重要手段,使用统计过程控制(SPC)技术对质量监测指标进行趋势性分析,可监控检测过程的稳定性,预测趋势性,采取适宜的预防及纠正措施,确保血液检测过程的有效性。
本研究采用4项质量监测指标对血站实验室ABO血型检测过程和结果进行客观评价。特殊血型检出率、标本血型与血液制剂血型不一致率、采血部门血型检测错误率3项质量监测指标来源《CSBT004-2019血站血液检测实验室质量监测指标》[2],结合本实验室具体业务过程和管理情况增加送检血型与确认结果符合率指标。
特殊血型检出率既可以反映实验室血型检测的总体稳定性,又可以间接地反映献血者的ABO特殊血型情况。尽管每天实验室所检测的标本来自不同时间、不同献血者和(或)不同地点,但在一定时期内血站实验室特殊血型检出率应处于相对稳定状态,一旦发现该指标出现明显波动,应追查原因,确定是检测过程异常还是特殊血型献血者增多[2]。本中心2012-2021年10年的特殊血型检出率中位数为0.030%,与长沙地区报道的0.026%[9]基本一致,低于广州地区报道0.058%[10],高于洛阳地区报道的0.021%[11],存在地区差异,也可能与各地区各实验室采用的检测试剂或方法不同而导致结果存在差异有关。实验室ABO血型检测过程出现正反定型不一致、O细胞凝集等异常情况,单位内部血型实验室进一步采用其他方法检测后,确定为ABO 亚型、意外抗体、抗体减弱、自身抗体干扰、缗钱状凝集等特殊血型。本研究结果显示2012—2021年特殊血型检出率比较,差异有统计学意义(P<0.05),且总体呈上升趋势(P<0.05)。进一步分析发现2018年的检出率最高,重点分析2017-2021年的数据,显示该指标呈下降趋势(P<0.01),如剔除2018年异常值,该指标呈平稳状态(P>0.05);分析出现该异常值可能与当年献血者自身情况相关,且为一过性、未再次出现。因此,应持续监控该质量监测指标。
标本血型与血液制剂血型不一致率与标本和血液制剂同源性有关,可反映检测前过程标本留取的正确性[2]。《血站技术操作规程(2012版)》[12]针对血液采集、标本留取、血袋及血液标本标识等操作提出了具体的要求。对标本血型与血液制剂血型不一致情况进行分析有助于实验室发现检测前过程标本留取是否正确。但该指标仍有局限性,仅在标本血型与血液制剂血型不一致时方可发现检测前过程标本留取过程的问题,无法甄别同一种血型不同献血者标本留取错误。因此,对采血工作人员进行定期专业的培训及持续教育是杜绝此类问题的关键举措。本研究结果显示2012—2021年标本血型与血液制剂血型不一致率为0.04,仅在2012—2015年出现标本血型与血液制剂血型不一致情况,进一步分析原因为在同一时段献血者较为集中时,新入职采血护士操作不熟练、未按要求“一人一针”等造成试管或血袋标签贴错、血液标本留错等情况。既往其他研究提示新上岗采血工作人员刚刚接触临床,对标本采集程序不熟悉,导致发生差错的概率增加,从而引起标本错误(WBIT)事件高发[13-15]。通过定期加强质量控制和人员培训并持续改进,2016—2021年连续6年未再发生标本血型与血液制剂血型不一致情况。为进一步分析2012—2015年该指标情况,本研究采用六西格玛质量管理方式进行评价,结果显示σ值均大于5.5,已达到六西格玛水平,意味着该指标2012—2015年发生率为低频次,检测前过程标本留取过程处于优秀水平,且后续6年发生率为0,说明过程管理持续有效。
另一个纠正采血环节血型结果的指标为采血部门血型检测错误率,该指标与标本血型检测结果有关,反映了在血液和标本同源性一致的情况下,采血部门血型检测结果的正确性[2]。本研究结果显示2012—2021年采血部门血型检测错误率为0.55,相关数据远低于上海[16](1.72)、郑州[17](16.48)、广州[10](9.40)地区的报道。进一步分析发现2012—2021年采血部门血型检测错误率呈递减的趋势,意味着总体控制良好、过程改进有效。
在实际工作中,ABO血型检测结果涉及多个环节,包括参考采血部门结果,正反定型是否一致,O细胞对照是否正常,信息系统比对(与采血部门结果比对、与献血者既往血型比对)等,确保ABO结果的正确性。检测人员发现正反定型不一致、O细胞对照异常等情况,首先查找检测过程是否有异常情况,并使用纸片法重复检测的方式以进行综合判断,核实为ABO血型结果异常时,按要求送检至单位内部血型血清学实验室进一步鉴定确认。针对上述过程,本研究采用送检血型与确认结果符合率进行评价。鉴于ABO筛查检测设备和试剂的局限性,会有少量正常ABO血型无法判定而需要送检的情况出现[18-20],送检血型与确认结果符合率旨在评价ABO检测过程的稳定性。本研究结果显示2012—2021年送检血型与确认结果符合率为78.24%,各年度该指标比较,差异无统计学意义(P>0.05),检测过程稳定。
综上所述,血站实验室应当依据自身实际情况建立适宜的质量监测指标体系,收集血型检测过程中相关的数据并进行统计、分析,对ABO血型检测过程进行有效量化监控和趋势性分析,明确持续改进方向,确保血液质量和安全。

