酿酒酵母和异常汉逊酵母混合发酵黄酒工艺研究
郑超群,陈 晨,蒋予箭,张 蕾,谢广发
(1 浙江工商大学食品与生物工程学院 杭州310018 2 浙江树人学院生物与环境工程学院 浙江省污染暴露与健康干预重点实验室 杭州 310015)
黄酒是中国最古老的酿造酒,与葡萄酒、啤酒共同享有世界三大古酒的美誉[1]。黄酒是以稻米、黍米、小米等为主要原料,利用麦曲和部分酶制剂、酵母等糖化发酵剂酿造而成的发酵酒[2-4]。黄酒的酒精度低,一般含量为14% vol~20% vol,20 种氨基酸成分齐全,营养价值丰富,符合新时代消费者对食品安全、健康、营养的需求。然而,近年来黄酒的发展不尽如人意。据不完全统计,目前我国白酒的人均消费量为9 L 左右,啤酒的人均消费量为38 L 左右,而黄酒的人均消费量不足2 L[5],黄酒市场仍有增长的空间,黄酒生产工艺与装备的更新、新产品开发的工作还任重道远。
酿酒酵母(S.cerevisiae)是黄酒酿造过程中的优势菌种,其特点是发酵速度快,酒精转化率高,发酵过程易于控制,对其它杂菌的抑制作用强,然而存在香气成分不丰富等缺陷[6]。异常汉逊酵母(H.anomala)是一类与酒精发酵相关的天然非酿酒酵母,其代谢能力差,产酒精能力较低,通常不能独自完成酒精发酵[7]。研究发现,非酿酒酵母能够通过自身代谢活动生成醇或酯,或者通过胞外酶的释放产生包括乙酯类、高级醇、甘油、挥发性酚类、芳香酮等一系列对黄酒质量有益的香气物质,增加酒类香气的复杂度和浓郁度[8-10]。Rojas 等[11]发现,有孢汉逊酵母(Hanseniaspora guilliermondii)、异常毕赤酵母(Pichia.anomala)与酿酒酵母的混合发酵获得的乙酸酯类化合物比单一酿酒酵母发酵产品有明显提高。Moreira 等[12]提出,将葡萄汁有孢汉逊酵母与酿酒酵母进行混合模拟自然发酵,结果酯类含量增加,提高了香气复杂度。李婷[13]从川南白酒窖池中分离出1 株高产酯的非酿酒酵母,发酵毕赤酵母(Pichia fermentans)在40 ℃、pH 5 时,最大酶活力可达12.68 U/g,在提前0~96 h 接种处理的混菌发酵葡萄酒中检出35 种香气物质,总含量达70~194 mg/L。夏鸿川等[14]通过酿酒酵母和非酿酒酵母混合发酵试验,发现混菌发酵处理提高了葡萄酒甘油产量0.38~1.11 g/L,同时降低了酒精含量0.33% vol~1.9%vol。Anfang 等[15]发现,克鲁维毕赤酵母(Pichia kluyveri)与酿酒酵母按照1 ∶1 接种混合发酵时,葡萄酒中硫醇类香气物质的含量有所提高;按9∶1 进行混菌发酵时,葡萄酒中乙酸-3-巯基己醇的浓度增加。
本研究以酿酒酵母和异常汉逊酵母为发酵菌种,在比较2 种酵母的发酵特性以及对黄酒品质影响的基础上,进行混菌发酵试验。混菌发酵试验包括同时混合发酵(CH)和顺序混合发酵(SH)这两种发酵途径。在发酵过程中,测定酵母菌数、酒精度、还原糖、挥发酯等理化指标。在发酵结束后,对混菌发酵黄酒样品进行感官评定。对筛选出的混合发酵路线,采用响应面分析法进行试验设计与发酵工艺条件优化。
1 材料与方法
1.1 材料与试剂
糯米:北纯糯米;糖化酶(酶活力1×105U/g,食品级)、液化酶(酶活力2×104U/g,食品级),河南万邦实业有限公司;酿酒酵母,安琪黄酒专用活性干酵母;异常汉逊酵母1298,中国工业微生物菌种保藏管理中心(CICC);麦曲,绍兴古越龙山黄酒工程技术研究中心有限公司。
葡萄糖、氢氧化钠、硫酸铜、亚铁氰化钾、酒石酸钾钠、亚甲基蓝、邻苯二甲酸氢钾、无水乙醇、酚酞、甲基红均为分析纯级;盐酸、硫酸、乳酸,国药集团化学试剂有限公司;酵母增殖培养基(YPD)、孟加拉红培养基,杭州微生物有限公司。
1.2 仪器与设备
HH-6 数显恒温水浴锅,常州国华电器有限公司;XSP-4C 显微镜,东莞市永先电子仪器有限公司;BXM-30R 立式压力蒸汽灭菌器,上海博讯实业有限公司;NSKY-200B 恒温培养振荡器,上海苏坤实业有限公司;3K30 台式高速冷冻离心机,SIGAM Laboratory Centrifuges;Milli-Q 超纯水处理系统,Millipore。
1.3 试验方法
1.3.1 发酵试验流程 见图1。

图1 发酵试验流程图Fig.1 Flow chart of fermentation experiment
1.3.2 糖化液的制备 将糯米打碎成糯米粉,粉碎后过60 目筛,备用,称取糯米粉300 g,蒸馏水750 g(料水比为1∶2.5)加入到1 L 锥形瓶,混合均匀后,加入2 g 液化酶,在75 ℃水浴条件下,液化1 h,调节pH 4.5~4.8,加入1.5 g 糖化酶和30 g 麦曲(10%添加量),在65 ℃水浴锅中糖化3 h,纱布过滤后,取上清液,正常情况糖度能达到20°Bx~25°Bx,95 ℃灭菌20 min,备用[16-17]。
1.3.3 酵母的扩培与计数
1.3.3.1 酯香酵母制备 挑取异常汉逊酵母1298斜面菌种,转入YPD 液体培养基,于28 ℃,180 r/min 条件下培养18~20 h 至对数生长期,保证酯香酵母的工作浓度达到1×107个/mL 以上,低温离心10 min 后(4 ℃,4 000 r/min)收集酵母菌体,经无菌水洗涤后,采用血球计数板进行酵母计数,在主发酵阶段前,按接种比例接入纯种酯香酵母发酵剂[18]。
1.3.3.2 酿酒酵母制备 称取10 g 干酵母,加入150 mL 2%葡萄糖溶液,38 ℃水浴活化20 min,低温离心(4 ℃,4 000 r/min)10 min 后,收集菌体,经无菌水洗涤,采用血球计数板进行酵母计数,按比例接种到糖化酵液中[19]。
发酵过程中采用平板计数法进行计数,培养基为孟加拉红培养基[20-21]。
1.3.4 发酵条件 初始糖度18°Bx,温度28 ℃,发酵20 d(主发酵5 d+后发酵15 d),发酵体量150 mL,其中酿酒酵母和异常汉逊酵母的的接种量都为1×107个/mL[22-23]。
1.3.5 发酵试验设计 试验组:接种酿酒酵母S.cere;接种异常汉逊酵母Han;同时接种混合发酵CH;顺序接种混合发酵(接种汉逊酵母48 h 后接种酿酒酵母)SH[24]。
其中,酿酒酵母和异常汉逊酵母的接种量都为1×107个/mL,同时接种是指同时接入酿酒酵母和异常汉逊酵母同时进行酒精发酵,顺序接种是指先接入异常汉逊酵母,48 h 后再接入酿酒酵母进行酒精发酵。
1.3.6 黄酒取样检测 主发酵第1,2,4 天,后发酵第7,12,16,20 天,分别取样125 mL 滤纸过滤,4 ℃冰箱保存,备用。测定还原糖、酒精度、总酸、挥发酯、酵母菌数等理化指标。
1.3.7 理化指标的测定 酒精度、总酸的测定参照GB/T 13662-2018[25];还原糖的测定参照GB 5009.7-2016[26]中的亚铁氰化钾滴定法;挥发酯的测定参考国家标准GB/T 17946[27]中的回流皂化法。酵母菌数的测定:血球计数法[28]、平板计数法参考GB/T 4789.2-2016[29]。
1.4 工艺优化设计
1.4.1 单因素实验设计 按照工艺路线进行发酵试验,并对以下单因素进行相关参数替换。初始还原糖含量:250,220,190,160,130 g/L,可使用葡萄糖调节;初始pH 值:3.5,4.0,4.5,5.0,5.5,参考文献[30]使用柠檬酸、小苏打调节;主发酵温度:26,28,30,32,34 ℃;接种量(酯香酵母∶酿酒酵母为1 ∶1):0.5×107,1.0×107,1.5×107,2.0×107,2.5×107个/mL。每个发酵组做3 次平行,取平均值。以发酵结束后的挥发酯、酒精度为评价指标。
1.4.2 响应面设计 在单因素实验的基础上,选择对黄酒顺序发酵挥发酯含量影响较大的3 个因素(包括初始pH、酵母接种量、主发酵温度)根据Box-Benhnken 中心组合试验设计原理,采用3 因素3 水平1 响应值响应面分析法进行设计。
选定初始pH、酵母接种量、主发酵温度范围分别为pH 3.5~4.9,0.5~1.5×107个/mL,30~34 ℃,响应面的分析因素及水平设计如表1 所示。
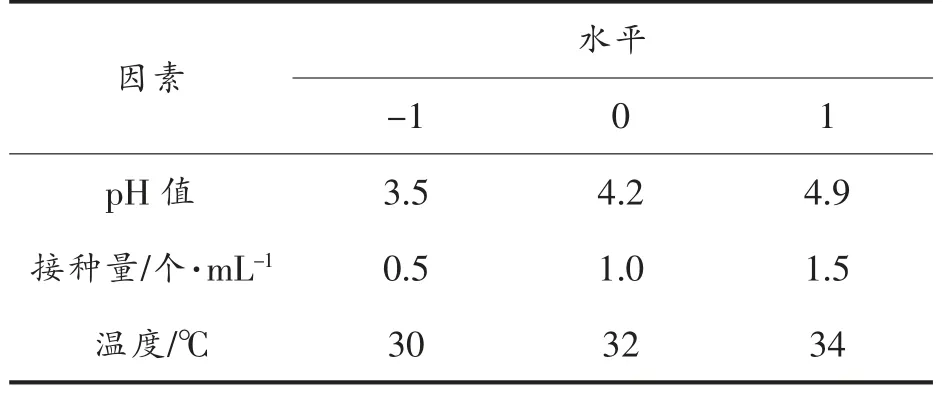
表1 响应面分析因素与水平Table 1 Response surface analysis factors and levels
1.5 感官评定
9 名感官评定人员先经过3 轮品评专业培训。使用计分评价法对酒样进行感官评价,以筛选出感官品质最优的黄酒样品。本次感官评价参考黄酒国家标准(GB/T 13662-2018)[25],制定发酵酒的感官评分表(见表2),满分是100 分,其中色泽10 分,香气25 分,口味50 分,风格15 分。根据品评酒样的色泽、香气、味道、风格的优劣差异的评语情况,依规定项目的分数进行打分。

表2 黄酒感官评分表Table 2 Yellow rice wine sensory score
1.6 数据处理
数据采用Excel,Origin 9.0,Design Expert 8.0.6 软件处理、绘图。
2 结果与分析
2.1 两株酵母发酵特性比较
2.1.1 两株酵母单独发酵过程理化指标变化 酿酒酵母和异常汉逊酵母发酵过程中理化指标的变化如图2~4 所示,对发酵结束后的理化指标进行统计,结果见表3。

表3 发酵结束后各理化指标Table 3 Physical and chemical indicators after fermentation

图2 酵母单独发酵过程还原糖(a)和酒精度(b)的变化Fig.2 Changes in reducing sugar(a)and alcohol content(b)during yeast fermentation alone
图2 和图3 分别为酿酒酵母和异常汉逊酵母发酵过程中理化指标的变化,包括还原糖、酒精度、总酸、挥发酯,图4 为酵母数的变化。由图2 可以看出,酿酒酵母发酵的还原糖含量急剧下降,仅2 d 下降至7.0 g/L,同时酒精度含量达到9.3% vol,第7 天酒精度达到最高值10.7% vol,之后缓慢下降。异常汉逊酵母的还原糖含量在整个发酵过程中呈逐步下降的趋势,发酵结束后,还原糖含量与酿酒酵母差异不大,说明异常汉逊酵母的还原糖代谢能力不低于酿酒酵母。同时,发酵过程中异常汉逊酵母的酒精度含量始终低于酿酒酵母,说明异常汉逊酵母的酒精转化能力较差。由图3 可知,在发酵过程中,异常汉逊酵母的产酸能力明显强于酿酒酵母,在发酵第16 天达到最大值5.6 g/L,之后出现下降,推测发酵后期有机酸会与醇类物质发生酯化反应,生成乙酯类化合物,导致总酸含量下降,同时,可以看出异常汉逊酵母的挥发酯含量一直在增加,第16 天达到最大值2.67 g/L,而酿酒酵母的挥发酯含量增加缓慢,变化不大,发酵结束后,酿酒酵母和异常汉逊酵母的挥发酯含量分别为0.53 g/L 和2.41 g/L,异常汉逊酵母的挥发酯含量是酿酒酵母的4.5 倍。说明异常汉逊酵母的产酯能力明显强于酿酒酵母的产酯能力。由图4可以看出,酿酒酵母前期的增殖速度较快,第2 天达到最大值1.61×108CFU/mL,之后呈下降趋势;异常汉逊酵母在发酵前4 天增殖速度最快,在第12 天达到最大值1.15×108CFU/mL 时进入平衡期,后期糖类等碳源物质逐渐消耗殆尽,酵母菌缺少营养物质,进入衰亡期。

图3 酵母单独发酵过程总酸(a)和挥发酯(b)的变化Fig.3 Changes in total acid(a)and volatile esters(b)during yeast fermentation alone
从表3 看出,发酵结束后,酿酒酵母与异常汉逊酵母发酵液中的还原糖含量都在10 g/L 以下,说明两者糖代谢都比较彻底。发酵结束时酿酒酵母的酒精度高于异常汉逊酵母,挥发酯含量低于异常汉逊酵母,显然酿酒酵母产酒精能力较强,异常汉逊酵母产挥发酯能力较强。
2.1.2 酵母单独发酵黄酒感官评价结果 对不同发酵方式的黄酒进行感官品评,总分以各项分累计而得,结果见表4。

表4 不同发酵方式黄酒感官评价结果Table 4 Sensory evaluation results of yellow rice wine with different fermentation methods
发酵结束后,对两种酵母菌单独发酵的黄酒样品进行感官评价,从色泽、口味、香气、风格4 个方面对黄酒样品进行打分,由表4 可以看出,两种酵母单独发酵黄酒的差异主要体现在色泽和香气成分上,酿酒酵母发酵的黄酒样品颜色较淡,而异常汉逊酵母发酵的黄酒样品呈现出色泽较好的琥珀色。另外,异常汉逊酵母由于产挥发酯的特性,所以其发酵的黄酒样品香气成分浓郁,强烈。从口味上来说,酿酒酵母的酒味明显强于异常汉逊酵母。综合来看,异常汉逊酵母发酵的黄酒样品得分高于酿酒酵母发酵的黄酒样品。
2.2 混合酵母发酵路线的筛选
2.2.1 混合酵母发酵过程变化
2.2.1.1 酵母混合方式对酵母生长量的影响 图5 可知,酿酒酵母和异常汉逊酵母同时混合接种发酵,异常汉逊酵母处于劣势地位,4 d 后,平板计数中检测不出异常汉逊酵母菌,说明酿酒酵母对异常汉逊酵母起到强烈的抑制作用[31]。可以看出,在顺序混合发酵条件下,前期异常汉逊酵母具有先发优势,增殖速度较快,形成菌种优势,对酿酒酵母的增殖起一定压制作用。4 d 后,酿酒酵母逐渐适应发酵条件,增殖数大于异常汉逊酵母,异常汉逊酵母菌种优势下降,酿酒酵母占据发酵优势地位。

图5 同时混合静置(a)和顺序混合静置(b)发酵期间酵母数变化Fig.5 Changes in yeast number during fermentation with simultaneous mix-and-stand(a)and sequential mix-and-stand(b)
2.2.1.2 酵母混合方式对发酵过程理化指标及产挥发酯量的影响 从图6 和图7 可以看出,在发酵前2 天,CH(同时混合发酵)消耗还原糖的速率远远大于SH(顺序混合发酵)还原糖的速率,这是因为前2 天,酿酒酵母大量生长繁殖,还原糖等碳源营养物质被大量吸收利用,通过EMP 代谢途径产生大量酒精。发酵结束后,SH 和CH 的还原糖含量均低于10 g/L,说明发酵代谢彻底,还原糖转化率高。发酵过程中CH 的酒精度始终高于SH 的酒精度,说明酿酒酵母的酒精转化率高,SH 挥发酯含量显著高于CH 的挥发酯含量,这是因为CH在发酵过程中,异常汉逊酵母竞争力太差,导致发酵中后期,以酿酒酵母为主体发酵菌种。结束后,SH 的酒精度(8.1%vol)略低于CH 的酒精度(8.7%vol)。CH 和SH 最终总酸含量分别为3.1 g/L 和4.7 g/L,挥发酯含量分别为0.56 g/L 和1.59 g/L,SH 挥发酯含量显著高于CH 挥发酯含量。

图6 不同混合条件黄酒发酵期间还原糖(a)和酒精度(b)的变化Fig.6 Changes in reducing sugar(a)and alcohol content(b)during fermentation of yellow rice wine with different mixing conditions

图7 不同混菌条件黄酒发酵期间总酸(a)和挥发酯(b)的变化Fig.7 Changes of total acid(a)and volatile ester(b)during fermentation of rice yellow wine under different mixed conditions
2.2.2 酵母混合方式对黄酒发酵产品感官的影响发酵结束后,对黄酒样品进行感官评定,从色泽、口味、香气、风格4 个方面对黄酒样品进行打分,根据感官评价结果,由表5 可知,SH 黄酒的综合感官得分高于CH 黄酒。SH 具有浓郁的酒香味,口味醇和、爽口的特点。CH 黄酒具有酒味不醇厚,香气不明显的特点。因此,可以将SH 路线作为黄酒新工艺研究方向,改善黄酒风味和口感。

表5 黄酒感官评价结果Table 5 Sensory evaluation results of yellow rice wine
2.3 发酵工艺优化
2.3.1 单因素实验结果与分析 由图8 可知,随着初始还原糖含量的增加,酒精度呈逐步上升的趋势,而挥发酯含量在逐步下降,当还原糖含量高于220 g/L 时,挥发酯含量趋于稳定,说明还原糖含量偏高时,不利于酯类等物质的生成,使得发酵黄酒挥发酯含量偏低;而酒精度随还原糖含量的增加而增加,说明发酵彻底,酒精转化率高。由此,可以选择一个合适的含糖量(160 g/L),使发酵黄酒的酒精度含量不能过低,并且可以增加挥发酯的含量,增加香气成分。

图8 初始还原糖浓度对发酵黄酒酒精度和挥发酯含量的影响Fig.8 Effect of initial reducing sugar concentration on alcohol content and volatile ester content of fermented yellow rice wine
由图9 可知,当发酵温度在26~34 ℃,温度对发酵黄酒最后的酒精度含量影响不显著,说明在这个温度范围内,酿酒酵母具有较强的发酵酒精能力。发酵温度在32 ℃时,挥发酯的含量达到最高值1.70 g/L。发酵温度过高或者过低都会影响最后挥发酯的含量。这可能是因为温度过高或者过低都不利于产酯酵母的生长繁殖,从而使得最终生成的挥发酯含量下降。另外,发酵温度过高也不利于香气成分等小分子物质保留,使得最终的挥发酯含量略低。综上考虑,发酵温度为32 ℃较为合适。

图9 主发酵温度对发酵黄酒酒精度和挥发酯含量的影响Fig.9 The effect of main fermentation temperature on the alcohol content and volatile ester content of fermented yellow rice wine
由图10 可知,当pH 值为4.5 时,酒精度含量最高达到8.9% vol。pH 值为4.0 时,挥发酯的含量最高,为1.64 g/L。pH 值的高、低都会影响异常汉逊酵母的生长代谢,使得最后生成的挥发酯含量有所不同。当pH 值含量为4.0 时,酒精度的含量也大于8.0% vol,达到低度黄酒国家标准的酒精度要求。综合考虑,选择初始发酵pH 值为4.0比较合适。

图10 初始pH 值对顺序发酵黄酒酒精度和挥发酯含量的影响Fig.10 Effect of initial pH value on alcohol content and volatile ester content of sequentially fermented yellow rice wine
由图11 可知,不同接种量条件对发酵黄酒最终酒精度含量的影响并不显著。挥发酯含量随着接种量的增加呈先增大后减小的趋势。接种量在1.0×107个/mL 时,挥发酯含量最高,达到1.72 g/L。当初始接种量过小时,影响发酵的启动速度,效率过低。接种量过高时,则由于糖类等初始营养物质消耗过快,不利于酯类物质的积累。综合考虑,选择接种量为1.0×107个/mL,比较适合黄酒发酵。
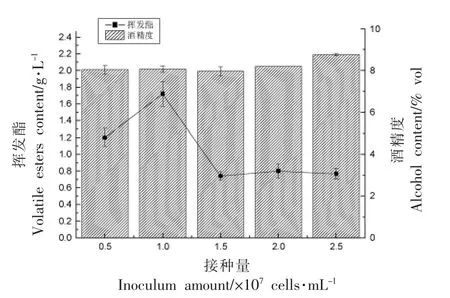
图11 接种量对顺序发酵黄酒酒精度和挥发酯含量的影响Fig.11 Effect of inoculum size on alcohol content and volatile ester content of sequentially fermented yellow rice wine
2.3.2 响应面试验结果与分析 在单因素实验结果的基础上,确定主发酵温度(A)、pH 值(B)、接种量(C)为考察自变量,以挥发酯含量为响应值,用Design-Expert V8.0.6 统计分析软件设计BoxBehnken 响应面试验,共设计3 因素3 水平,共17 个试验组别,试验结果见表6。

表6 响应面分析法试验方案及结果Table 6 Experimental scheme and results of response surface methodology
通过软件分析拟合,以挥发酯含量为响应值,得到顺序发酵黄酒挥发酯含量对主发酵温度(A)、pH 值(B)、接种量(C)的二次回归方程为:挥发酯=1.69-0.053A-0.026B-0.031C-0.005AB-0.020 AC+0.048BC-0.12A2-0.10B2-0.13C2。
从表7 和表8 可以看出,模型的P 值<0.0001,说明该回归模型达到极显著水平,失拟项的P 值为0.1750>0.05,表明模型失拟项不显著;决定系数R=0.9808,表明98.8%的数据可以用这个方程来解释;信噪比为17.723>4;变异系数为1.67%<15%;以上分析均说明该回归模型与试验拟合良好,可以用于对顺序发酵黄酒的挥发酯含量的预测分析。
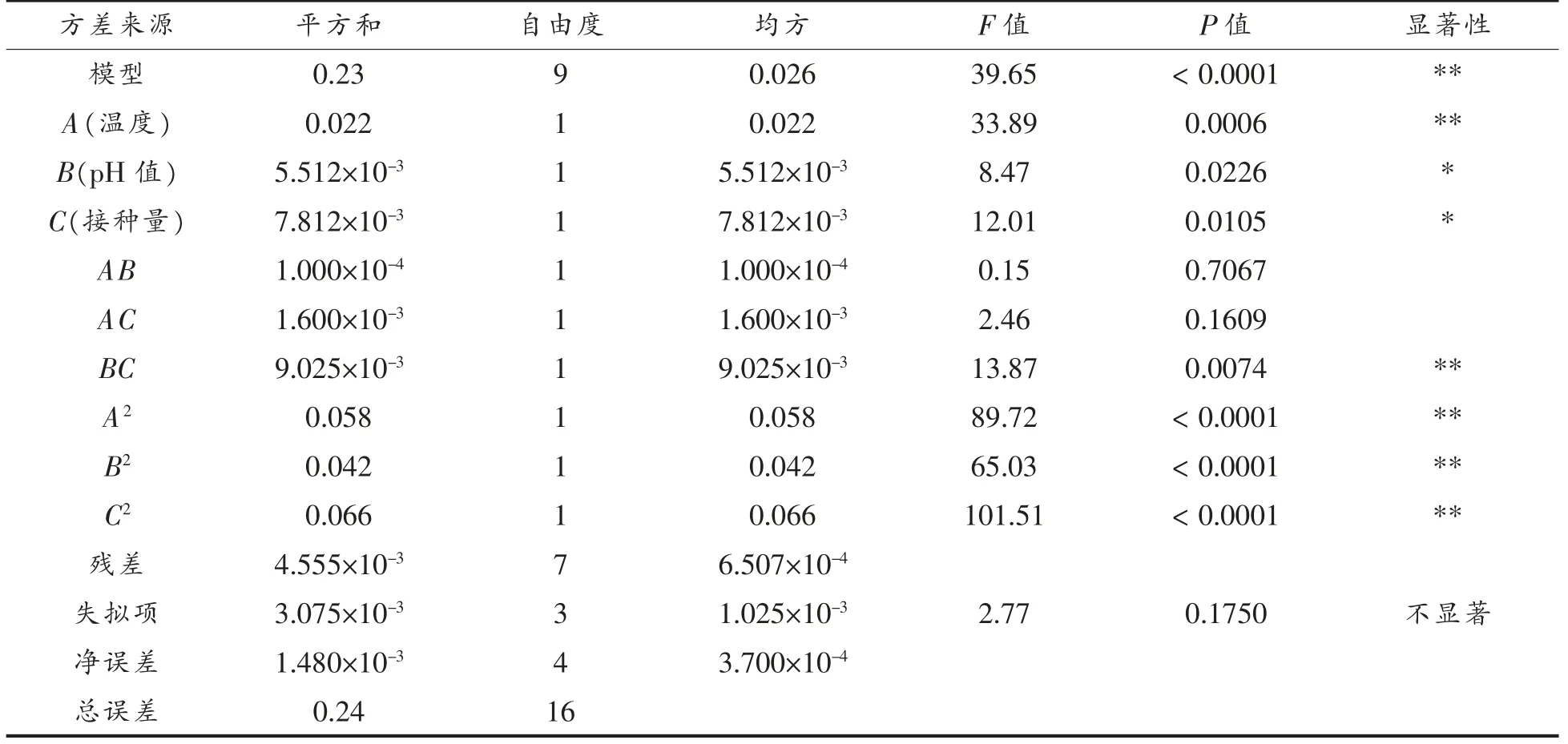
表7 挥发酯回归方差模型分析Table 7 Analysis of volatile ester regression variance model
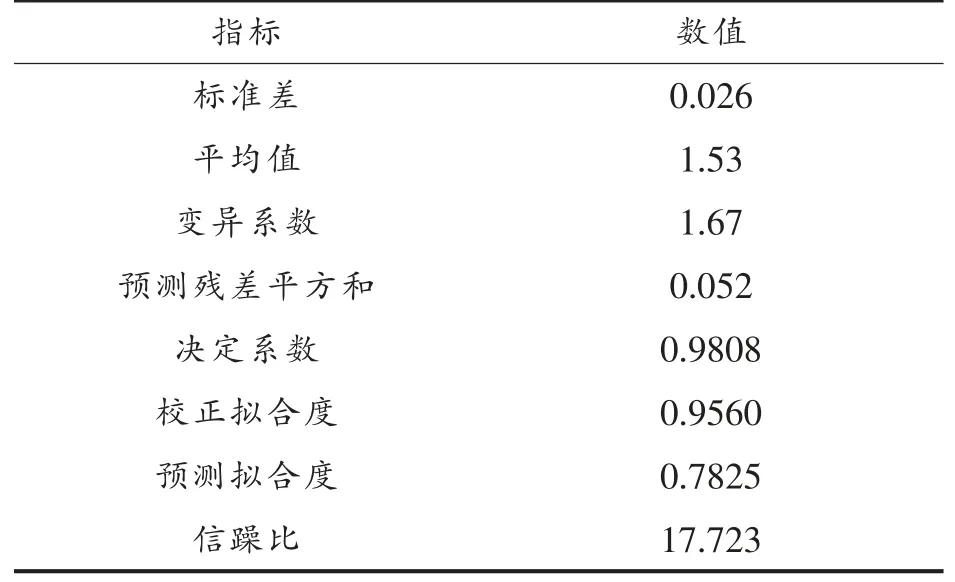
表8 模型可行性分析Table 8 Model feasibility analysis
本模型因素一次项A(P<0.01)为极显著水平,B 和C(0.01<P<0.0)为显著水平;二次项A2、B2、C2均为极显著水平(P<0.01);交互项BC 为极显著水平(P<0.01),AB 和AC 均不显著(P>0.05),从主发酵温度(A)、pH 值(B)、接种量(C)3 个影响因素的F 值可知,各单因素对发酵黄酒挥发酯含量的影响大小依次为:A(33.89)>C(12.01)>B(8.47)。
2.3.2.1 模型讨论与分析 响应面是以响应值对各试验因子所构成的三维空间的曲面图[32]。通过用Design expert 8.06 软件分析,得出主发酵温度、pH 值和酵母接种量交互作用对黄酒挥发酯含量影响的响应曲面和等高线,结果如图12 所示。

图12 各因素间交互作用对黄酒挥发酯含量影响的响应面图和等高线图Fig.12 Response surface and contour map of the interaction between factors on the content of volatile esters in yellow rice wine
响应面中的最高点是等高线最小椭圆的圆心,并且图形的曲面越陡峭,说明两因素之间的交互作用越明显。相反,图形的曲面越平缓,说明两因素的交互作用越小。等高线的形状可以表示因素之间的交互作用的显著程度,等高线的形状越接近椭圆形,表明两因素的交互作用显著;相反,形状越接近圆形,表面相互作用不显著[33]。由图12可知,曲面图形开口均向下,存在极值。从图中可以看出,温度对于SH 黄酒的挥发酯含量影响最大,A(发酵温度)和B(pH 值)的等高线趋于圆形,交互作用不显著;而A(发酵温度)和C(接种量)与B(pH 值)和C(接种量)的曲面形状较为陡峭,等高线近于椭圆形,说明两因素间的交互作用显著。从图中也可看出,发酵温度对挥发酯含量的影响大于pH 值、接种量;接种量对挥发酯含量的影响大于pH 值。因此,各因素影响挥发酯含量的顺序依次为:发酵温度>接种量>pH 值,与方差结果分析一致,说明模型的可靠性较高。
2.3.2.2 验证试验 通过Design-Expert 8.0.6 对方程求解,得到顺序发酵黄酒的最佳工艺:发酵温度为31.58 ℃,接种量为0.93×107个/mL,pH 值为4.18。在此条件下,挥发酯含量的理论值为1.70 g/L。同时考虑到实际操作的可行性,修正最佳工艺的条件为:温度31.5 ℃,接种量为1.0×107个/mL,pH 值为4.2。在此条件下进行平行试验3 次,得到发酵黄酒结束后的挥发酯含量为1.66 g/L,准偏差为0.028,与理论值相差不大,说明试验模型可靠,试验结果理想。在此条件下,测得发酵结束后的理化指标,酒精度8.0% vol,还原糖含量9.32 g/L,总酸含量4.32 g/L,综合感官评价得分为82.6。
3 结论
本研究对2 种酵母发酵过程中理化指标进行跟踪检测,并对发酵结束后的黄酒样品进行感官评价,发酵结束后,酿酒酵母和异常汉逊酵母的酒精度分别为9.9% vol 和6.8% vol,挥发酯含量分别为0.53 g/L 和2.41 g/L,异常汉逊酵母的挥发酯含量是酿酒酵母含量的4.5 倍,含量显著高于酿酒酵母,且香气较为浓郁。对2 种酵母进行混菌发酵途径筛选,显示顺序混合发酵路线能有效提高黄酒中挥发酯含量,选择顺序混合发酵路线较为合适。
通过使用软件Design-Expert 8.0.6 对主发酵温度、pH 值、接种量3 个因素以挥发酯为响应值进行优化。结果显示,最佳发酵工艺为:发酵温度31.5 ℃,pH 值4.2,接种量1.0×107个/mL。在此条件下进行3 次平行试验,得到挥发酯含量为1.66 g/L。同时测得理化指标:酒精度8.0% vol,还原糖含量9.32 g/L,总酸含量4.32 g/L,符合黄酒国标GB/T 13662-2018 中清爽型干黄酒理化要求,综合感官评价得分为82.6。在保证顺利发酵的情况下,增加了非酿酒酵母的优势,提高了黄酒中挥发酯含量,增加更多香气成分,改善了黄酒的品质和风味,具有一定的现实意义。

