茶多酚对嗜水气单胞菌致病力的抑制作用
张德福,闫天慧,,励建荣,杨秋红,艾晓辉,董 靖*
(1 渤海大学食品科学与工程学院 辽宁锦州121013 2 中国水产科学研究院长江水产研究所 武汉 420223)
水产品是重要的动物蛋白来源之一[1]。鱼肉具有低脂肪、低胆固醇、高蛋白质和富含人体必需微量营养素等优点,有助于均衡营养和健康[2]。水产养殖是全球发展最快的动物性食品生产部门,在全球粮食安全中占有至关重要的地位[2]。随着人们生活水平的提高和对水产品需求的增加,水产养殖在世界范围内迅速发展。自2000 年以来,水产养殖方式趋向于集约化,然而随着集约化养殖的发展,各类传染性疾病在水产养殖中频繁暴发[1],不仅给养殖业带来巨大的经济损失,还对水产品的食品安全和人类健康造成潜在威胁[3]。
嗜水气单胞菌(Aeromonas hydrophila)是广泛分布于淡水养殖环境中的一种人-畜-鱼共患致病菌,已经成为一种重要的食源性病原菌。其既可以导致多种水产养殖动物患病,还可以通过受污染的水、患病鱼等导致人类感染败血症、肠道感染、腹泻、皮肤病等疾病[4]。目前,已有从水环境、饮用水、废水甚至鱼、虾、肉、牛奶和蔬菜等多种食品中分离出该菌的报道[5]。控制嗜水气单胞菌导致的食源性疾病非常重要。
嗜水气单胞菌有多种毒力因子参与其致病力,如气溶素、溶血素、肠毒素和生物被膜等。其中,气溶素是嗜水气单胞菌分泌的一种蛋白毒素,并且是嗜水气单胞菌主要的毒力因子之一,具有溶血性、肠毒性和细胞毒性[10]。气溶素的成孔机制已被清晰阐述[11],气溶素经胰蛋白酶或其它蛋白酶活化后,方具有活性,活化的气溶素可结合到上皮细胞等敏感细胞表面,并形成具有孔道结构的七聚体,从而破坏细胞膜的通透性屏障而导致细胞死亡[11]。以气溶素为靶标进行药物筛选,有望成为抗耐药性嗜水气单胞菌感染药物研发的新路径。
茶多酚是存在于茶叶中多酚类物质的总称,包含儿茶素类、黄酮类、酚酸类等成分,其中儿茶素是其主体成分[12]。大量学者对茶多酚的相关研究表明,茶多酚具有降脂、减肥、调血脂、杀菌、消炎、抗病毒、保肝、护肝等作用[13]。余春燕等[12]发现可以通过外源膳食补充茶多酚来预防人与动物的心肌相关疾病。张蒙等[14]发现氧化型茶多酚可以通过改变高脂饮食老年大鼠的肠道微生物群落结构,从而改善大鼠的健康状况。朱娜等[15]发现茶多酚中表没食子儿茶素没食子酸酯是抑菌的主要成分,并对饮用水具有一定消毒效果。为研究抗嗜水气单胞菌感染的天然药物,本研究通过生长曲线、溶血活性、荧光热漂移、七聚体形成和体内、外致病力评价等试验,研究了茶多酚的抗嗜水气单胞菌感染作用,为以茶多酚为主要成分的药物研究奠定了基础。
1 材料与方法
1.1 材料与试剂
嗜水气单胞菌XS-91-4-1 由本实验室保存;茶多酚、恩诺沙星,中国食品药品检定研究院;脱纤维羊血,南京茂捷微生物科技有限公司;乳酸脱氢酶检测试剂盒、活细胞/死细胞双染试剂盒、ECL试剂盒,上海翌圣生物科技股份有限公司;纯化气溶素由本实验室通过原核表达纯化获得并保存;抗气溶素多克隆抗体由本实验室制备并保存。
1.2 仪器与设备
生化培养箱(ZDS-1160)、恒温振荡培养箱(ZHWY-100B),上海智成分析仪器制造有限公司;摇床振荡器(TS-1000),海门市其林贝尔仪器制造有限公司;酶标仪(680),美国伯乐公司;分光光度计(UV-1600PC),德润诚生物科技有限公司;高速微量离心机(D2012),大龙兴创实验仪器北京有限公司;凝胶成像系统(ChemiScope6000Exp),上海勤翔科学仪器有限公司。
1.3 最小抑菌浓度测定
采用微量稀释法测定茶多酚、恩诺沙星2 种药物对嗜水气单胞菌的最小抑菌浓度(MIC)[16]。用MHB 培养基对药物进行二倍稀释,茶多酚质量浓度由512 μg/mL 稀释至2 μg/mL,恩诺沙星质量浓度由32 μg/mL 稀释至0.125 μg/mL,每孔中培养基体积为100 μL。嗜水气单胞菌XS-91-4-1 在28 ℃振荡培养至对数生长中期,10 000×g 离心1 min 收集菌体,菌体经PBS 洗涤后,用MHB 调整浓度至为5×105CFU/mL。向每孔中加入100 μL 菌液,并设置对照。以不长菌的孔中最低的药物浓度作为该药的MIC。
1.4 生长曲线
从培养皿中无菌挑取XS-91-4-1 单菌落,在LB 液体培养基中培养过夜,次日按1%比例将培养好的菌液加入到100 mL 新鲜的培养基中,在28 ℃摇床中继续振荡培养至OD600nm=0.3。分别取20 mL 菌液分装至5 个玻璃锥形瓶中加入128,64,32,16,0 μg/mL 质量浓度的茶多酚,不加药物的菌液作为阴性对照。28 ℃继续振荡培养5 h,用分光光度计每30 min 记录1 次OD600nm吸光值,绘制生长曲线。
1.5 溶血试验
1.5.1 嗜水气单胞菌培养物上清液的溶血试验将嗜水气单胞菌XS-91-4-1 在28 ℃条件下培养至OD600nnm=0.3,将菌液分装于6 个无菌锥形瓶中,分别加入16,8,4,2,1,0 μg/mL 质量浓度的茶多酚,28 ℃继续培养至嗜水气单胞菌与茶多酚共培养体系OD600nm=1.5 时,10 000×g 离心1 min 收集菌液上清。向菌液上清中加入胰蛋白酶(20 μg/mL),在室温条件下作用10 min,使菌液上清中的气溶素活化。
秦风在班上一如既往地沉默,可能他真的不喜欢说话,努力几次后,我也有些“心有余而力不足”的挫败感。每一次都是我滔滔不绝地说了半天,他就回应我一个字——“嗯”,实在是让人崩溃。有同学在背后叫他“闷葫芦”,我觉得很形象,但为了团结,还是阻止大家这样叫他,或许他需要时间来适应吧。
溶血试验在1.5 mL 离心管中进行,溶血体系由875 μL 溶血缓冲液,100 μL 胰蛋白酶处理后的菌液上清和25 μL 脱纤维绵羊红细胞组成,充分混匀后在37 ℃培养箱中反应15 min,然后通过离心(10 000×g,1 min)去除未裂解的红细胞,取上清液用分光光度计测定OD543nm处的吸光值。将只加溶血缓冲液和红细胞的试验组作为阴性对照组,0.1%Triton X-100 处理的红细胞作为阳性对照组。
1.5.2 纯化气溶素的溶血试验 根据之前的研究[17]用纯化的气溶素测定茶多酚对气溶素溶血活性的影响。茶多酚与纯化气溶素的反应体系为1 mL,首先向离心管中加入溶血缓冲液975 μL、纯化气溶素(5 μg/mL)和终质量浓度分别为16,8,4,2,1,0 μg/mL 的茶多酚,放入37 ℃培养箱中10 min,使气溶素与药物充分反应,然后加入25 μL脱纤维绵羊红细胞,充分混匀后,在37 ℃反应15 min。
1.6 免疫印记试验
取1.5.1 中激活的菌液上清作为免疫印迹试验样品,上清液用BCA 总蛋白定量试剂盒测定样品中的总蛋白浓度。取适量样品与蛋白上样缓冲液混匀,在100 ℃水浴锅中煮沸10 min,简短离心(3 000×g,1 min)后,取20 μL 样品进行SDS-PAGE电泳。电泳后将凝胶上的蛋白通过半干法转印至PVDF 膜上,转印后的膜经5%脱脂奶粉封闭后,加入抗嗜水气单胞菌气溶素抗体常温(25 ℃)反应1 h,TBST 洗涤5 次后,加入HRP 标记的羊抗兔IgG 二抗反应1 h,洗涤后使用ECL 试剂检测。
1.7 荧光热漂移试验
荧光热漂移试验采用Protein Thermal Shift染料试剂盒,并按说明书操作。向八排管中加入Thermal Shift 缓冲液5 μL,8×Thermal Shift Dye 2.5 μL,纯化气溶素(终质量浓度10 μg/mL)1 μL和茶多酚(终质量浓度32 μg/mL)0.6 μL,添加气溶素储存缓冲液,使反应体系补足20 μL,0.6 μL DMSO 组作为阴性对照。将体系混匀后,将八排管置于实时荧光定量PCR 仪上,以1.6 ℃/min 的速度从25 ℃加热到90 ℃,在Ex/Em=490/530 处检测荧光强度。
1.8 七聚体形成试验
按Iacovache 等[18]报道的方法诱导产生七聚体。取质量浓度为2 mg/mL 的激活气溶素20 μL,加入到1.5 mL 离心管中,向每管中按比例加入相同体积的茶多酚,使体系中气溶素与茶多酚的物质的量的比与1.5.2 溶血试验一致。将混合好的反应体系置于37 ℃培养箱中反应10 min,然后加入pH 值为7.2 的HEPES 缓冲液,继续将混合物在室温条件下静置孵育1 h,聚丙烯酰胺凝胶电泳(8%)后观察分析。
1.9 细胞毒性试验
1.9.1 LDH 释放试验 人肺上皮细胞(A549)生长在含有10%胎牛血清的DMEM 培养基(含100 μg/mL 青霉素和100 μg/mL 链霉素)中,细胞置于37 ℃含有5%CO2细胞培养箱中,静置培养48 h。生长好的细胞加入浓度为0.25%的胰蛋白酶消化,用不含血清的DMEM 培养基将细胞重悬并按1.5×105个/孔接种至96 孔细胞培养板中,于37 ℃,5%CO2的条件下继续培 养16 h 备用。5 μg/mL活化气溶素加入茶多酚使其终质量浓度分别达到32,16,8,4,0 μg/mL,37 ℃培养箱中静置反应10 min 后,加入到细胞中,37 ℃继续培养2 h,离心(1 000×g,5 min)取上清液,按试剂盒操作步骤加入试剂,反应30 min 后,用酶标仪测定波长490 nm 处的吸光度。
1.9.2 细胞染色 取1.9.1 LDH 试验后的细胞,用无菌PBS 洗涤3 次,加入活/死细胞染色试剂后,置于暗处反应30 min,用荧光显微镜观察细胞图像并拍照。
1.10 试验治疗学
将90 尾体质量为(150±10)g 斑点叉尾鮰随机分为3 组,每组30 尾,饲养于200 L 的玻璃缸中,保持水温为(28±2)℃,溶解氧5.5~5.8 mg/L,分组后在该环境下暂养10 d。嗜水气单胞菌XS-91-4-1 在LB 液体培养基中振荡培养至OD600nm=1,离心收集菌体;洗涤后将菌液用无菌PBS 调整至1.5×108CFU/mL。茶多酚组和阳性对照组的实验鱼分别通过腹腔注射200 μL 菌液,阴性对照组注射相同体积的无菌PBS,建立嗜水气单胞菌感染模型。茶多酚组在感染后6 h 开始口灌50 mg/kg剂量的茶多酚溶液,2 个对照组灌服PBS,每12 h一次,连续灌胃3 d。每24 h 观察各试验组鱼的活动情况及发病鱼症状,并记录各组鱼的死亡情况。
2 结果与分析
2.1 茶多酚对嗜水气单胞菌生长的影响
MIC 测定试验发现,茶多酚对嗜水气单胞菌XS-91-4-1 的MIC 高于256 μg/mL,而恩诺沙星为4 μg/mL。由此可见,茶多酚对嗜水气单胞菌XS-91-4-1 基本无抑菌活性,且该菌株对恩诺沙星具有一定耐药性。为研究不同浓度茶多酚对嗜水气单胞菌生长的影响,绘制了5 h 内茶多酚与嗜水气单胞菌共培养的生长曲线。如图1 所示,茶多酚质量浓度在16~128 μg/mL 时,嗜水气单胞菌的生长与未添加药物组相比无显著性差异。综上所述,在本试验条件下,质量浓度为16~128 μg/mL的茶多酚与嗜水气单胞菌共培养后对细菌的生长没有影响。
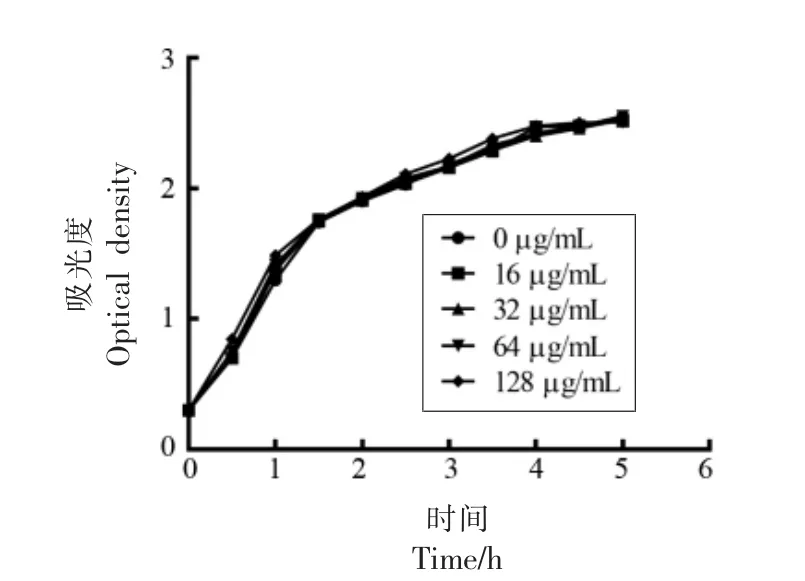
图1 茶多酚与嗜水气单胞菌XS-91-4-1共培养的生长曲线Fig.1 Growth curves of A.hydrophila XS-91-4-1 co-cultured with tea polyphenols
2.2 茶多酚对气溶素活性的抑制作用
通过共培养试验发现,茶多酚可剂量依赖性的降低共培养物上清液的溶血活性。如图2a 所示,当茶多酚质量浓度为1,2,4,8 μg/mL 时,上清液的溶血百分比分别为38.58%±2.65%,28.82%±2.18%,21.61%±2.89%和14.58%±2.16%,而空白组溶血百分比为79.25%±4.31%。当茶多酚质量浓度达到1 μg/mL 及以上时,其溶血百分比与空白组相比差异显著。该结果提示,茶多酚可能通过抑制气溶素表达或活性降低其溶血活性。因此,本试验研究了茶多酚对纯化气溶素和嗜水气单胞菌分泌气溶素活性的影响。如图2b 所示,当茶多酚质量浓度为1,2,4,8 μg/mL 时,纯化后的气溶素的溶血百分比从未添加药物处理组的86.98%±21.81%依次下降到44.26%±2.64%,26.27%±11.63%,16.37%±3.27%,7.29%±2.68%,当质量浓度在1 μg/mL 及以上时,差异显著。如图3 所示,通过蛋白免疫印迹试验发现,不同质量浓度茶多酚与嗜水气单胞菌共培养后,其上清液中气溶素的含量没有变化。以上3 个试验结果表明,茶多酚可在较低质量浓度下通过直接抑制嗜水气单胞菌气溶素的活性,降低其溶血活性,对气溶素的分泌没有影响。
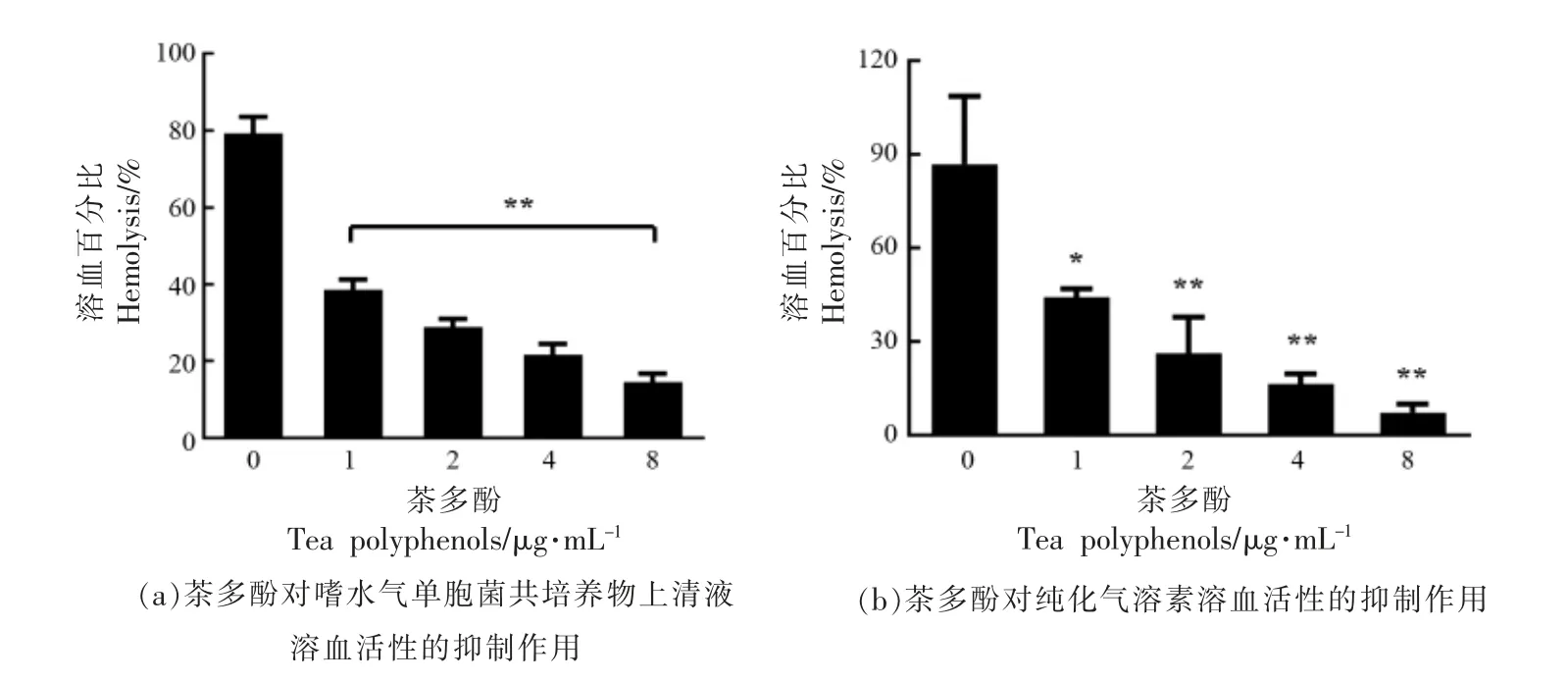
图2 茶多酚与气溶素介导的溶血活性的抑制作用Fig.2 Inhibitory effects of tea polyphenols against aerolysin mediated hemolysis

图3 茶多酚对细菌上清液中气溶素产物的影响Fig.3 Influence of tea polyphenols on aerolysin production in bacterial supernatants
2.3 茶多酚提高气溶素的热稳定性
通过荧光热漂移试验研究茶多酚对气溶素热稳定性的影响如图4 所示,反应体系中加入32 μg/mL 茶多酚后,使气溶素的Tm值向右移动了4.8 ℃,超过了2 ℃。该结果表明,茶多酚与气溶素结合后可提高其热稳定性,提示茶多酚与气溶素发生了相互作用。

图4 茶多酚对气溶素热稳定性的影响Fig.4 Impact of tea polyphenols on thermal stability of aerolysin
2.4 茶多酚抑制气溶素的寡聚化
如图5 所示,随着茶多酚质量浓度的升高,气溶素七聚体的量逐渐下降,当茶多酚质量浓度达到1 024 μg/mL 时,未检测到有七聚体形成。气溶素单体通过结合于易感细胞的表面形成具有孔道的七聚体,七聚体导致细胞膜完整性被破坏,最终导致细胞死亡。因此,茶多酚可以通过抑制七聚体的形成来降低气溶素的活性。
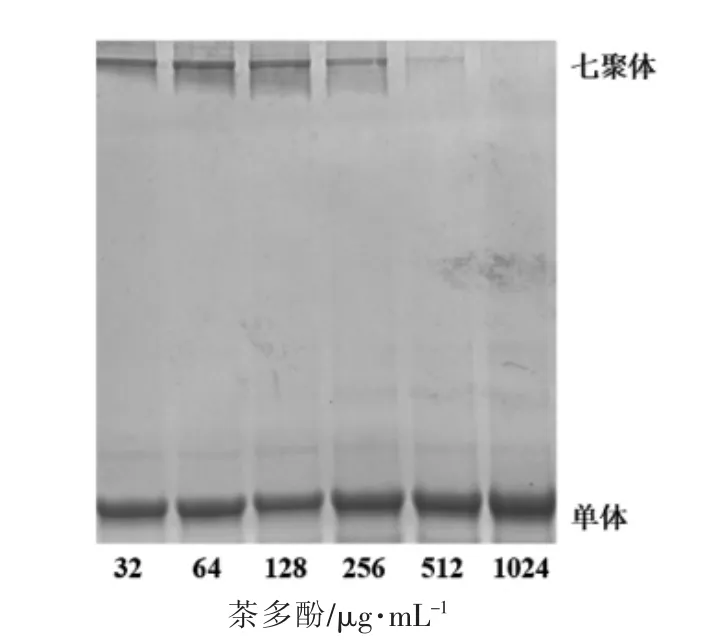
图5 茶多酚对气溶素七聚体形成的抑制作用Fig.5 Inhibition of heptamer formation by addition of tea polyphenols
2.5 茶多酚对气溶素介导的细胞损伤的保护作用
如图6 所示,随着茶多酚质量浓度的升高,A549 细胞上清液中LDH 释放比例逐渐下降。当茶多酚质量浓度分别为1,2,4,8 μg/mL 时,其LDH 释放百分比分别为74.58%±9.38%,53.49%±13.57%,46.19%±7.44%,24.39%±13.42%。当茶多酚质量浓度达到16 μg/mL 及以上时,LDH 下降比例与无药物处理组相比差异显著。细胞染色如图7a~7c 所示,未经处理的细胞呈绿色(图7a),表明该细胞为活细胞;用气溶素处理过的细胞表现为红色(图7b),提示为死亡细胞;气溶素与16 μg/mL 的茶多酚反应后再加入到细胞体系,可见细胞死亡明显减少(图7c)。以上结果表明,LDH 释放和细胞染色试验均能反映出A549 细胞经药物处理前、后的损伤或死亡情况,茶多酚处理后可显著降低气溶素介导的细胞损伤。
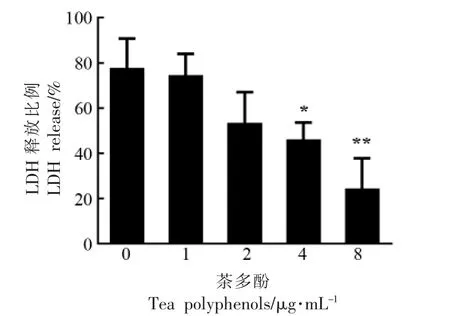
图6 茶多酚对气溶素介导的A549 细胞LDH释放的影响Fig.6 Impact of tea polyphenols on LDH release of A549 cells mediated by aerolysin

图7 茶多酚对气溶素介导的细胞损伤的保护作用Fig.7 Protective effect of tea polyphenols on aerolysin mediated cell injury
2.6 茶多酚对斑点叉尾鮰嗜水气单胞菌感染的保护作用
通过体外试验发现,茶多酚对气溶素介导的细胞损伤有显著的保护作用,提示茶多酚对嗜水气单胞菌感染有一定的保护作用。通过腹腔注射的方法构建了斑点叉尾鮰嗜水气单胞菌感染模型。人工感染后,斑点叉尾鮰感染后出现了明显的发病,主要表现为游动失调,体质量下降等,经剖检发现死亡鱼腹腔内有大量积水,肠道内有出血点,与自然感染的症状相同,表明模型构建成功。如图8 所示,阳性对照组未经任何药物治疗,试验第8 天时存活率为3.33%;而灌服50 mg/kg 茶多酚治疗后斑点叉尾鮰的存活率为60%,两组差异极显著。该研究结果表明,茶多酚可降低嗜水气单胞菌对斑点叉尾鮰的致病力。

图8 茶多酚对人工感染嗜水气单胞菌的斑点叉尾鮰的治疗作用Fig.8 Therapeutic effect of tea polyphenols on channel catfish infected with A.hydrophila
3 讨论
嗜水气单胞菌可以引起水产动物和人类的多种疾病,已经引起国内外高度重视。戚伟等[19]在因采食鱼塘水草而患病死亡的仔猪肝脏及病变肠道中发现致病菌株包含嗜水气单胞菌;Vivekanandhan 等[20]对市售的536 个鱼类样本和278 个对虾样本进行检测分析后发现,对虾和鱼类有不同程度的带菌率;马恩红等[21]对暴发感染性腹泻事件的研究表明,患者是因饮用了被嗜水气单胞菌所污染的井水而患病。从以上研究可以发现,嗜水气单胞菌对食品安全存在严重的威胁。
抗菌药物被广泛用于水产养殖中细菌性感染的预防和治疗[22],导致水产养殖中嗜水气单胞菌对抗菌药物产生不同程度的耐药性,并呈现多重耐药的特点[23]。Vivekanandhan 等[24]从印度南部出售的海鲜中分离出的319 株嗜水气单胞菌,均对甲氧西林和利福平耐药,对杆菌肽的耐药率为99%,对其它抗菌药物也有不同程度的耐药。李爱华等[25]对我国鱼类嗜水气单胞菌进行耐药性分析发现,26 株试验菌株均对青霉素类药物具有耐药性,且多数菌株具有多重耐药性。本研究中嗜水气单胞菌XS-91-4-1 对恩诺沙星的最小抑菌浓度为4 μg/mL,表明该菌对恩诺沙星耐药。
成孔毒素通常是由细菌分泌的一类毒素,在肺炎链球菌、金黄色葡萄球菌、大肠埃希氏菌、结核分枝杆菌和嗜水气单胞菌等多种重要病原菌的毒力中发挥重要作用。成孔毒素可作用于真核细胞,在其细胞膜上形成寡聚体并产生孔道,从而引起细胞膨胀和溶解。寡聚化是成孔毒素发挥溶细胞活性的必经阶段。因此,抑制寡聚化是中和成孔毒素活性的一种手段。Xie 等[26]发现,金合欢素能在不抑制猪链球菌生长的浓度下剂量依赖性地抑制猪链球菌溶血素的寡聚化,并通过下调MAPK信号通路减轻猪链球菌介导的细胞损伤。Wang等[27]报道了杨梅素可以作为金黄色葡萄球菌α-溶血素的抑制剂,通过抑制α-溶血素的寡聚化抑制金黄色葡萄球菌的毒力。Lv 等[28]从天然化合物中发现槲皮素能抑制肺炎链球菌溶血素的活性,通过寡聚化试验发现槲皮素能剂量依赖性的降低溶血素寡聚体的形成,并对肺炎链球菌人工感染模型动物起治疗作用。以上研究表明,成孔毒素可作为研究抗毒力药物的靶标。因此,本研究建立了气溶素寡聚化形成试验模型,气溶素与茶多酚共孵育后,通过加入HEPES 使反应体系的pH 降低至气溶素可形成寡聚化的条件。结果发现,茶多酚对气溶素形成七聚体有抑制作用,并呈剂量依赖性,与以上研究结果一致。
自抗毒力策略用于研究抗耐药性病原菌感染药物以来备受关注。气溶素作为嗜水气单胞菌的主要毒力因子,与其致病力密切相关,是研究抗嗜水气单胞菌感染的潜在靶标。国内外已筛选到多种抑制气溶素表达、活性的化合物,并阐明了其作用机制。Srinivasa 等[29]发现柚皮苷作为一种群体感应抑制剂,可抑制嗜水气单胞菌气溶素、生物被膜等毒力因子,并对感染嗜水气单胞菌的斑马鱼产生显著的保护作用。然而柚皮苷对气溶素诱导溶血活性的半数抑制质量浓度高达750 μg/mL,远远高于本试验中茶多酚的有效作用浓度。Takahashi 等[30]研究了4 种吲哚[3,2-b]喹啉对细菌主要成孔毒素活性的抑制作用,发现每一种吲哚[3,2-b]喹啉衍生物均能不同程度地降低温和气单胞菌气溶素的溶血活性,其中C-11 位含有氨基的两种化合物对气溶素活性的抑制作用最强。这些化合物除了直接抑制气溶素的活性,还对温和气单胞菌的生长具有一定的抑制作用,因此,长时间使用该种化合物容易诱导病原菌产生耐药性[30]。本研究中,通过测定茶多酚与嗜水气单胞菌XS-91-4-1 共培养的生长曲线发现,茶多酚对嗜水气单胞菌的生长基本没有影响,其对气溶素活性的抑制作用远远低于其MIC。因此,使用茶多酚治疗嗜水气单胞菌感染仅会降低其致病力,不会对其生长产生选择性压力,不易产生耐药性。谭宏亮等[31]研究了多酚类化合物白藜芦醇对嗜水气单胞菌毒力的抑制作用,发现白藜芦醇可在质量浓度≥32 μg/mL 时显著抑制上清液的溶血活性,并显著提高感染了嗜水气单胞菌的异育银鲫的存活率。以上研究表明,通过抑制气溶素的表达或活性可降低嗜水气单胞菌的体内、外致病力。本研究通过溶血试验、蛋白免疫印迹和荧光热漂移试验发现,茶多酚可直接与气溶素结合,从而使其失去溶血活性;进一步的寡聚化试验发现,茶多酚与气溶素结合后可导致气溶素无法形成功能性七聚体。
近年来随着细菌耐药性的不断出现,人们对天然化合物抗菌特性的研究也逐渐增多[32]。茶多酚是由多种多酚类物质组成的混合物,本试验发现茶多酚最小抑菌质量浓度大于256 μg/mL,表明茶多酚对嗜水气单胞菌基本无抑菌活性。此外,通过生长曲线试验发现茶多酚对嗜水气单胞菌生长几乎没有影响,说明在本试验浓度范围内茶多酚不会影响嗜水气单胞菌生长。Bhattacharya 等[33]从茶中提取的多酚物质对霍乱弧菌进行抗毒力试验,发现多酚物质可以抑制霍乱弧菌蛋白酶的分泌,防止细菌穿透肠黏液层并在肠上皮细胞中定殖,从而降低霍乱弧菌的致病力。此外,茶多酚还广泛应用于保健食品、食药加工、果蔬保鲜等领域[34],而茶多酚对嗜水气单胞菌体内、外致病力的抑制作用尚未报道。本研究的结果显示茶多酚可以有效的抑制嗜水气单胞菌分泌的毒力因子气溶素的活性,有希望作为抗嗜水气单胞菌耐药的候选药物。
4 结论
本文研究了茶多酚对食源性病原菌嗜水气单胞菌体内、外致病力的抑制作用。结果显示,茶多酚在体外对嗜水气单胞菌的生长没有抑制作用,然而可剂量依赖性的降低嗜水气单胞菌分泌的气溶素的活性,茶多酚能直接与气溶素结合,使其无法形成具有孔道的七聚体而失去活性,茶多酚还可以通过抑制气溶素活性,来降低嗜水气单胞菌的体内、外致病力。本研究为嗜水气单胞菌感染的治疗提供了先导化合物和新的策略。

