特勒凯比尔沙门菌临床血流分离株的毒力研究
郑恩惠,邱玉锋,陈建辉,高亚东,黄梦颖,李曲文,林 杰,翁顺太
非伤寒沙门菌(Non-typhoid salmonella, NTS)是导致急性胃肠炎的主要食源性病原之一,具有广泛的宿主范围。当它感染婴幼儿、老年人和免疫功能低下的群体,可导致侵入性的临床疾病[1]。Sell J等[2]研究报道,2011年美国胃肠炎感染患者中,11%是由NTS感染引起的,NTS感染是住院甚至死亡的主要原因。
2019年,课题组从患者血液中分离出1株罕见血清型的沙门菌菌株,经血培养、生化鉴定、血清学和飞行质谱等系列鉴定,确认病原为G群特勒凯比尔沙门菌,经数据库比对为福建省内、亦是国内首次检出人感染沙门菌血清型[3]。
由于人类大多数沙门菌感染病例是由动物源性食物引起的,人们对了解沙门菌如何与动物宿主相互作用、如何突破宿主屏障并操纵宿主细胞使其自身受益,产生了浓厚的兴趣,开始对宿主体内感染动力学的进一步研究[4]。但目前大部分研究是利用少数典型菌株进行,不清楚不同血清型之间的体内代谢差异有多大[5]。为掌握该血清型沙门菌的致病特点,我们建立ICR小鼠模型,研究感染后宿主体征、组织病理学变化特点,对丰富沙门菌流行病学和防控策略意义重大。
1 材料与方法
1.1 实验材料 SPF级ICR小鼠120只,雌雄各半,购自北京华阜康[SCXK(京)2019-0008],体重22~26 g。ABSL-2实验室备案号为2022105532, 本实验室保存的特勒凯比尔沙门菌菌株号为2018103,动物伦理审查号为No.PZ2022043。
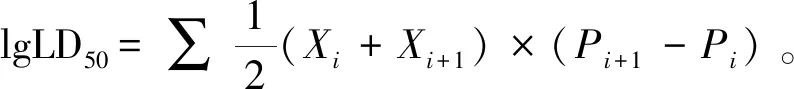
小鼠受试前用 5 mg/mL链霉素腹腔注射0.5 mL/只,连续 2 d,后正常饲养 1 d,实验前禁水禁食 8 h。实验组及对照组每组10只、雌雄各半,实验组腹腔注射菌液0.5 mL/只,对照组接种PBS液0.5 mL/只。统计小鼠死亡数,计算LD50。
1.3 组织病理、透射电镜和淋巴细胞免疫组化实验 接种后,生物安全柜内采集死亡、存活和对照组小鼠的肝、脾、肺、心、肾和空肠等组织,称重。组织一分为二,一份用2.5%戊二醛浸泡固定用于透射电镜实验,另一份用4%多聚甲醛浸泡固定进行病理HE、免疫组化实验。
1.4 排菌周期观察 取小鼠新鲜粪便2~3粒于SBG增菌液中,37 ℃培养18 h并划线于DHL平板上,37 ℃培养24 h后,挑取沙门菌典型菌落接种于双糖斜面上。挑取双糖斜面上少许菌苔,用沙门菌丹麦诊断血清进行凝集实验,验证是否为特勒凯比尔沙门菌。
1.5 组织细菌载量测定 用LD50剂量接种小鼠,对照组接种PBS液,每只0.5 mL。感染后第3 d、6 d、9 d、12 d、15 d,每组随机处死3只小鼠,同样采集上述6种组织,称重后置EP管中,加入1 mL PBS液和1粒无菌不锈钢球进行匀浆。匀浆液依次10倍稀释,取100 μL于3个DHL中,37 ℃培养18 h后进行。菌落计数,计算不同组织在不同感染时间的平均细菌载量。
1.6 小鼠菌株分离培养与实验室评价
1.6.1 分离培养无菌 取LD50实验组小鼠新鲜粪便2~3粒置SBG中,37 ℃培养24 h。挑取SBG增菌液于DHL上,37 ℃培养24 h。
1.6.2 飞行质谱鉴定 分别挑取人分离株和小鼠分离株DHL平板上单个菌落,均匀涂抹MALDI MSP靶板圆孔,晾干后每孔滴加1 μL 70%甲酸溶液和1 μL HCCA基质液,干燥后上机检测。
1.6.3 生化鉴定 分离出的菌株采用VITEK2 Compact予以鉴定。
1.6.4 血清型鉴定 小鼠分离株采用沙门菌丹麦诊断血清进行凝集实验。
1.6.5 PCR检测毒力基因 引物由上海尚亚合成,cdtB-F: GAAACAAGTCAGGCATTGCC,cdtB-R: GAATGGCTCATAAACACGCC,pltA-F: GT-GGGACTATCATCGTGCAG,pltA-R: AGGGTGATCAACGTAACCAC,pltB-F: GCCGGAAGTACCTGTGTTAT,pltB-R: AGTAGTGAAAA-CCCATCGCG。按照试剂盒说明书提取特勒凯比尔沙门菌基因组,-20 ℃保存。PCR反应总体积为20 μL,其中2×Taq PCR Premix Taq(TaKaRa公司)10 μL,F和R引物(20 μmol/L)各0.4 μL,DNA模板3 μL,ddH2O 6.2 μL。PCR反应步骤:94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸70 s,30个循环;72 ℃延伸5 min。然后对PCR扩增产物进行测序。
1.6.6 PFGE实验 小鼠分离株与人分离株和5株其它血清型沙门菌进行分子分型实验。
1.7 测序和生物信息学分析 细菌全基因组测序由北京诺禾致源生物科技有限公司完成。测序后的序列通过VFDB进行生物信息学分析(http://www.mgc.ac.cn/cgi-bin/VFs/v5/main.cgi?func=VFanalyzer)和Center for Genomic Epidemiology (http://www.genomicepidemiology.org/services/)。NCBI Prokaryotic Genome Annotation Pipeline (PGAP) 用于注释已拼接组装的基因组完成图,NCBI GenBank登入号:CP111029,人源菌株基因组框架图NCBI登入号:SAMN16287684。
1.8 统计分析 采用SPSS 20.1软件对实验数据进行统计分析,实验数据以平均值±标准差表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 感染小鼠临床和解剖症状 原液及10-1~10-4实验组感染小鼠后0.5 h即出现临床症状,卷缩、眼神呆滞、被毛松乱。原液及10-1实验组接种4 h后死亡,持续24 h。10-2~10-4实验组感染后12 h开始死亡,持续72 h。死亡小鼠因腹泻致肛周被毛沾染稀便,临死前倒地抽搐。10-5~10-6实验组感染后出现短暂嗜睡外,无其它不适反应。死亡小鼠解剖发现小肠充血严重,空肠、回肠、盲肠可见较多气泡、积液,盲肠坏死;肝尖点状变性,肾脏表面有坏死灶,肺脏苍白、局部坏死,脾脏萎缩。对照组均正常。
2.2 感染小鼠健康状况 感染后各组小鼠死亡数与成活数见表1。

表1 感染后各组小鼠死亡数与成活数Tab.1 The number of deaths and survival of mice in each group after infection
2.3 半数致死量(LD50)测定 在10-9稀释浓度接种营养琼脂培养基后进行菌落肉眼计数,3次有效菌落计数分别为42 CFU、39 CFU、46 CFU,菌落平均计数为42.3 CFU。结合表1中半数致死浓度,按Korbor法公式算出特勒凯比尔沙门菌的LD50为2.67×108CFU/mL,95%可信限上限为 7.99×108CFU/mL,95%可信限下限为8.92×107CFU/mL。
2.4 组织病理、投射电镜、淋巴细胞免疫组化实验结果(以心脏、空肠为例)
2.4.1 组织病理学结果 对照组心肌细胞正常均匀、无炎细胞浸润。10-1组、10-2组、10-3组心肌细胞排列规整,轻微炎细胞浸润。原液组心肌间质小灶状炎细胞浸润,毛细血管扩张充血。见图1。
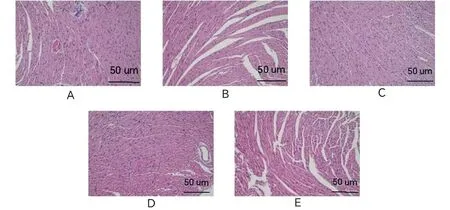
注:A.原液;B.10-1;C.10-2;D.10-3;E.对照。图1 不同稀释度下特勒凯比尔沙门氏菌接种的小鼠心肌组织HE染色 (200×)Fig.1 HE staining of myocardial tissue in mice at different dilutions with Salmonella Telelkebir(200×)
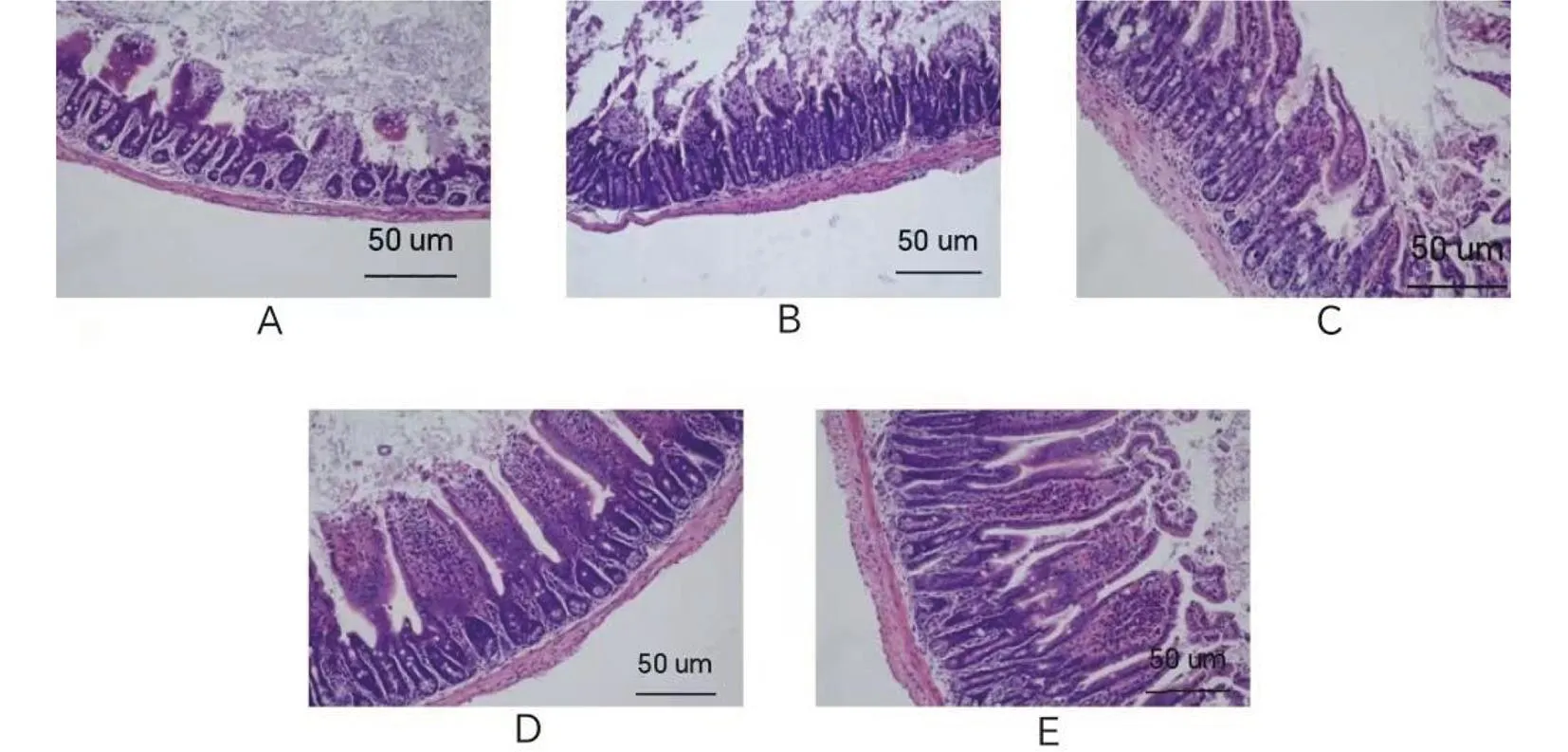
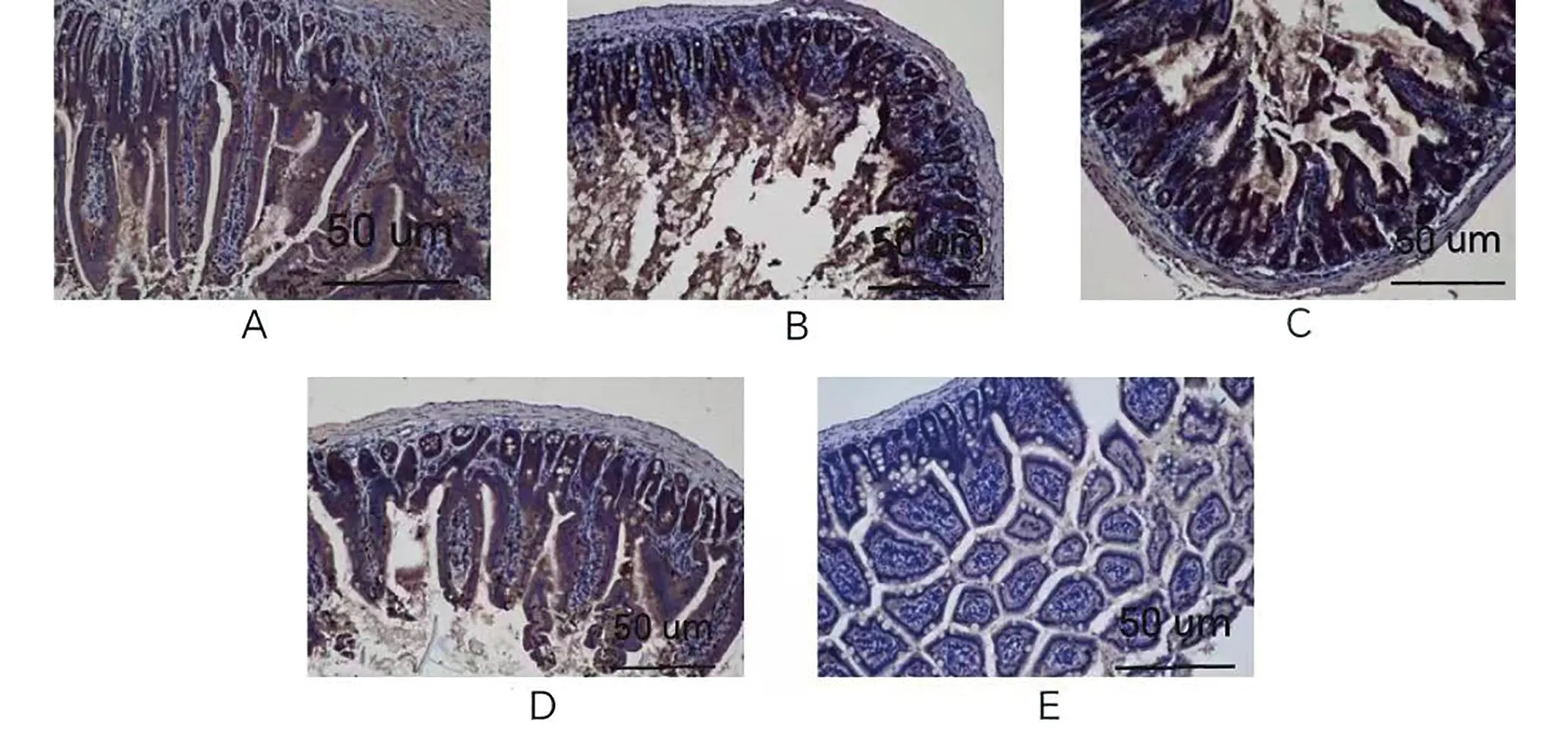
注:A.原液;B.10-1;C.10-2;D.10-3;E.对照。图2 不同稀释度下特勒凯比尔沙门氏菌接种的小鼠空肠组织HE染色(200×)Fig.2 HE staining of jejunum tissue in mice at different dilutions with Salmonella Telelkebir(200×)
对照组绒毛排列整齐,环壁、黏膜上皮正常。原液组、10-1组、10-2组绒毛断裂、脱落,肠壁变薄,黏膜上皮不同程度损伤,伴炎细胞浸润,10-3组肠壁变薄,伴炎细胞浸润。见图2。
2.4.2 空肠超微结构检查结果 肠黏膜上皮细胞轻微水肿,个别细胞器明显肿胀。微绒毛(MV)轻微水肿,上皮细胞紧密连接(TJ)、中间连接(ZA)可见,桥粒(De)存在,细胞间隙狭窄。细胞核(N)近似圆形,核周隙略微增宽,异染色质边集,核仁(Nu)居中。线粒体(M)数量一般,嵴轻度扩张。粗面内质网(RER)轻度扩张,表面可见核糖体附着。高尔基体(Go)囊膜轻中度扩张。胞内可见少量溶酶体(Ly)结构。见图3。
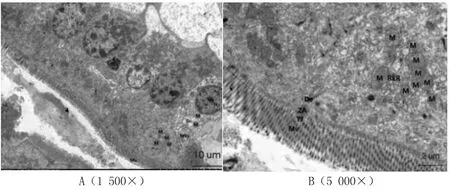
图3 10-2剂量组空肠超微结构检查结果Fig.3 The results of transmission electron microscopy of jejunum tissue of 10-2 group surviving mice
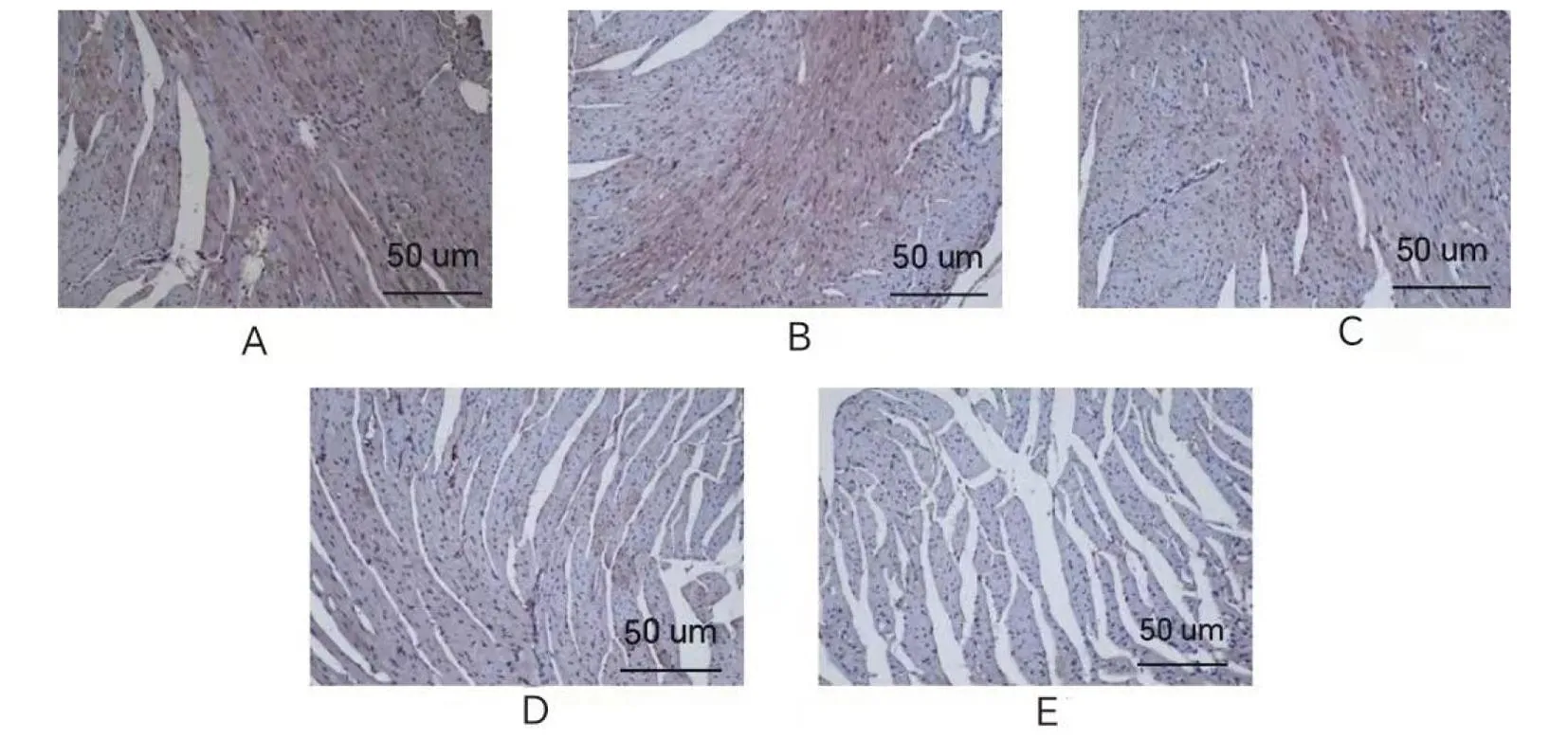
注:A.原液;B.10-1;C.10-2;D.10-3;E.对照。图4 不同稀释度下特勒凯比尔沙门氏菌接种的小鼠心脏组织免疫组化检测结果(200×)Fig.4 Immunohistochemical test results of mouse heart tissue at different dilutions with Salmonella Telelkebir(200×)
注:A.原液;B.10-1;C.10-2;D.10-3;E.对照。图5 不同稀释度下特勒凯比尔沙门氏菌接种的小鼠空肠组织免疫组化检测结果(200×)Fig.5 Immunohistochemical test results of mouse jejunum tissue at different dilutions with Salmonella Telelkebir(200×)
2.4.3 免疫组化检测结果 通过对小鼠组织中的CD3检测,与对照组相比,10-3、10-2、10-1、原液组中的CD3含量显著增多,且呈递增状态。见图4、图5。
2.5 感染后小鼠排菌周期检测结果 10-5、10-6剂量组排菌仅2周左右,而10-1~10-4剂量组排菌时间可超100 d,但排菌量逐渐下降,粪便油性呈褐色。喹诺酮药物干预后恢复正常。见表2。
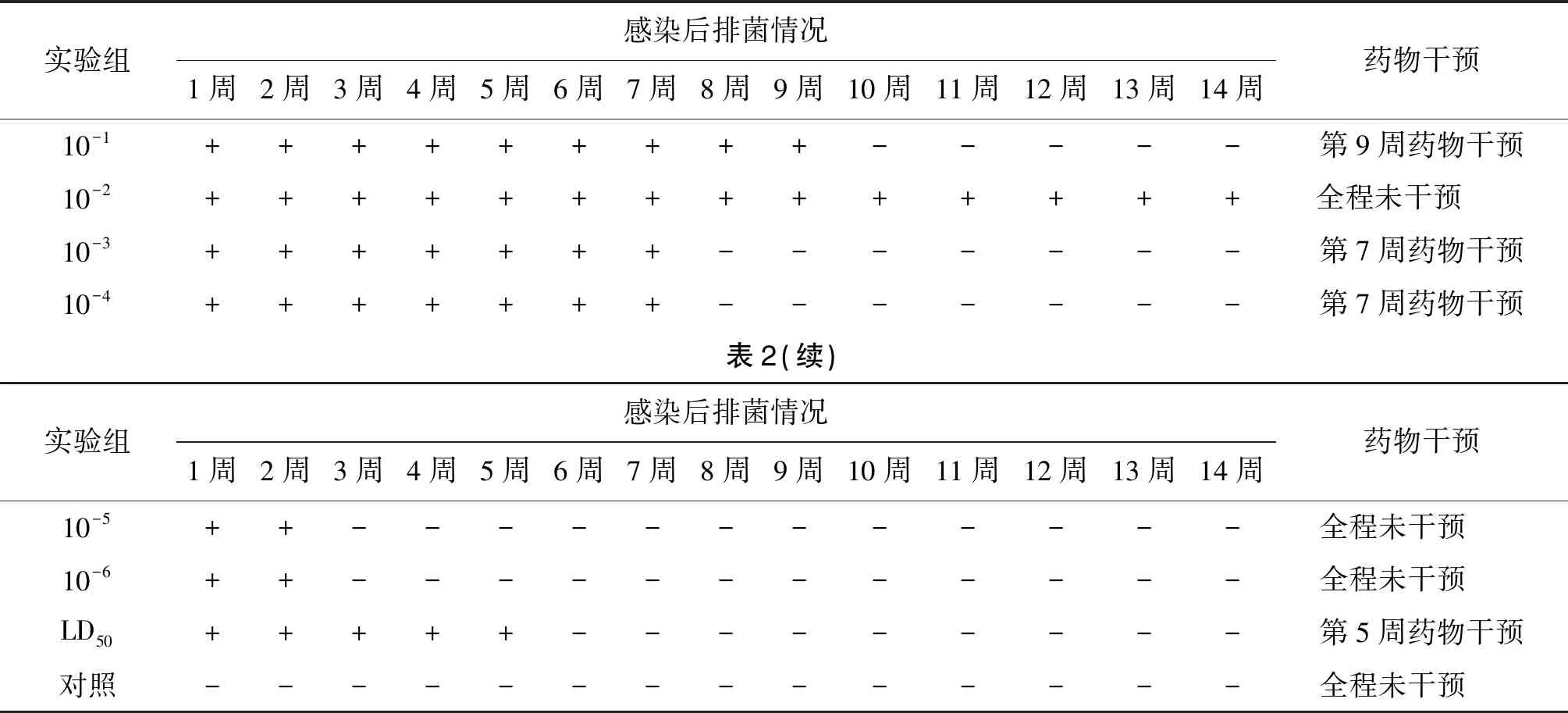
表2 感染后小鼠排菌周期检测结果Tab.2 Test results of bacterial excretion cycle of mice after infection
2.6 感染后小鼠相关组织细菌载量测定结果 小鼠脾脏、肾脏、肺脏、肝脏、空肠细菌载量感染后3 d达到高峰,而心脏第6 d达高峰,之后呈动态变化。见图6。
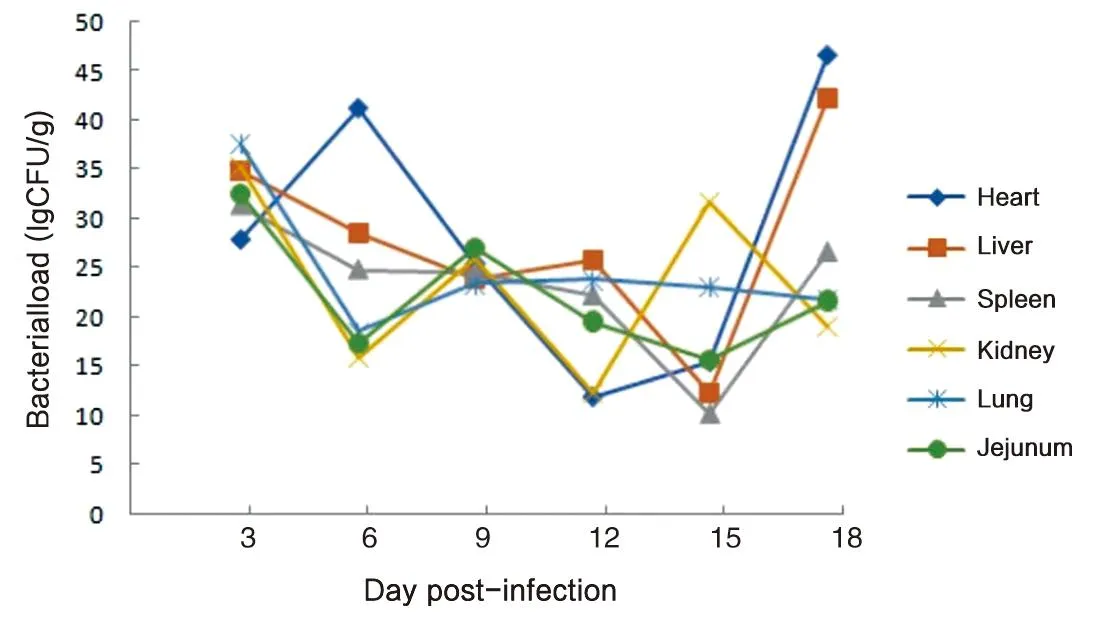
图6 感染后不同时间小鼠相关组织细菌载量(lgCFU/g)Fig.6 Bacterial load in related tissues of mice at different times after infection (lgCFU/g)
2.7 实验室评价结果
2.7.1 菌株分离与鉴定 小鼠粪便DHL平板培养均出现约1 mm左右中心黑色、周边半透明菌落。挑取典型单菌落进行全自动生化与飞行时间质谱鉴定,结果均为沙门菌属。进一步使用丹麦沙门菌诊断血清凝集实验确认为特勒凯比尔血清型。
2.7.2 PCR毒力基因检测 为确认感染小鼠后菌株的致病力没有改变,使用PCR扩增鼠源特勒凯比尔沙门菌cdtB、pltA和pltB3个毒力基因,结果与人源株一样具有3个毒力基因(图7)。
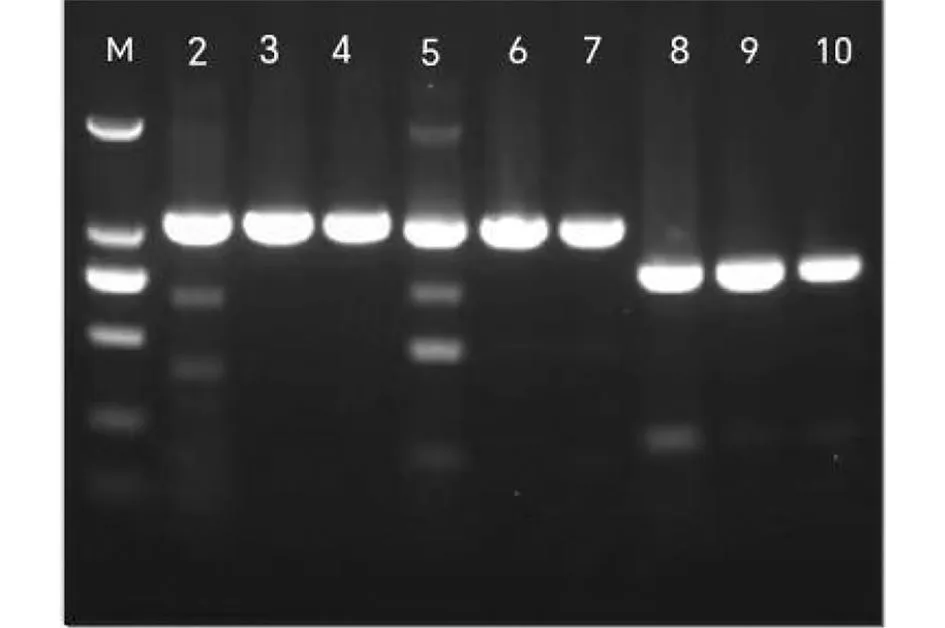
注:2、5、8分别为人源cdtB、pltA、pltB; 3-4、6-7、9-10分别为鼠源cdtB、pltA、pltB。图7 PCR毒力基因检测结果Fig.7 PCR virulence gene test results
2.8 全基因组测序和生物信息学初步分析 基因组组装结果显示菌株拥有唯一的环状染色体,大小为4 610 213 bp,GC含量52.22%(图8),无任何类型的质粒。NCBI注释表明基因组共含有4 432个基因,其中包含4 204个编码蛋白基因、110个假基因、22个rRNAs、84个tRNAs、12个ncRNAs和2个短重复序列(CP111029)。使用CGE ResFinder-4.1(标准参数设置,下同)发现菌株携带氨基糖苷类耐药aac(6′)-Iaa和磷霉素耐药基因fosA7,并且喹诺酮耐药决定区发生parC:p.T57S突变。使用CGE MLST-2.0 Server 鉴定该菌株为ST5494型,使用CGE SPIFinder 2.0预测沙门菌毒力岛(SPI),该菌株拥有SPI1-SPI5、SPI9、SPI13-14和1个未知SPI。把该菌基因组与细菌致病菌毒力因子(VFDB)数据库比对,发现存在cdtB、pltA、pltB、菌毛粘附决定因子基因、分泌系统基因等,其中pltA和pltB基因位于毒力岛SPI1上,cdtB、pltA、pltB3个基因与PCR检测结果一致。
3 讨 论
近年来,利用动物模型开展相关传染病研究日渐增多,对增强传染病流行病学特征研究发挥重要作用。雷占东等[6]以BALB/c小鼠为实验对象,采用灌胃方法接种御成门沙门菌,确定LD50为5×102CFU/mL。王伟等[7]以ICR小鼠为对象,采用灌胃法接种肠炎沙门菌,其LD50为1×105.67CFU/mL。研究表明,高剂量干预可能会突破宿主的免疫防疫系统,侵入到宿主各组织器官造成病理损伤,引起动物死亡。朱春红等[8]以BALB/c小鼠为对象,通过腹腔注射感染肠炎沙门菌,确定其LD50为19.95 CFU/mL。姚营等[9]研究发现,感染鼠伤寒沙门菌后,小鼠可诱发全身性的炎症反应;空肠黏膜下层出现严重的水肿和单核细胞炎性浸润;透射电镜显示肠道绒毛部分断裂,上皮细胞线粒体空泡化,嵴和膜消失;肠道淋巴细胞大量增殖。
本研究以ICR小鼠为实验对象,采用腹腔注射方式感染特勒凯比尔沙门菌,LD50为2.67×108CFU/mL。感染后0.5 h即可出现临床症状,卷缩、被毛松乱;死亡小鼠解剖发现小肠充血严重,可见较多气泡、积液,盲肠坏死,肝尖点状变性坏死,肾脏表面有坏死灶、肺脏局部坏死。实验组各组织均可见炎细胞浸润。实验组小鼠心肌毛细血管扩张充血;肝细胞大面积空泡变样,部分肝细胞变性、坏死,静脉内皮下轻度水肿,肝窦轻度扩张伴出血;脾窦扩张明显,分区模糊,部分区域纤维化明显;肾小球基膜增厚、毛细血管增生,肾小管扩张,管腔增大,肾小球不同程度萎缩;气管、纤毛上皮部分剥脱、气管黏膜皱嬖增多、变长;空肠组织绒毛断裂、萎缩、脱落、消失,肠壁变薄,黏液层、黏膜上皮不同程度损伤。对照组小鼠各组织均正常。免疫组化检测结果表明,随着感染剂量增大,小鼠组织中的CD3含量呈递增状态,免疫系统受到刺激和炎症反应愈加强烈。
本研究发现在急性感染时,小鼠脾脏萎缩变小,死亡小鼠脾脏更小,而恢复期小鼠脾脏变粗大。这与Mshelbwala FM等[10]研究结果明显不同。Mshelbwala FM等通过对尼日利亚3个州的家禽养殖场感染沙门菌死亡的鸡及14 d天小母鸡进行不同血清型沙门菌感染实验发现,无论是自然感染还是实验室感染,鸡的肝脏、脾脏、肾脏出现明显增大的病变过程,这种明显不同,应该与感染宿主、感染剂量有一定关系,宿主自身免疫状态是引起感染后果的原因。
聂晶晶等[11]研究发现,感染后24 h可在大鼠模型粪便中检出肠炎沙门菌,持续排菌时间为1~15 d不等。本研究10-1~10-4剂量组排菌时间持续100 d以上,无药物干预时动物呈现漫长的排菌过程,对动物影响趋小,成为“健康带菌者”,排菌时间越长,动物模型可利用周期也越长。在不同感染阶段采用喹诺酮药物对相关实验组成活小鼠进行治疗,剂量为20 IU/只,连用3 d,效果明显,第4 d起即停止排菌。而10-5~10-6剂量组小鼠感染后排菌时间仅持续10 d(表2)。不同感染时间的不同组织的细菌负荷以感染后第6 d的心脏最高,其次是肝脏。感染后死亡小鼠心脏平均细菌载量为46.59 lgCFU/g,高于存活小鼠心脏28.41 lgCFU/g(t=119.41,P<0.05);高于存活小鼠的肝脏34.76 lgCFU/g(t=15.56,P<0.05)。
Miki T等[12]使用链霉素小鼠模型对沙门氏菌结肠炎进行肠道内稳态研究,发现RegⅢβ可促进鼠伤寒沙门菌的持续肠道定殖,延长病程。RegⅢβ是一种杀菌凝集素,是由肠上皮细胞分泌到肠腔中的抗菌剂[13-14]。Kilroy S等[15]研究肠炎沙门菌鞭毛在母鸡输卵管定殖中的作用,发现缺乏功能性鞭毛的突变体在母鸡输卵管定殖的效率更高,通过下调肠炎沙门菌鞭毛蛋白来避免宿主免疫应答。这些可能都构成特勒凯比尔沙门菌长时间定殖小鼠体内的主要机制。
从全基因测序和PCR结果分析,特勒凯比尔沙门菌小鼠分离株与人分离株一样含有cdtB、pltA、pltB等沙门菌毒力因子。提示我们不能忽视较少报道的某些沙门菌血清型,它们也携带独特的毒力因子而导致不良的临床表现甚至死亡。程琼等[16]研究表明,不同沙门菌对小鼠致病力表现与其毒力基因的分布存在相关性,但病原体的致病力除了毒力基因还与其他因素有关,这有赖于后期对全基因组更深入的研究与分析,包括转录组分析等。
人分离株和LD50小鼠模型分离株DHL平板上生长菌落经飞行质谱鉴定均为Salmonellasp.,得分分别为2.24、2.08,均属极好的鉴定结果;生化鉴定结果两者完全一致,符合沙门菌特征,均为非常好的鉴定。说明在建模研究中排除了其它微生物影响,小鼠模型对特勒凯比尔沙门菌进行了准确的表达、反应。
毒力是一种复杂的表型,只有在宿主体内与病原体相互作用时才能充分表现出来[17]。本研究首次利用ICR小鼠建立特勒凯比尔沙门菌动物模型,再现了细菌感染、复制、宿主免疫和病理过程,证明了ICR小鼠特勒凯比尔沙门菌模型是成功的。该模型的建立,可为今后在体内水平加强特勒凯比尔沙门菌“单一”或“多重”耐药分子病理机制、产生机制研究,为噬菌体技术、抗耐药药物研发、益生菌研发、疫苗研发等提供有效的动物模型,同时为该血清型沙门菌的药物治疗、药效评价和生物学评价提供临床帮助。
利益冲突:无

