黔南州和贵阳市幽门螺杆菌临床菌株的耐药性、基因多样性及其与疾病的关系
张远远, 潘 科,糜孟衡,管玉祝,陆秋丹,郑 娟,张 晋,王天姝,刘 琦,陈峥宏
幽门螺杆菌(Helicobacterpylori,H.pylori)是一种螺旋状、革兰氏阴性细菌,在中国幽门螺杆菌平均感染率为40.66%,成人为43.45%[1]。近十几年来幽门螺杆菌的耐药率不断上升,并且不同地区耐药性差异较大。因此,定期进行区域性检测幽门螺杆菌对抗生素耐药性,可能成为指导个性化抗生素治疗的有效手段。幽门螺杆菌的致病性与几个毒力标志物有关,如细胞毒素相关蛋白基因A (Cytotoxin associated gene A,cagA)、 空泡样细胞毒素基因A(Vacuolating cytotoxin A gene,vacA)等[2]。还有一项调查研究显示在哥伦比亚有两类不同的人群, 他们分别生活在高海拔山区和低海拔海岸,研究者发现, 前者感染幽门螺杆菌后患胃癌的风险显著地高于后者[3],对两类人群及其感染幽门螺杆菌的遗传背景分析显示, 两类哥伦比亚人都是欧洲、非洲和美洲印第安祖先的混血后裔。另外,幽门螺杆菌存在异质性[4],并且幽门螺杆菌异质性的可能性越大,胃癌风险越高[5]。因此,研究幽门螺杆菌基因多态性在指导临床医生进行靶向治疗方面可能具有重要意义。
贵州省是经济和医疗相对滞后的省份,也是多民族聚居的省份。黔南州是布依族苗族自治州,该地居民保持自己的民族特点与生活习惯,患病后喜采用民族医药治疗及病后未及时就医的现象较贵阳市普遍。本研究目的是了解贵州省贵阳市和黔南州少数民族地区幽门螺杆菌的耐药性、基因多样性及其与临床疾病的关系。
1 材料与方法
1.1 材 料
1.1.1 病例和样本 胃黏膜样本来自于2018年1月到2021年10月期间黔南州人民医院和贵阳贵航医院消化科门诊或住院的上消化道疾病患者,包括:慢性非萎缩性胃炎(CNAG)、萎缩性胃炎(CAG)、消化性溃疡(PUD)、胃癌(GC)。所有患者均同意接受胃镜检查和胃镜下胃黏膜活检,活检用于组织病理检查、幽门螺杆菌培养和相关基因检测。
1.1.2 主要材料及仪器设备 幽门螺杆菌菌株26695 (山东大学齐鲁医学院病原生物学研究所馈赠);哥伦比亚琼脂培养基(杭州百思生物技术有限公司);MH琼脂培养基(杭州天和微生物试剂有限公司); 尿素酶试纸(珠海市克迪科技开发有限公司);E-TEST药敏试纸条:克 拉 霉 素(CLA)、阿 莫 西 林(AMX)、利福平(RFP)、四 环 素(TET)、环丙沙星(CIP)(意大利利飞驰);无菌脱纤维绵羊血(河南巨石生物科技有限公司);CO2恒温培养箱(赛默飞世尔科技有限公司);细菌基因组 DNA 提 取 试 剂 盒(北京天根生物工程有限公司);PCR扩增仪(赛默飞世尔科技公司);电泳仪(北京市六一仪器厂);凝胶成像分析仪 (北京百晶生物科技公司);冷冻高速离心机(赛默飞世尔科技有限公司);组织细胞破碎仪(天津杰灵仪器制造);选择性添加剂含两性霉素、头孢磺啶、万古霉素、甲氧苄氨嘧啶(英国,OXOID);抗生素混合液:萘啶酮酸、多粘菌素B和杆菌肽(北京索莱宝公司)。
1.1.3 幽门螺杆菌分离用培养基平板 选择性添加剂用前加灭菌ddH2O 2 mL充分混匀。取经高压蒸汽灭菌的哥伦比亚琼脂培养基100 mL,冷却至约60 ℃,加无菌脱纤维绵羊血8 mL和选择性添加剂440 μL,充分混匀后倾入平板中,凝固后备用。将萘啶酮酸、多粘菌素B和杆菌肽 3种抗生素标准品分别与灭菌ddH2O混合制成浓度为20 mg/mL的抗生素稀释液,取上述3种抗生素稀释液及灭菌ddH2O配制成1∶1∶1∶2比例的抗生素混合液,取抗生素混合液40 μL,用涂布棒均匀涂在选择性哥伦比亚血琼脂平板表面。
1.2 方 法
1.2.1 细菌的分离培养及鉴定 将胃黏膜破碎匀浆后涂布接种在幽门螺杆菌分离用培养基平板表面,然后CO2恒温培养箱(37 ℃、10% CO2、95%~100%相对湿度)[6]孵育3~5 d。通过革兰氏染色镜检、尿素酶试验、氧化酶试验、过氧化氢酶试验和幽门螺杆菌特异性16SrRNA基因片段PCR扩增来鉴定。16SrRNA基因PCR产物送生工生物技术有限公司测序,将序列在NCBI BLAST进行比对以鉴定物种。
1.2.2 药物敏感性试验 在已经高压灭菌好的5 mL玻璃试管中加入生理盐水1 mL,然后刮取幽门螺杆菌纯培养物到试管中充分混匀,用专用的麦氏2.0比浊管比浊配制成麦氏2.0的菌悬液,吸取150 μL菌悬液,用涂布棒均匀接种到MH血琼脂培养基血平板表面,将阿莫西林、克拉霉素、四环素、环丙沙星、利福平5种抗生素E-TEST试纸条分别放入血平板中间,于CO2恒温培养箱中放置3~5 d后观察结果。同时以敏感菌株幽门螺杆菌26695(质控菌株)对所配培养基及实验条件进行质量控制。耐药标准判断:阿莫西林最低抑菌浓度(Minimum inhibitory concentration,MIC)≥0.5 μg/mL、克拉霉素MIC≥1 μg/mL、四环素MIC≥2 μg/mL、利福平MIC≥1 μg/mL、环丙沙星MIC≥1 μg/mL[7-9]。对单一抗生素耐药的菌株为单一耐药株,对两种抗生素耐药的菌株为双重耐药株,对3种或3种以上抗生素耐药的菌株为多重耐药株。
1.2.3cagA、vacA基因鉴定、测序及分型 用于扩增cagA保守区和可变区以及vacA的引物[10-11]见表1。cagA保守区及vacA扩增条件为:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共35个循环。cagA可变区扩增条件为:94 ℃ 1 min,50 ℃ 1 min,72 ℃ 30 s,共35个循环。PCR产物在1.5%琼脂糖凝胶中电泳。cagA3′可变区片段PCR产物交由生工生物技术有限公司进行Sanger测序,使用生物软件DNAMAN将基因序列转化为氨基酸序列用于EPYIA分型[12]。
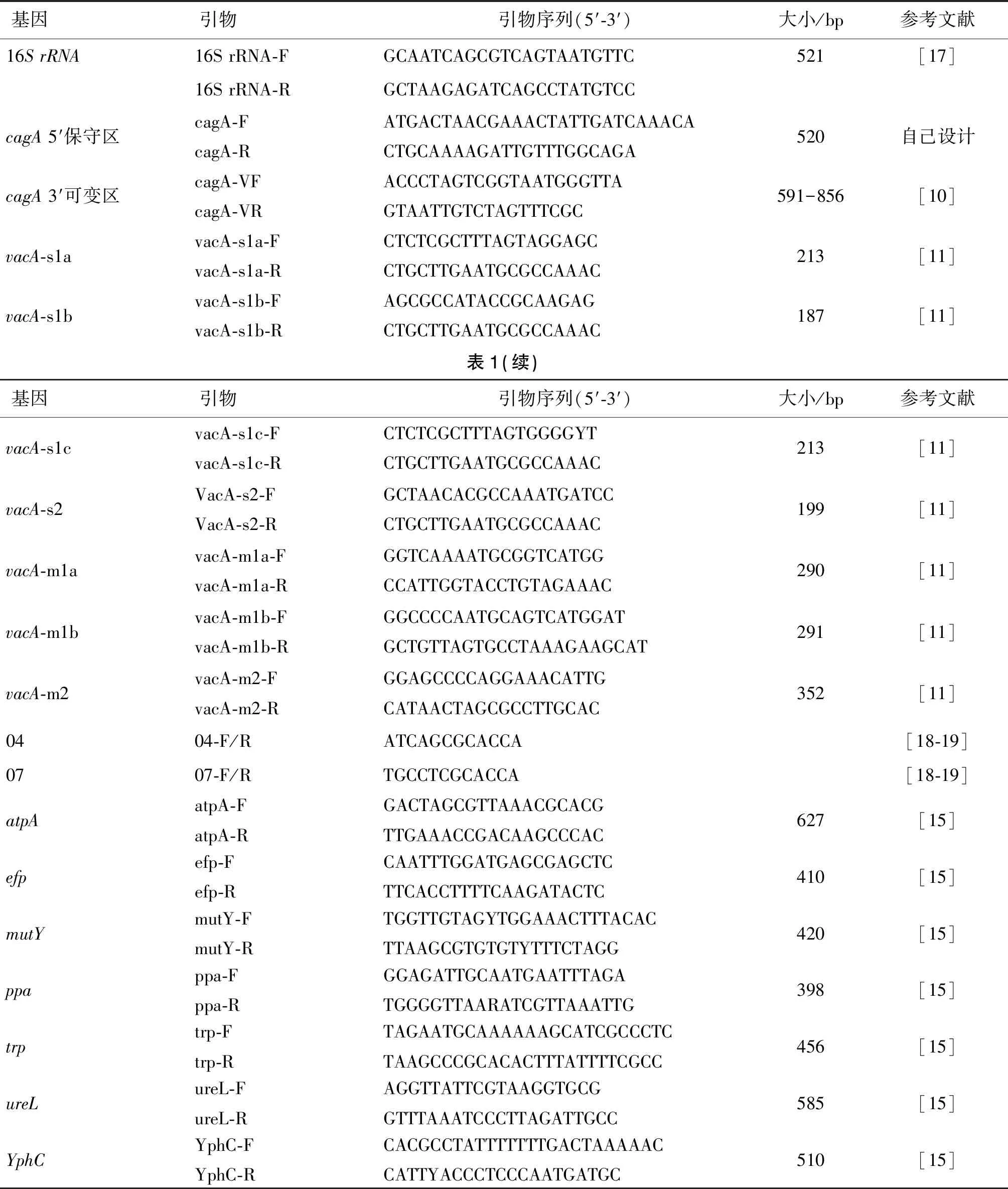
表1 聚合酶链式反应引物序列Tab.1 Polymerase chain reaction primer sequences
1.2.4 单一或混合感染的检测及临床分析 对从胃黏膜获得的幽门螺杆菌菌株在血琼脂平板上进行三区划线法,以获取单菌落。每株菌株随机挑取6个单菌落传代培养,以获得单克隆培养物,通过RAPD-PCR技术对6个单克隆培养物进行分型。用于扩增的随机引物04和07(表1)。扩增条件为:94 ℃ 2 min,38 ℃ 2 min,72 ℃ 2 min,共35个循环。PCR产物用1.0%琼脂糖凝胶电泳。相同的RAPD带型代表单一菌株的感染,而两种或多种RAPD带型表明不同菌型菌株感染[13-14]。
1.2.5 管家基因的检测及MLST分析 用atpA、efp、mutY、ppa、trpC、urel和yphC共7个管家基因引物[15]分别对黔南州29个和贵阳市27个幽门螺杆菌单克隆的DNA进行PCR扩增。扩增条件为:94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,共30个循环。PCR产物在1.5%琼脂糖凝胶中电泳。PCR产物测序后,将测序结果上传到PUBMLST(https://www.mlst.net/)网站进行比对,可以得到每个基因的等位基因号(Allele number),如果不能完全匹配上,则可上传原始测序文件给该网站管理者,经管理员审批后可得到新的等位基因号。然后再将每个菌株的7个等位基因号提交到网站上,如果不能完全匹配,则可能是新的序列型(sequence type,ST),经网站管理员审批后,对应的菌株会分配得到新的ST型及ID号。
1.2.6 多序列比对及系统发育树构建 首先通过MEGA 10.0软件将黔南州和贵阳市7个管家基因扩增产物的测序结果进行串联后进行两地区的多系列比对和系统发育分析[16],另外我们从PUBMLST网站下载不同地区的国际菌株的7个管家基因串联序列,我们也将黔南州和贵阳市两地区7个管家基因扩增产物的测序结果进行串联后与国际菌株进行多序列比对及系统发育分析。然后利用ITOL(https://itol.embl.de/)进行画图。
1.2.7 统计学分析 样本数据均采用SPSS 26.0软件进行数据处理和分析,所有样本数据均采用Fisher确切概率法检验,P<0.05为差异有统计学意义。
2 结 果
2.1 细菌分离培养及鉴定 通过分离培养、革兰氏染色镜检、尿素酶试验、氧化酶试验、过氧化氢酶试验及特异性PCR(16S rRNA)等鉴定,黔南州分离的幽门螺杆菌为44株(慢性非萎缩性胃炎19株,萎缩性胃炎12株,消化性溃疡12株,胃癌1株),贵阳市分离的幽门螺杆菌为40株(慢性非萎缩性胃炎17株,萎缩性胃炎7株,消化性溃疡16株)。
2.2 临床菌株对抗生素药物敏感试验。
2.2.1 药物敏感试验结果 黔南州地区分离培养出44株幽门螺杆菌,其中40株完成阿莫西林、克拉霉素、利福平、四环素、环丙沙星抗生素药物敏感试验(表2),另外4株因血平板污染未能完成药物敏感性试验;贵阳市分离培养的40株幽门螺杆菌的药敏检测部分结果见文献[4]。幽门螺杆菌 26695 MIC值为:阿莫西林 0.0625 μg/mL、克拉霉素0.125 μg/mL、四环素0.25 μg/mL、环丙沙星0.25 μg/mL、利福平0.25 μg/mL。
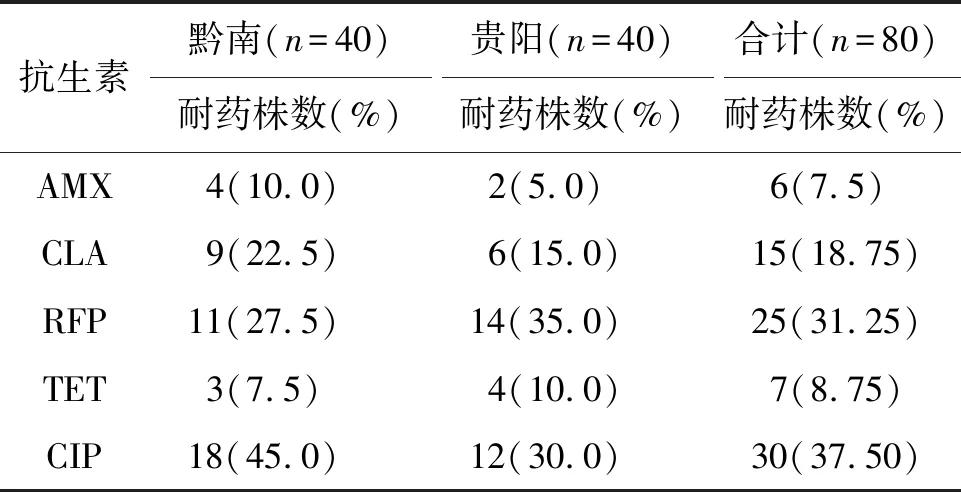
表2 黔南州和贵阳市临床幽门螺杆菌耐药率Tab.2 Results of antibiotic susceptibility test of Helicobacter pylori strains in Qiannan Prefecture and Guiyang City
2.2.2 分离自黔南州和贵阳不同临床疾病患者的幽门螺杆菌的耐药情况 黔南州单一、双重、三重、四重及全耐药率分别为32.5%(13/40)、10%(4/40)、12.5%(5/40)、2.5%(1/40)、2.5%(1/40),其中单一耐药率最高为环丙沙星,耐药率为17.5%(7/40),双重耐药率最高的组合是利福平和环丙沙星,耐药率为7.5%(3/40),三重耐药率最高的组合是利福平+克拉霉素+环丙沙星,耐药率为7.5%(3/40),四重耐药组合阿莫西林+克拉霉素+环丙沙星+利福平,耐药率为2.5%(1/40);双重耐药率和多重耐药率为27.5%(11/40)。贵阳市单一、双重、三重及四重耐药率分别为27.5%(11/40)、12.5%(5/40)、2.5%(1/40)、5%(2/40)、未检出全耐药幽门螺杆菌。贵阳市最高单一耐药率是利福平,耐药率为15%(6/40),最高双重耐药率组合是利福平和环丙沙星,耐药率为12.5%(5/40),三重耐药率组合是环丙沙星+四环素+利福平,耐药率都是2.5%(1/40),四重耐药组合阿莫西林+四环素+利福平+环丙沙星,耐药率为5%(2/40),双重耐药率和多重耐药率为20%(8/40))。两地区总的双重加多重耐药组合、单一耐药组合的耐药率分别为28.75%(23/80)、30%(24/80);两地区总的单一耐药及双重耐药分别是5种和2种,三重耐药3种,四重耐药2种,还有全耐药(Resistant to all antibiotics)及全敏感(Sensitive to all antibiotics)(表3)。根据地区分为黔南州、贵阳市两组,黔南州和贵阳市两地区幽门螺杆菌耐药率差异无统计学意义(P=0.092)(表3);根据病理检查结果分为慢性非萎缩性胃炎、萎缩性胃炎、消化性溃疡以及胃癌4组,不同疾病类型病人的菌株抗生素耐药率差异无统计学意义(P=0.228)(表3)。
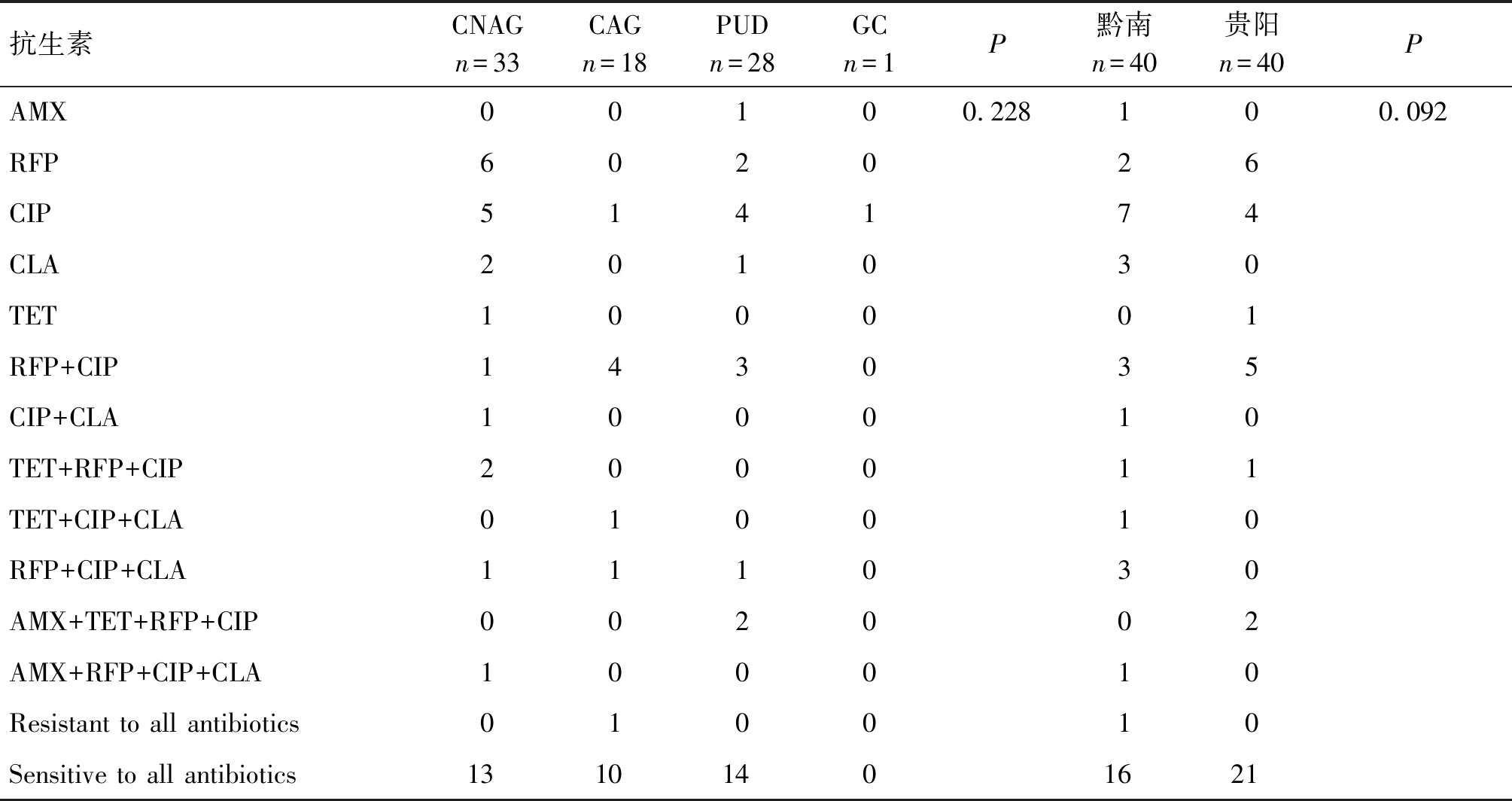
表3 分离自黔南州和贵阳市不同临床疾病患者的幽门螺杆菌的耐药情况Tab.3 Drug resistance of Helicobacter pylori isolated from patients with different clinical diseases in Qiannan Prefecture and Guiyang City
2.3cagA和vacA基因多态性 共84株幽门螺杆菌菌株检测了cagA和vacA基因。关于cagA基因多态性,通过PCR方法扩增cagA的羟基端保守区,大小在520 bp,所有菌株均检出cagA3′片段,分为8种cagA可变区EPIYA型,见表4。将地区分为黔南州、贵阳市两组,结果显示黔南州和贵阳市两地区cagA可变区EPIYA型构成比差异有统计学意义(P=0.012),见表4;慢性非萎缩性胃炎、萎缩性胃炎、消化性溃疡以及胃癌4组病人的菌株cagA可变区EPIYA型构成比差异无统计学意义(P=0.520),见表4。
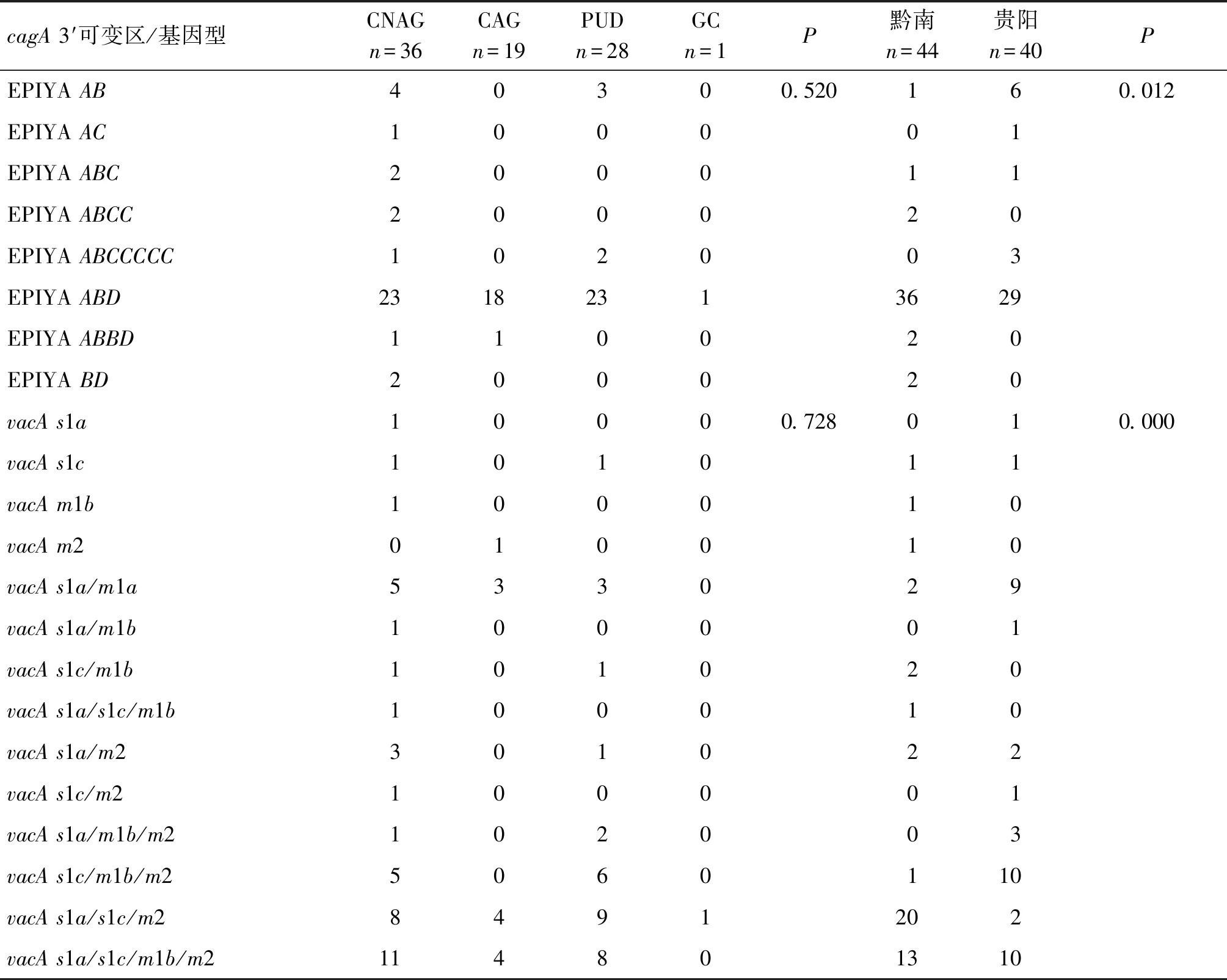
表4 分离自黔南州和贵阳市不同临床疾病患者幽门螺杆菌的毒力基因情况Tab.4 Virulence genes of Helicobacter pylori isolated from patients with different clinical diseases in Qiannan Prefecture and Guiyang City
关于vacA基因多态性, 84株幽门螺杆菌临床菌株vacA基因的信号区(s1a、s1b、s2)和中间区(m1a、m1b、m2)检测,分型结果见表4。其中包括混合型基因型:vacAs1a/s1c/m1b(1株),vacAs1a/m1b/m2(3株)、vacAs1c/m1b/m2(11株)、vacAs1a/s1c/m2(22株)、vacAs1a/s1c/m1b/m2 (23株),缺失m区型vacAs1a(1株)、vacAs1c(2株),缺失s区型vacAm1b(1株)、vacAm2(1株)。将地区分为黔南州、贵阳市两组,黔南州和贵阳市两地区各vacA基因型构成比差异有统计学意义(P=0.000),见表4;慢性非萎缩性胃炎、萎缩性胃炎、消化性溃疡以及胃癌4组病人的菌株vacA基因型构成比差异无统计学意义(P=0.728),见表4。
2.4 单一或混合感染的结果 黔南州共44株菌株有36株菌株分离培养了单菌落,得到单克隆培养物共216个,另外8株菌株由于传代后生长不良或污染未能获得单克隆培养物。贵阳市菌株单克隆实验结果见文献[4]。菌株指的是一种分离株或一组分离株,可通过表型特征或基因型特征或两者与相同属和种的其他分离株区分开来[20];单克隆指的是通过各种遗传方法(例如:脉冲场凝胶电泳、多位点酶电泳或核糖分型)彼此无法区分的分离物,或者相似以致于推测它们来自共同的亲本的分离物[20]。RAPD-PCR结果显示,从20株幽门螺杆菌中随机挑取的6个单菌落RAPD分型结果一致,则这20例为单一菌型菌株感染;另从16例样本分离的菌落中随机挑取的6个单菌落的RAPD分型结果存在差异,则为不同菌型菌株感染,感染率为44.4%(16/36)。根据病理检查结果分为慢性非萎缩性胃炎、萎缩性胃炎、消化性溃疡3组,幽门螺杆菌不同菌型混合感染率分别为16.6%(6/36)、13.9%(5/36)、13.9%(5/36), 3组病人的幽门螺杆菌不同菌型混合感染构成比差异无统计学意义(P=0.349),见表5。
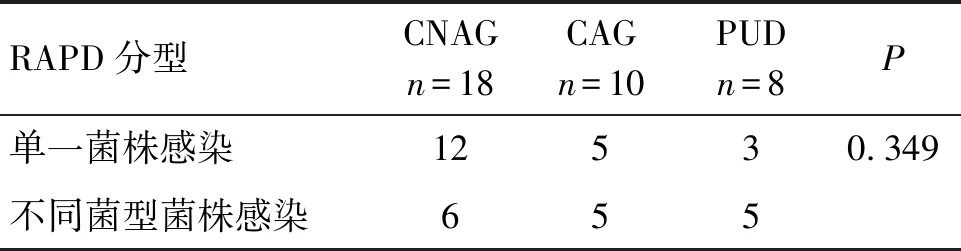
表5 黔南州疾病类型病人的幽门螺杆菌不同菌型混合感染情况Tab.5 Multiple infection by various strains in patients from Qiannan Prefecture with different disease types
2.5 MLST分析结果 上传了黔南州29株及贵阳市27株幽门螺杆菌的7个管家基因序列到PUBMLST网站,94.6%(53/56)的菌株为新的序列型,均是之前在幽门螺杆菌MLST数据库中未曾报道的,其中贵阳市27株均为新的序列型,黔南州89.6%(26/29)的菌株为新的序列型。
2.6 系统发育结果 基于黔南州及贵阳市幽门螺杆菌菌株的7个管家基因核心序列构建的系统发育树,黔南州和贵阳市聚类相对分散,并未出现明显聚集,说明并未按地理亲缘关系进行聚类(图1);根据慢性非萎缩胃炎、萎缩性胃炎、消化性溃疡、胃癌分组,在系统发育树上标注每株幽门螺杆菌菌株宿主患有的疾病类型,不同的疾病类型的菌株未出现明显聚集(图1)。从PUBMLST下载了94株不同国家的菌株序列,包括hpEastAsia 15株、hpMaori 15株、hpAfrica1 5株、hpAfrica2 5株、hpAsia2 15株、hpEurope 24株和hpSahul 15株,与黔南州29株及贵阳市27株临床分离株的7个管家基因序列构建系统发育树,黔南州93.1%(27/29)归类于hp EastAsia,6.9%(2/29)归类于hp Europe,贵阳市85.2%(23/27)归类于hp EastAsia,14.8%(4/27)归类于hp Europe,黔南州和贵阳市总的89.3%(50/56)归类于hpEastAsia,10.7%(6/56)归类于hp Europe,见图2。
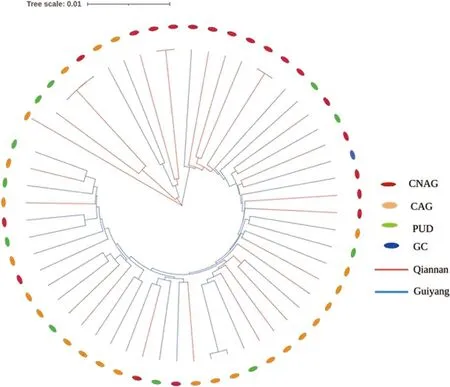
图1 基于56株幽门螺杆菌的7个管家基因核心序列构建的系统发育树Fig.1 Phylogenetic tree based on the core sequences of seven butler genes of 56 strains of Helicobacter pylori

注:hpEastAsia、hpAfrica1、hpAfrica2、hpAsia2、hpEurope、hpSahul、hpMaori分别代表各个国际菌株;Qiannan:黔南州菌株;Guiyang:贵阳市菌株。图2 黔南州及贵阳市幽门螺杆菌和国际菌株的系统发育树Fig.2 Phylogenetic tree of Helicobacter pylori and international strains isolated in Qiannan Prefecture and Guiyang City
3 讨 论
幽门螺杆菌感染和胃癌发病率关系密切[21],幽门螺杆菌感染的人数几乎占世界总人口的一半,中国平均感染率为40.66%,成人为43.45%,并且表现出地区和人群差异性[1,22]。
根除幽门螺杆菌是预防胃癌的有效措施,根除方案主要是:质子泵抑制剂+铋剂+2种抗生素[23],但是幽门螺杆菌耐药性增长速度降低了抗生素的有效性,并且表现出明显的地域差异性。本研究中黔南州和贵阳市这两个地区幽门螺杆菌对阿莫西林、克拉霉素、利福平、四环素及环丙沙星这5种抗生素耐药率,与国内外总体耐药情况有一定差别。克拉霉素的耐药率低于国内外平均水平和部分地区,可能原因是克拉霉素除了作为根除幽门螺杆菌一线药物以外,还可作为呼吸系统疾病治疗药物,这两个地区的人群优先选择了其他呼吸系统疾病治疗药物,而把克拉霉素排除在外了,但需进一步扩大样本量以进一步研究。本研究中环丙沙星和利福平耐药率高于全国平均水平及部分地区,环丙沙星耐药率高的可能原因是本地区人群中,环丙沙星作为喹诺酮类药物,常用于急性肠炎、不明原因急慢性腹泻等常用药物,其广泛使用可能引起该地区幽门螺杆菌感染人群对环丙沙星的耐药率高,利福平耐药率高较难理解,因为利福平作为广谱抗生素,是治疗结核常用药物,其副作用大,一般不在人群中普遍使用,但该地区耐药率却很高,所以不建议利福平作为根除幽门螺杆菌的备选药物。阿莫西林和四环素耐药率与国内外报道基本一致。
本研究结果发现两地区总的多重耐药率(包括双重耐药率+三重耐药率+四重耐药率+全耐药率)接近单一耐药率。幽门螺杆菌产生单一耐药与点突变有关,而多重耐药的机制主要包括:外排泵系统作用[24]、细胞膜渗透性改变[25]、细菌生物膜形成[24]。客观原因还可能与患者的依从性、当地经济、使用药物习惯、病人不规范服药以及选择质量差、生物利用度差的药物有关,造成反复感染而出现多重耐药情况。本次研究发现,不同临床疾病和不同地区与抗生素耐药之间都没有显著差异,其原因可能在于:1)实验采集样本量较小;2)黔南州和贵阳市地理位置相近,人群中滥用抗生素习惯也相近。
幽门螺杆菌是一种具有高度遗传多样性和地域多样性的微生物,有其独特的基因多态性。目前公认的不同地区之间幽门螺杆菌基因多态性的原因主要有两个,一是幽门螺杆菌菌株在不同区域的突变积累,二是幽门螺杆菌和它们宿主之间存在适应性进化选择[26]。
cagA作为幽门螺杆菌的重要毒力因子。根据cagA羟基端保守区将幽门螺杆菌分成2个亚类,即cagA阳性与cagA阴性,cagA阳性和严重的消化道疾病有关。本研究中黔南州和贵阳市幽门螺杆菌临床分离株cagA全部为阳性,与2018年本课题组报道的此地区的结果一致[27],也与国内和东亚不同地区报道结果一致,这可能是为什么东亚地区胃癌高发原因之一。
根据cagA羧基可变区按照EPIYA基序片段将幽门螺杆菌分为东亚型和西方型,通常西方型有1~5个EPIYA-C片段,而西方型由EPIYA-D片段替代EPIYA-C片段,CagA蛋白进入细胞后与酪氨酸磷酸酶2特异性结合,诱导细胞形态改变为呈“蜂鸟表型”[28],可引起细胞增殖和生长,严重时导致细胞癌变。东亚型CagA蛋白和酪氨酸磷酸酶2具有更高结合活性,所以东亚型更易引起癌症[29]。本研究根据上述EPIYA基序片段分型,共分出8种基因型,以东亚型为主,这与本课题组2018年研究的本地区[27]及中国其他地区研究结果基本一致[26]。另外,cagA可变区EPIYA分型及vacA基因型构成比在黔南州和贵阳市两地区存在差异。黔南州是布依族苗族自治州,少数民族人口占全州人口的 81.87%,其中布依族最多,该地区居民保持自己的民族特点与生活习惯,患病后喜采用民族医药进行治疗,而贵阳市是贵州省省会城市,其经济相对比较发达,这可能是两个地区cagA可变区EPIYA分型和vacA基因型构成比差异的原因。
幽门螺杆菌存在不同菌型混合感染的情况,并且不同地区不同菌型感染率不同,例如中国宁波为41%,突尼斯为48%,法国为5%[15,30]。有文献报道,幽门螺杆菌不同菌型混合感染的可能性越大,胃癌风险越高,通过对RAPD结果的分析,发现幽门螺杆菌分离株在胃癌高危人群中具有较高的遗传变异性[5]。混合感染增加患胃癌风险的可能原因有两点:第一,不同的幽门螺杆菌菌株在同一患者胃内容易产生重组进化,从而更易产生携带有更强毒素的菌株[31-32];第二,不同的幽门螺杆菌菌株药物敏感性有差异[5],使幽门螺杆菌难以根除或容易复发。 本研究中黔南州地区幽门螺杆菌不同菌型混合感染率与突尼斯[33]及宁波[15]结果相近,但在不同疾病类型分组间未发现明显差异,考虑可能与样本量小有关,未来我们将加大样本量以进行下一步研究。
幽门螺杆菌是目前遗传最为多样化的细菌物种之一[34]。其多样性多来自频繁的突变和重组,这为群体遗传分析提供了额外的信息。利用7个管家基因的 MLST 已鉴定出多个不同的幽门螺杆菌种群。有文献提出胃癌发病率地域上的差异与幽门螺杆菌菌株间的差异相关,如hpEastAsia菌株流行区域胃癌发病率高,而非洲的胃癌发病率非常低[33]。本研究检测了黔南州菌株及贵阳市菌株的管家基因序列,其中94.6%(53/56)的序列型(ST)是之前在数据库中未曾报道的,也说明幽门螺杆菌遗传多样化。从PUBMLST网站中下载得到不同基因型的国际菌株ST数据集,通过聚类分析显示本研究中分离的幽门螺杆菌大部分为hpEastAsia, 小部分为hpEurope,这与中国其他地方的发现一致[15,35]。前述提到的hpEastAsia菌株流行区胃癌发病率高,很多东亚地区,包括中国在内均属于胃癌高发地区,东亚包括中国大部分菌株归类hpEastAsia,这可能解释了胃癌发病率地域性差异的原因,有待进一步验证。本研究结果提示,黔南州和贵阳市两地区幽门螺杆菌耐药率无显著差异,但cagA可变区EPIYA分型和vacA基因型构成比有差异。通过vacA和cagA分型、RAPD分型及MLST分型的联合分析,可识别致病性幽门螺杆菌感染的高危患者,感染这种菌株的患者可以选择进行预防性抗菌治疗,以预防严重消化道疾病发生。
利益冲突:无
——黔南州老年大学校歌

