银耳多糖对力竭运动小鼠氧化性损伤所致疲劳的缓解作用
黄小兰,黄少波,邵 丽
(1.重庆对外经贸学院,重庆 401520;2.重庆市开州区中医院骨伤科,重庆 405400;3.重庆市开州区中医院儿科,重庆 405400)
随着人们追求健康意识的提高,通过锻炼来提高身体机能已成为大多数人的首选。适当的运动训练不仅能使身体更健康,还能改善睡眠和锻炼身体[1]。然而,许多人的运动强度不当,引起能量代谢(糖原等)失衡和代谢产物(脂质过氧化物、乳酸、氨、离子等)积累,从而导致运动疲劳的发生[2]。运动疲劳会进一步破坏体内氧化/抗氧化系统的平衡,并诱发一系列与疲劳相关的临床表现,包括失眠、抑郁、认知障碍等,这些破坏性损伤严重威胁着疲劳患者的健康和生活质量[3]。由于其复杂的发病机制,目前仍然无法获得有效的药物或策略来缓解疲劳。研究表明,氧化应激,即活性氧(ROS)生成和抗氧化能力之间的不平衡,被认为是疲劳的关键因素之一,力竭运动会引发ROS 的爆发,超过系统对ROS 解毒的能力,从而导致疲劳[4]。Nrf2 是一种重要的转录因子,调节细胞的氧化应激反应,是维持细胞氧化还原稳态的中心调节因子,在阻止氧化应激和维持组织和器官氧化还原状态的稳态方面发挥着至关重要的作用[5],因此,通过靶向Nrf2 去除过量的ROS 将是一种很有前途的预防疲劳的有效策略,而天然抗氧化剂之所以受到关注,是因为其惊人的抗氧化能力和安全性。
银耳是一种食用菌,具有多种生物学功能,包括免疫调节、抗癌、降血脂和降血糖等作用[6]。研究表明,采用不同剂量荞麦银耳连续灌胃小鼠30 d 后,均可延长小鼠负重游泳时间,提高小鼠肝糖原含量,减少血清尿素氮的产生[7]。近年来,许多研究表明银耳的活性成分是多糖,而且银耳多糖(Tremella fuciformispolysaccharides,TFP)存在一定的抗氧化和抗炎作用[8]。已有研究显示,银耳多糖处理人真皮成纤维细胞可以抑制细胞中ROS 的增加。体外研究表明,银耳多糖可以清除各种自由基,如超氧化物、羟基自由基等[7],能有效降低非酒精性脂肪性肝病大鼠模型体内炎症水平[9]。然而,对TFP 在运动过程中对氧化应激和炎症启动的调节中的作用知之甚少。已有文献报道珍珠菇、杏鲍菇多糖能通过减轻氧化应激发挥抗疲劳作用[10-11],本研究假设TFP 可能对减轻力竭运动后的氧化损伤有效,采用TFP 预处理小鼠,并通过游泳运动建立力竭运动小鼠模型,探讨TFP 对力竭性运动诱导的氧化损伤的影响及其潜在的分子机制,以期为银耳多糖的药理研究做理论参考。
1 材料与方法
1.1 材料与仪器
雄性C57BL/6 小鼠 SPF 级,18~22 g,4 周龄,中国科学院上海动物实验中心,动物合格证号SCXK(沪)2017-0005,每笼10 只,12 h 的明暗循环,以标准啮齿动物饮食和自来水进行喂养,并保持在恒定的环境温度(23±1 ℃)、湿度(55%±5%),动物伦理委员会批准该实验程序(批准号:2021-0312);L6 大鼠骨骼肌细胞 齐氏生物科技有限公司(江阴市,中国),在含有10%胎牛血清和1%青霉素-链霉素的GIBCO DMEM 高糖培养基中,在37±2 ℃和5% CO2下培养;银耳 重庆市玉屏菜市场;试剂盒LA、BUN、ROS、SOD、MDA、GSH-Px、TNF-α、IL-6 南京建成生物工程研究所;兔抗Nrf2、NQO1、HO-1、β-actin、HRP 标记的羊抗兔IgG 二抗 碧云天生物技术有限公司。
DMIL LED 莱卡倒置荧光显微镜 德国徕卡公司;BIO-RAD 伯乐电泳成像系统 美国BIO-RAD公司。
1.2 实验方法
1.2.1 银耳多糖的提取 准确称取干燥粉碎且过40 目的银耳粉末,按照1:20 的物料比(w/v)加入蒸馏水,将样品在100 ℃沸水中煎煮3 次,每次3 h,合并滤液,浓缩样品,向浓缩液中加入无水乙醇,并使其终浓度为80%,离心(4000 r/min,4 ℃)15 min,收集沉淀物,丙酮洗涤三次,干燥,得到粗多糖。将其溶解在蒸馏水中至浓度为10 mg/mL,将溶液转移到透析袋中,透析48 h,6 h 换水一次,减压浓缩,与1/3 体积的Sevag 试剂(氯仿/正丁醇4:1,v/v)混合,搅拌30 min,3500 r/min 离心10 min,重复脱蛋白3 次。所得溶液浓缩至1/4 体积,D101 大孔树脂纯化,蒸馏水洗脱,收集滤液,浓缩、冷冻干燥得到银耳多糖,苯酚-浓硫酸法检测银耳多糖含量为92.48%,其主要成分为甘露糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖和岩藻糖[12]。
1.2.2 细胞活力测定 将L6 细胞接种到96 孔板(1×104个/孔)中,采用终浓度分别为0、50、100、200、400 µg/mL 的TFP 处理48 h,更换110 µL(CCK-8 10 µL+培养基100 µL)培养基,5% CO2中37 ℃下孵育1.5 h,酶标仪450 nm 测定吸光度值,计算细胞活力。细胞活力(%)=(A给药-A空白)/(A对照-A空白)×100。
1.2.3 LA 水平检测 将L6 细胞(1×104个/孔)接种在96 孔板,设置3 组,包括对照组、H2O2(200 µmol/L,预实验获得)组、H2O2(200 µmol/L)+TFP(100µg/mL)组,5% CO2中37 ℃下孵育 48 h,按照LA试剂盒说明书要求检测上清中LA 的水平。
1.2.4 Western blot 实验 将L6 细胞(1×105个/mL)接种在6 孔板,参照“1.2.3”分组,孵育48 h,采用RIPA 裂解液裂解细胞,BCA 法检测蛋白质水平,将蛋白质(30 µg)转移在每个泳道中,SDS-PAGE 分离蛋白,并转移到PVDF 膜上。在室温下用5%脱脂奶封闭1 h 后,用抗Nrf2(1:1000)、血红素加氧酶-1(HO-1,1:10000)、NADPH 醌氧化还原酶-1(NQO-1,1:1000)、β-肌动蛋白(1:2000)一抗孵育,4 ℃过夜。TBST 洗涤三次,二抗(1:1000)在室温下孵育1 h,用TBST 清洗三次,增强化学发光溶液(ECL)处理条带,Image J 软件分析蛋白条带。
1.2.5 动物分组及给药 C57BL/6 小鼠适应性喂养一周后,随机分为五组,即安静组、模型组、TFP 组(50、100、200 mg/kg,预实验确定剂量),每组10 只,TFP 组连续灌胃TFP,模型组灌胃相同剂量的蒸馏水,每天1 次,连续2 周。
1.2.6 力竭运动实验 动物实验通过重庆对外经贸学院实验动物福利伦理审查(编号:CSDW2022 005)。除了安静组,其余各组小鼠进行力竭游泳运动,游泳池(90×45×45 cm),装满水,温度保持在36±2 ℃,水深35 cm。小鼠最初适应游泳训练,每天20 min,持续3 d。末次给药30 min 后进行力竭运动:小鼠尾巴上附重(其体重的3%)游泳,通过观察协调运动的中断和游泳失败来确定疲劳。当小鼠未能在3 s 内返回表面呼吸时,立即记录耐受时间,从眼窦静脉丛取血,并以3000×g、4 ℃离心10 min 分离血清。然后,用戊巴比妥钠(50 mg/kg)腹膜内麻醉小鼠,处死小鼠,收集肝脏和骨骼肌并将其储存在-80 ℃。
1.2.7 指标的检测 肝脏或骨骼肌采用PBS(0.1 mol/L,pH7.4)匀浆,将样品3000×g、4 ℃离心10 min 分离上清,酶联免疫吸附试验(ELISA)检测肝糖原(LG)、骨骼肌糖原(MG);取血清,ELISA 法检测血清中尿素氮(BUN)、乳酸(LA)、ROS、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、TNF-α、IL-6 和NF-κBp65 水平。Western blot 实验检测Nrf2、HO-1、NQO-1 蛋白表达水平。
1.3 数据处理
所有数值均以均数±标准差表示。采用Graph Pad Prism(5.0 版)进行统计分析,采用单因素方差分析。P<0.05 为差异显著。
2 结果与分析
2.1 银耳多糖对L6 细胞活力及外源性H2O2 诱导的氧化应激的影响
为了探索TFP 对L6 细胞活力的影响,本研究进行了细胞活力测定,发现高达400 µg/mL TFP 未观察到细胞毒性(图1A)。因此,在随后的实验中使用了100 µg/mL TFP(预实验获得)进行试验。

图1 银耳多糖对L6 细胞活力及外源性H2O2 诱导的氧化应激的影响Fig.1 Effect of Tremella fuciformis polysaccharides on L6 cell viability and oxidative stress induced by exogenous H2O2
图1B 显示,L6 细胞内加入H2O2后,H2O2组培养液中LA 水平明显增加,说明该组细胞已经出现LA 外漏,在加入TFP 后,细胞培养液的LA 水平明显下调,说明TFP 能够减少LA 的外漏,拮抗H2O2所致的氧化损伤。研究显示,Nrf2/HO-1 信号通路的激活可以抑制氧化应激[13]。Nrf2 作为一种转录相关因子,在细胞自我保护中发挥重要作用,是氧化应激反应的关键调节因子。正常情况下,Nrf2 稳定存在于细胞质中,氧化应激发生时,Nrf2 进入细胞核,从而作用于HO-1,从而启动下游蛋白的表达,抵抗氧化应激所致的毒性作用[14]。本研究表明,H2O2+TFP组Nrf2、HO-1、NQO-1 蛋白水平极显著(P<0.01)低于H2O2组(图1C、图1D),说明TFP 可能通过激活Nrf2/HO-1 信号通路抑制氧化应激的表达,减少氧化应激损伤。
2.2 银耳多糖对小鼠力竭游泳的影响
力竭游泳时间可以直接反映运动能力以及药物的抗疲劳效果[15],本研究评估了银耳多糖对小鼠力竭游泳时间。结果显示,银耳多糖延长了力竭游泳时间(图2A),表明银耳多糖具有有效的抗疲劳作用。此外,疲劳期间有一系列生物标志物会发生变化,包括LA、BUN、肝糖原和肌糖原。其中,LA 是身体运动过程中产生的废物,而力竭运动会导致血液中LA 增加[16]。BUN 是人类蛋白质代谢的主要终产物,其含量与运动性疲劳呈正相关,即BUN 消除得越快,疲劳缓解得越快[17]。

图2 银耳多糖对小鼠力竭游泳的影响Fig.2 Effect of Tremella fuciformis polysaccharides on exhaustive swimming in mice
此外,肌糖原是糖在肌肉中的储存形式,反映了能量储备,而肝糖原负责剧烈运动期间的直接能量供应[18]。本研究结果显示,与安静组比较,模型组LA、BUN 极显著(P<0.01)增加,肝糖原、肌糖原极显著(P<0.01)降低,说明力竭运动所致疲劳模型建立成功。与模型组比较,TFP 组(50、100、200 mg/kg)LA(P<0.01)和BUN(P<0.05,P<0.01)的水平显著降低,肝糖原和肌糖原的含量显著(P<0.05,P<0.01)增加(图2B~图2E);这些结果表明,银耳多糖不仅能加速有害代谢产物的消除,还能恢复身体能量,从而缓解疲劳。
2.3 银耳多糖对力竭游泳的小鼠氧化应激水平影响
SOD 调节氧化应激和自由基,MDA 反映氧化应激的程度,ROS 是一种化学活性物质,由氧分子组成,包括氧自由基、羟基自由基、过氧化氢[19]。在生理条件下,身体会产生一定量的ROS,这些ROS 会被体内的SOD 和GSH-Px 等抗氧化剂清除,以阻止氧化损伤;然而,在疲劳等病理条件下,抗氧化酶的活性会受到阻碍,多余的ROS 会积聚,MDA 水平也会升高[20]。有规律的体育锻炼已被证明可以增加人类和动物血液和组织中的抗氧化酶活性,这可归因于一种补偿反应,以抵消与氧化应激相关的可能有害影响。然而,其他研究报告称,剧烈运动会导致血液和组织中抗氧化酶活性急剧下降,而且过度的氧化应激会导致疲劳[21],因此本研究研究了TFP 对小鼠力竭性运动诱导的氧化应激的影响。本研究结果显示,与安静组比较,模型组ROS、MDA 极显著(P<0.01)增加,SOD、GSH-Px 极显著降低(P<0.01),说明力竭运动所致小鼠体内抗氧化系统出现紊乱。与模型组比较,TFP 组(50、100、200 mg/kg)ROS(P<0.01)、MDA(P<0.05,P<0.01)的水 平显著降低,SOD、GSH-Px 的含量显著(P<0.01)增加(图3A~图3D),这些结果表明,TFP 的抗疲劳作用与其显著的抗氧化特性有关。

图3 银耳多糖对力竭游泳的小鼠氧化应激水平影响Fig.3 Effect of Tremella fuciformis polysaccharides on oxidative stress levels in mice after exhaustive swimming
2.4 银耳多糖对力竭游泳的小鼠的炎症水平的影响
本研究中,模型组小鼠血清中NF-κB 被激活,导致炎症因子过度分泌。TFP 的干预可以抑制NFκBp65 的表达(图4B),进而抑制TNF-α、IL-6 的炎症指标(图4A、图4C),这与其他的研究结果一致[22],NF-κB 的激活可刺激TNF-α、IL-6 等炎症因子的表达,加重机体组织损伤。研究表明,炎症和氧化应激相互作用,持续的氧化应激导致炎症的发展,炎症进一步促进大量氧自由基的产生,导致身体失衡[23]。本研究结果显示,本研究结果显示,与安静组比较,模型组NF-κB、TNF-α、IL-6 的炎症指数极显著(P<0.01)升高,提示模型组小鼠存在炎症损伤。与模型组比较,TFP 组(50、100、200 mg/kg)NF-κB、TNF-α、IL-6 的水平极显著(P<0.01)降低(图4A~图4C),提示TFP 可能对氧化应激和炎症水平具有较好的调节作用。
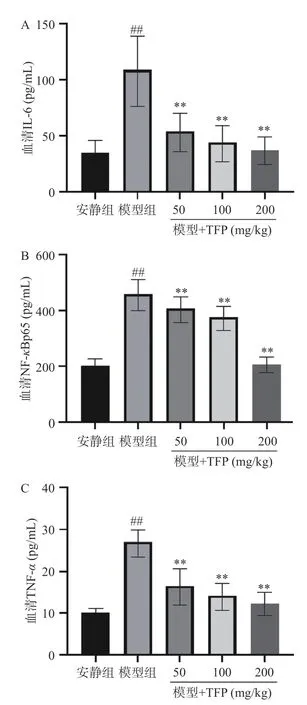
图4 银耳多糖对力竭游泳的小鼠的炎症水平的影响Fig.4 Effect of Tremella fuciformis polysaccharides on inflammation levels in exhausted swimming mice
2.5 银耳多糖对力竭游泳的小鼠的Nrf2/HO-1 信号通路的影响
研究显示,Nrf2 信号通路与过度运动诱导的疲劳氧化损伤有关。在氧化还原稳态下,Nrf2 与细胞质中的kelch 样ECH 相关蛋白1(Keap1)结合,以保持失活状态。相反,在氧化应激刺激下,Nrf2 从Keap1 解离,然后转移到细胞核,引起下游基因的激活,包括HO-1、NQO-1[24]。因此,开发新的药物或策略,通过调节Nrf2 信号通路来延缓疲劳的产生和/或促进疲劳的消除,具有重要意义[25]。本研究结果表明,与安静组比较,模型组Nrf2、HO-1 和NQO-1 蛋白质水平极显著(P<0.01)降低。与模型组比较,TFP 组(50、100、200 mg/kg)Nrf2、HO-1 和NQO-1的水平显著(P<0.05,P<0.01)增加(图5A~图5B),这些发现表明,TFP 促进Nrf2 蛋白表达,从而激活其下游的HO-1、NQO-1。
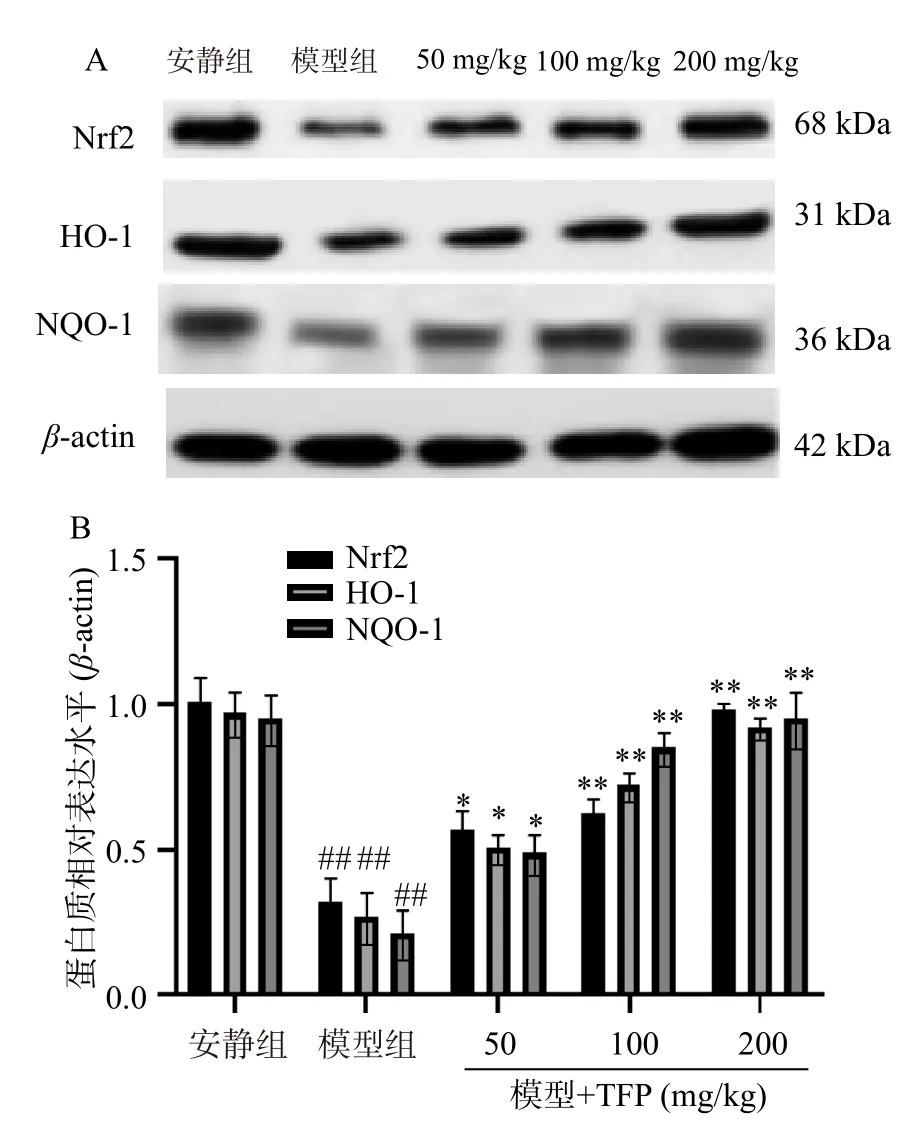
图5 银耳多糖对力竭游泳的小鼠的Nrf2/ HO-1 信号通路的影响Fig.5 Effect of Tremella fuciformis polysaccharides on the Nrf2/HO-1 signaling pathway in exhausted swimming mice
3 讨论与结论
过度训练或高强度运动易导致疲劳的发生,身体活动不再是自发的,这也会增加ROS 的产生,加重疲劳。在营养物质的生成和能量消耗过程中,ROS 的过量产生会诱导氧化应激,导致疲劳诱导物质的产生[26]。在本研究中,我们发现TFP 有效地保护了外源性H2O2刺激的L6 细胞,并且ROS 的产生在所有动物实验组中显著降低(P<0.05,P<0.01)。因此,本研究认为TFP 调节ROS 的清除。由于游泳力竭时间指标可以直接反映运动能力以及药物的抗疲劳效果,本研究评估了TFP 对力竭游泳时间的影响。结果表明,TFP 延长了力竭游泳时间,表明TFP具有有效的抗疲劳作用。此外,还研究了给药后TFP 是否能有效地作为抗疲劳剂。由于BUN 和血乳酸水平是与线粒体功能相关的生化指标,而氧化应激与能量产生有关[27]。在本研究中,给药组的小鼠的BUN 和乳酸水平明显下调,说明TFP 能调节线粒体代谢。
氧化应激是疲劳损伤的主要机制之一,ROS 的大量产生将导致抗氧化防御能力的破坏或消耗,增加MDA 水平。SOD、GSH-Px 作为一种重要的抗氧化酶,在清除超氧化物自由基和抵抗氧化应激方面发挥着关键作用[28]。MDA 是细胞膜上的一种识别受体,自由基的产生与MDA 密切相关[29]。本研究结果表明,TFP 下调ROS、MDA 水平,上调SOD、GSHPx 的表达,证实TFP 对运动性损伤的改善作用与其通过增强抗氧化酶活性而清除自由基的作用有关。该研究的数据还表明,用TFP 处理可以显著增加Nrf2 水平,上调下游HO-1 的表达,表明TFP 具有显著的抗氧化应激作用。Nrf2/HO-1 信号通路的激活可以抑制氧化应激,Nrf2 作为一种转录相关因子,在细胞自我保护中发挥重要作用,是氧化应激反应的关键调节因子[30]。本研究表明,TFP 可能通过激活Nrf2/HO-1 信号通路抑制氧化应激蛋白MDA 的表达,从而有效抵抗氧化应激损伤。研究显示,自由基的增加可能导致炎症的发展[31]。在本研究中,模型组MDA 的脂质过氧化水平高于对照组,TFP 处理组表现出较低的脂质过氧化水平,增加Nrf2/HO-1 的活性,抑制NF-κB、TNF-α、IL-6 的表达,减缓炎症损伤这,这些都说明TFP 可抑制氧化应激,进而抑制炎症反应。
总之,TFP 改善了H2O2刺激的L6 细胞中的线粒体功能障碍和氧化应激。而且TFP 能通过介导Nrf2/HO-1 信号通路有效缓解小鼠的力竭性运动诱导的氧化损伤。这些发现表明,TFP 可以作为一种潜在的新型天然抗氧化剂,可以延缓疲劳。

