谷氨酰胺、姜黄素组方对酒精性胃粘膜损伤的保护作用
陆海霞,徐 莹,潘美辰,唐天培,赵建云,葛 磊
(杭州娃哈哈集团有限公司,浙江省食品生物工程重点实验室,浙江杭州 310018)
慢性胃炎在胃病类型中占比排名第一,初期临床表现上有腹痛、饱胀等,如果不加控制导致病情进一步发展,则会出现出血、穿孔、癌变等并发症[1-2]。多数慢性胃炎患者都有不同程度的胃粘膜损伤。作为“酒文化”盛行国家,我国由乙醇引发胃粘膜损伤进而演变为慢性胃炎患者不在少数[3]。乙醇具有脂溶性特性,在其进入体内被代谢时,能促进中性粒免疫细胞释放氧自由基的过程,导致胃黏膜出现组织损伤、微循环障碍、损伤愈合变慢等现象。接着通过呼吸爆发,使上述过程持续反复进行,最终导致胃粘膜损伤[4]。目前用于治疗胃粘膜损伤药物主要为质子泵抑制剂类、组胺H2 受体阻滞剂,作用通路较为单一,且长期使用会出现耐药性情况。
通过检索国家市场监督管理总局特殊食品信息查询平台注册保健食品批件数据库[5],发现截至2022 年7 月,获得具有辅助胃粘膜保护功能批件保健食品共计77 个。从使用原料来看,基本都为传统中药成分,其中砂仁、蜂胶、党参、葛根使用率较高,频率分别20%、17.6%、16.2%和16.2%;从主要功效成分来看,主要是粗多糖、总黄酮和总皂苷,占比分别为33.8%、31.1%和21.6%。整体来看,目前已有产品同质性较高,主要依据传统中医药理论设计。
传统中药靶点复杂,作用机制不够明确,且大多非药食两用;而西药则作用通路较为单一,且长期使用会出现耐药性情况。因此,从天然原料中寻找具有明确功效原料组方并将其应用于相关产品中,适用范围更为广泛。通过查询文献、咨询专家等方式确定谷氨酰胺与姜黄素搭配组方,推测其对由乙醇引发胃粘膜损伤发生有极佳抑制作用。谷氨酰胺能够增加防御因子粘液分泌,促进粘膜细胞连接紧密,加快上皮细胞修复和生长作用实现胃粘膜保护[6-8];姜黄素能增加胃粘膜血流量[9-10]、减少胃粘膜氧化应激和炎性因子表达[11-12],从而减轻胃粘膜损伤。根据国食药检保化[2012]107 号《关于印发抗氧化功能评价等9 个保健功能评价方法》中辅助胃粘膜保护功能动物实验要求,本文验证谷氨酰胺与姜黄素组方功效,并探索其作用机制,实现组方功效、靶点明确,为今后将其应用于功能食品或保健食品打好理论基石。
1 材料与方法
1.1 材料与仪器
SD 大鼠 SPF 级,健康雄性,体质量180~220 g,共50 只,上海斯莱康实验动物有限责任公司提供,实验动物许可证号码:SCK(沪)2017-0005;谷氨酰胺河北力维素科技有限公司提供;姜黄素 河南中大恒源生物科技股份有限公司提供;MDA、NO、GSH-Px、PGE2试剂盒 碧云天生物技术有限公司提供;PCR 引物、逆转录酶试剂盒 由苏州金唯智生物技术有限公司提供。
HistoCore PEARL 自动组织脱水机、HistoCore Arcadia 全自动包埋机、Leica RM2125RTS 手动轮转式切片机 美国徕卡公司;CX23 生物显微镜 日本Olympus 公司;7900HT Fast Real-Time PCR 仪美国ABI 公司。
1.2 实验方法
1.2.1 分组及给药 SPF 级SD 大鼠50 只,每组10 只,随机分配,共5 组,分别为空白组、模型对照组、西咪替丁组(阳性对照组)、高剂量给药组和低剂量给药组。给药方式和剂量:空白组、模型对照组每天口服灌胃生理盐水10 mL/kg;西咪替丁组灌胃给药65 mg/kg/d;将谷氨酰胺与姜黄素复配混合灌胃给药,其中高剂量组给药谷氨酰胺15 g/kg/d、姜黄素360 mg/kg/d;低剂量组给药谷氨酰胺2.5 g/kg/d、姜黄素60 mg/kg/d。杭州娃哈哈集团实验动物中心审查并批准实验程序(NO:2023010501)。
1.2.2 动物模型建立 根据国食药检保化[2012]107 号《关于印发抗氧化功能评价等9 个保健功能评价方法》中辅助胃粘膜保护功能动物实验要求,大鼠在连续灌胃服药30 d 后禁食禁水24 h,除正常组大鼠外,其余各组用1 mL/只无水乙醇灌胃,1 h 后用乙醚麻醉,主动脉取血并取胃部。
1.2.3 胃粘膜损伤评分标准 沿胃部大弯处切开,洗净胃内容物,将胃黏膜展开,用游标卡尺将出血点或出血带的长宽分别测定,并拍照记录[13]。观察等级分评定办法,见表1。按下列公式计算各组胃黏膜损伤程度:

表1 急性酒精损伤肉眼观察分标准Table 1 Gross visual scorings of acute alcohol injury
损伤发生率(%)=某组出现出血或溃疡大鼠数/该组大鼠数×100
损伤积分指数=各组损伤总积分/组动物数量
损伤抑制率(%)=(A-B)/A×100
其中,A、B 分别为模型组与实验组的损伤总积分。
1.2.4 病理组织学观察 根据官方动物评价方法对胃粘膜损伤进行评分后,取损伤严重相同部位组织固定于10%甲醛溶液制备成切片,将所制切片脱腊之后,严格按照H&E 染色说明书进行染色操作,采用生物显微镜观察各组胃粘膜组织情况。
1.2.5 大鼠血清MDA、GSH-Px、NO 水平 乙醚麻醉后,主动脉取血,将所取主动脉血液充分静置,两次离心后,取澄清上清液。按照试剂盒说明书操作流程测定各组大鼠血清MDA、NO 含量以及GSH-Px活力[14-15]。
1.2.6 大鼠胃粘膜组织中PGE2含量 取损伤严重部位大鼠胃粘膜经过组织研磨、充分静置、离心后得组织上清液,按ELISA 试剂盒操作方法测定胃粘膜组织中PGE2含量[16]。
1.2.7 大鼠胃粘膜组织抗氧化相关基因表达水平分析 采用Trizol 法提取胃粘膜组织总RNA[17-18],严格按照逆转录酶试剂盒(MultiScribe Reverse Transcriptase;Applied Biosystems)说明书进行操作。首先,使用One-drop 测定样品在260 nm 和280 nm处RNA 的纯度和浓度,样品的纯度即A260/A280的比值在1.8~2.0 之间表示为纯的RNA。其次,将RNA 逆转录成cDNA。然后将cDNA、引物和SYBR Green Master Mix 充分混合至均匀,使用实时荧光定量PCR 扩增并检测荧光强度,基因扩增程序如下:95 ℃,5 min 循环1 次;按照高温变性95 ℃,20 s;低温退火60 ℃,30 s,适温延伸72 ℃,20 s,循环45次,72 ℃终末延伸2 min。最后以β-actin 作为参照基因,采用2-ΔΔCt方式计算四个基因相对表达水平[19]。实验所用基因引物的引物序列见表2[20-21]。
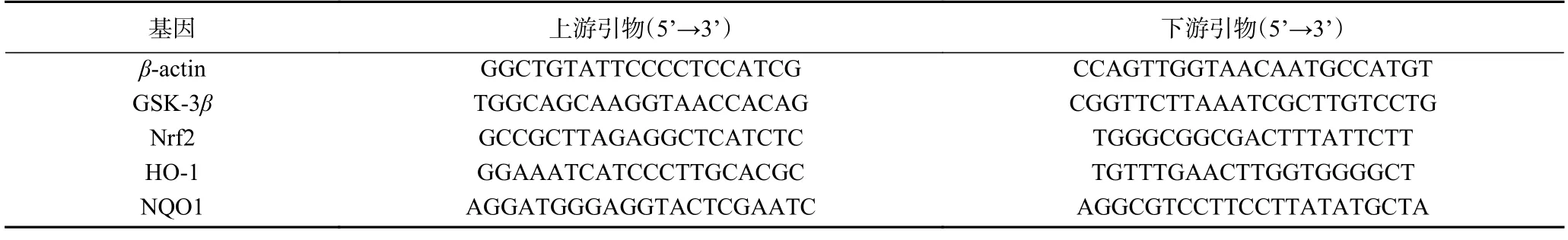
表2 RT-PCR 引物序列Table 2 Primers used in Real-time PCR
1.3 数据处理
统计学处理结果采用平均值±标准差(mean±SE)表示。用SPSS 26.0 软件进行统计学分析,P<0.05 表明差异具有统计学意义。采用Origin 2019软件作图。
2 结果与分析
2.1 胃粘膜损伤评价结果
参照官方辅助胃粘膜保护功能评价方法对胃粘膜表面损伤评价,更客观展现胃粘膜损伤情况。各组胃粘膜组织损伤结果如表3 所示。可以看出,无水乙醇造模,模型组损伤发生率为100%,显示造模成功。与模型组相比,西米替丁组和高剂量给药组SD 大鼠损伤积分显著降低(P<0.01),低剂量给药组无差异。从损伤抑制率来看,高剂量给药组抑制作用最为明显,达到75%。结果表明西米替丁组、高剂量给药组都具有较好改善无水乙醇导致的胃粘膜损伤作用,且高剂量给药组效果更好。

表3 胃粘膜损伤评价(n=10)Table 3 Evaluation of gastric mucosal injury (n=10)
2.2 胃粘膜组织病理学检查结果
胃粘膜组织细胞是胃的天然保护屏障,即可以发挥胃保护作用又具有吸收功能[22]。通过H&E 染色法观察大鼠胃黏膜情况(图1)。空白组大鼠胃粘膜组织结构完整且边界清晰(图1A);模型对照组大鼠胃黏膜组织细胞可见明显坏死、排列松散、结构不完整现象(图1B)。与模型对照组相较,西米替丁组与不同剂量的给药组中胃粘膜形态结构较为完整,排列相对整齐有规则,胃黏膜受损症状皆有所减轻(图1C),且给药组中高剂量给药组大鼠胃黏膜病理性损伤明显较轻。因此,组方可以帮助胃粘膜组织抵御乙醇带来的损伤,帮助胃粘膜组织细胞更好发挥屏障作用[23-24](图1D,图1E)。

图1 胃粘膜组织H&E 染色结果(40×)Fig.1 Results of H&E staining of gastric mucosal tissue (40×)
2.3 大鼠血清MDA、GSH-Px、NO 水平变化
GSH-Px、NO、MDA 是反映组织器官氧化应激损伤的重要指标,NO、MDA 升高显示氧化应激损伤发生和加重,GSH-Px 活性降低意味着在受到氧化应激损伤后,胃粘膜组织细胞自我调节能力下降[13]。从表4 大鼠血清检测结果可以发现模型对照组大鼠血清中GSH-PX活性较正常组有明显下降,MDA 和NO 水平均有明显上升(P<0.01),表明乙醇对胃黏膜的损伤与氧自由基有关。各给药组较模型对照组均能显著改善GSH-PX活性,降低MDA,NO 水平(P<0.05),且高剂量组作用更显著(P<0.01)。因此,可以看出,组方改善了由乙醇引起的胃粘膜组织氧化应激损伤,增强了组织细胞自我调节能力[25-26]。

表4 各组大鼠血清中MDA、GSH-Px 和NO 水平变化(n=10)Table 4 Changes of MDA,GSH-PX and NO levels in serum of rats in each group (n=10)
2.4 大鼠胃粘膜组织中PGE2 含量变化
PGE2是避免胃粘膜损伤无可替代的保护因子[27-28]。检测结果表明,与空白组相比,通过无水乙醇造模后,模型对照组大鼠胃粘膜组织中PGE2水平极显著降低(P<0.01)。各给药组与模型对照组相比,PGE2含量水平明显提高,高剂量组作用更显著(P<0.01)(表5),表明组方对胃黏膜组织的保护作用可通过提高PGE2水平而发挥作用。

表5 各组大鼠胃粘膜组织PGE2 水平(n=10)Table 5 PGE2 levels in gastric mucosal tissue of rats in each group (n=10)
2.5 大鼠胃粘膜组织中抗氧化相关基因表达水平变化
KEAP1-Nrf2-ARE 是细胞内重要的抗氧化信号通路,机体的氧化应激激发NRF2/ARE 信号通路的活化,使Nrf2 与KEAP1 解偶联,活化的Nrf2 与ARE结合,刺激下游抗氧化酶相关基因(HO-1 与NQO1)的表达。GSK-3β作为糖原合成激酶,通过推进Nrf2 磷酸化降解过程,对下游抗氧化酶的表达进行抑制[29-30]。实验结果表明,各给药组与模型对照组相比,均可提升Nrf2、HO-1 和NQO1 的基因表达水平(P<0.05),抑制GSK-3β的表达(P<0.05),其中高剂量组给药效果极显著(P<0.01)(图2)。由此推测,组方保护酒精性胃黏膜损伤的作用与KEAP1-Nrf2-ARE 信号通路有关。
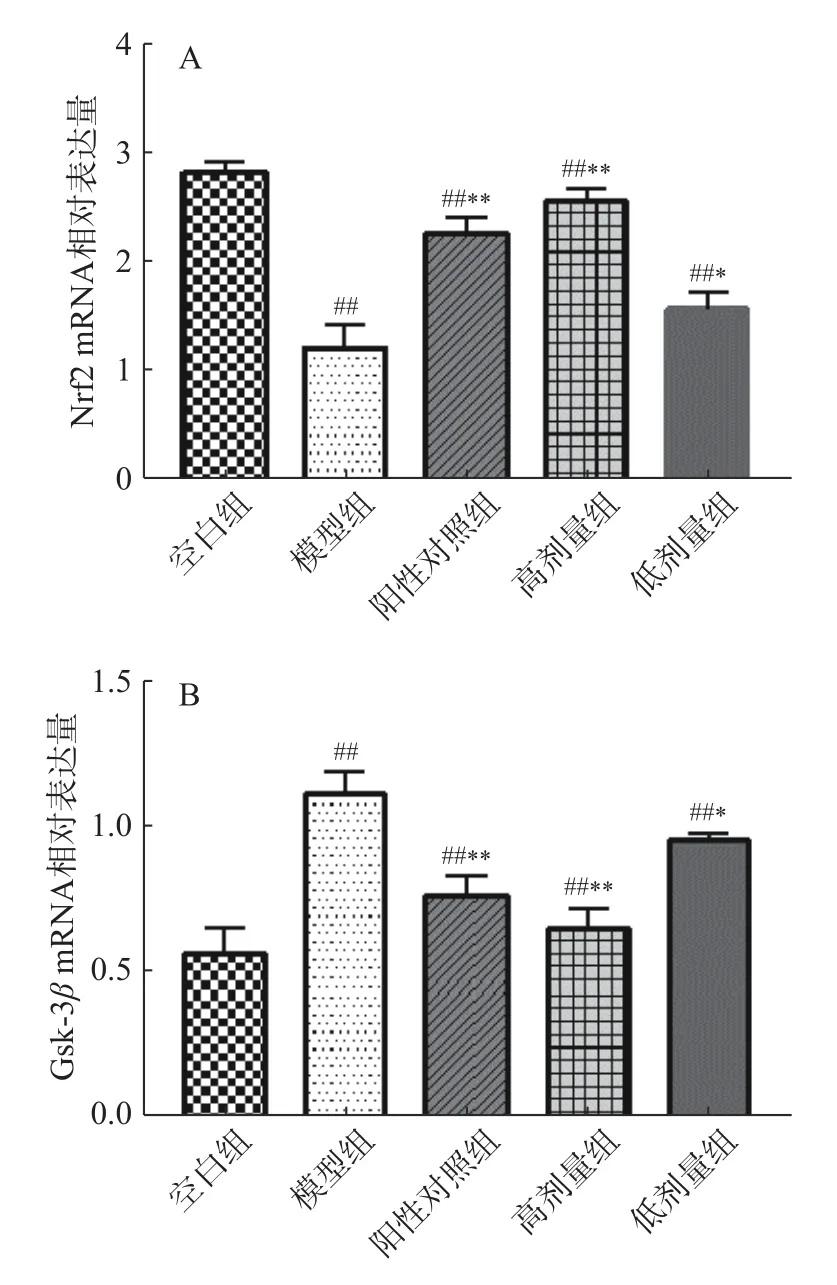

图2 胃抗氧化相关基因mRNA 表达水平Fig.2 mRNA expression levels of gastric antioxidant related genes
3 结论
本实验通过建立SD 大鼠酒精性胃黏膜损伤模型,探究谷氨酰胺与姜黄素组方对胃粘膜损伤的保护作用。高剂量的谷氨酰胺和姜黄素组方灌胃SD 大鼠后,在一定程度上降低了大鼠胃粘膜损伤积分指数,改善了大鼠胃黏膜组织病理损伤现象。同时,高剂量的谷氨酰胺和姜黄素组方使大鼠血清中的MDA 含量得到了显著降低(P<0.01),GSH-Px 的酶活性、NO 含量和胃粘膜组织中PGE2水平均有显著提高(P<0.05),对酒精性胃粘膜损伤起到了保护作用。同时可以上调大鼠胃粘膜组织中抗氧化相关基因Nrf2、HO-1 及NQO1 的mRNA 相对表达水平(P<0.05),下调了抑制抗氧化通路相关基因GSK-3β的mRNA 相对表达水平(P<0.05),增强胃粘膜组织的抗氧化能力。
综合以上结果,谷氨酰胺和姜黄素组方具有抑制乙醇所致胃粘膜损伤的作用,其作用机制推测与调节抗氧化通路关键因子的基因表达,进而减轻氧化应激反应有关。虽然目前已有部分文献报道单一成分的谷氨酰胺或姜黄素具有修复胃粘膜损伤的功效,但是关于谷氨酰胺和姜黄素联用的组方对修复胃粘膜的文献少之又少,所以需要对其修复胃粘膜的机制进行深入研究。本研究阐明了谷氨酰胺和姜黄素组方对胃粘膜损伤的保护作用,为把其开发为安全有效的治疗酒精性胃粘膜损伤疾病的功能食品和保健食品提供了理论支持。

