4 种食源性致病菌多重PCR 检测体系的建立及其在乳品检测中的应用
王珊,高辉明,王雁伟,周思思,庞艳荣,艾鹏飞
(河北科技大学食品与生物学院,石家庄 050018)
0 引 言
近年来食品质量安全事件频发,屡见不鲜。根据全球数据统计显示,针对食源性疾病治疗的花销平均每年高达数十亿美元[1]。食品安全不断地受到致病菌的威胁,严重影响消费者身体健康,由食源性致病菌引起的疾病也呈上升趋势[2]。通常,引发疾病的食源性致病菌主要包括志贺氏菌、蜡样芽胞杆菌、副溶血性弧菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、单核细胞增生李斯特氏菌、致病性大肠埃希氏菌等[3-9]。人误食了食源性致病菌污染的食物后会产生腹痛、腹泻、恶心呕吐等症状,随时会对人的生命安全造成不可估量的损害[10-12]。因此,如何快速准确地检测食源性致病菌是预防食源性疾病暴发的关键[13]。
国标法作为食源性致病菌常规的检测技术,一般情况下需经过复杂繁琐的过程,如富集培养、形态学观察、生理生化鉴定等,以致灵敏度低、不易定量[14]、耗时费力[15],还易引起检测样品中菌种的流失,不能第一时间发现并控制潜在风险[16-17],因此无法高效、精准地评估食品安全[18]。相比之下,聚合酶链式反应(polymerase chain reaction,PCR)作为一项新的分子生物学技术在检测食源性致病菌中,为检测致病菌开辟了更加高效准确的新方法[19-20]。多重PCR 检测技术可以实现在同一PCR 体系中,加入多对引物组合,进行多菌种多样品的高效分析[21-22],可以实现在短期内同时筛选多组检测样品,极大地缩短检测时间,提高检测效率,目前已在多种有害微生物的快速检测中得到应用[23-25]。如SHI X 等[26]利用多重PCR 技术实现了对牛奶中金黄色葡萄球菌、鼠伤寒沙门氏菌和单核细胞增生李斯特菌等3 种致病菌的检测,谭燕等[27]采用多重PCR 检测食品中鼠伤寒沙门氏菌,WANGZ 等[28]利用多重PCR 检测方法,快速检测禽类中鼠伤寒沙门氏菌属、奇异变形杆菌、大肠杆菌、多杀性巴氏杆菌、铜绿假单孢菌和金黄色葡萄球菌等6 种致病菌。
目前,针对在食品中同时快速检测单核细胞增生李斯特氏菌(Listeria monocytogenes)、蜡样芽胞杆菌(Bacillus cereus)、肠道出血性大肠埃希氏菌O157:H7(Escherichia coliO157: H7)、鼠伤寒沙门氏菌(Salmonella)等4 种食源性致病菌的报道鲜少。基于此,本实验根据上述4 种食源性致病菌的特异基因设计引物,通过优化多重PCR 反应体系及扩增条件,构建了一套多重PCR 快速检测方法,并通过对人工污染牛奶检测来评估该技术的可行性,为当前快速发展的食品安全检测行业提供了理论指导和技术支持[29]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
4 株目标病原菌。单核细胞增生李斯特氏菌(CMCC 54001)、鼠伤寒沙门氏菌(CMCC 50115),中国医学菌种保藏中心;蜡样芽胞杆菌(CICC 21290)、肠道出血性大肠埃希氏菌O157∶H7(CICC 21530),中国工业微生物菌种保藏中心。14 株非目标菌。绿脓杆菌(CMCC 1011)、表皮葡萄球菌(CMCC 26069)、多黏类芽胞杆菌(CMCC 63512),中国医学菌种保藏中心;副溶血性弧菌(CICC 21617)、苏云金芽胞杆菌(CICC 22945)、枯草芽胞杆菌(CICC 10002)、福氏志贺菌(CICC 10865)、霍乱弧菌(CICC 23794)、巴氏醋杆菌(CICC 23561),中国工业微生物菌种保藏中心;金黄色葡萄球菌(ATCC 6538)、阪崎肠杆菌(ATCC 51024)、弗氏柠檬酸杆菌(ATCC 43864)、空肠弯曲菌(ATCC 29428)、结核分枝杆菌(ATCC 25177),美国标准菌种收藏所。
1.1.2 试剂
2×Rapid Taq Master Mix,南京诺赞维生物科技有限公司;细菌基因组DNA 提取试剂盒,北京索莱宝生物科技有限公司;50×TAE Buffer,上海宇牧博生物科技有限公司;蛋白胨、酵母粉,OXOID 公司;琼脂凝胶提取试剂盒,Omega 公司;零背景pTOPO-Blunt 平末端克隆试剂盒,艾德莱生物科技有限公司;50 bp DNA Ladder、DH5α,天根生化科技有限公司;其它生化试剂为国产分析纯试剂。
1.2 仪器与设备
Veriti PCR 热循环仪,美国ABI 公司;Gel Doc XR 凝胶成像系统,美国Bio-Rad 公司;DS-11 型超微量核酸测量仪,美国DeNovix 公司;DYY-6D 生化电泳仪,北京六一生物科技有限公司;CT15RE 台式微量高速离心机,日本Himac 公司;QL-901 Vortex漩涡混合器,海门其林贝尔仪器制造公司;-80 ℃超低温冰箱,安徽美菱股份有限公司。
1.3 实验方法
1.3.1 菌种的培养
从-80 ℃冰箱中取出菌种冻存管,解冻回温后,将4 株目标病原菌和14 种非目标菌分别采用平板划线法接种到LB 固体培养基中,置于37 ℃培养箱中培养过夜。分别挑取单菌落接种于LB 液体培养基中,置于摇床中37 ℃、180 r/min 培养过夜。
1.3.2 模板的制备
吸取培养过夜的菌悬液2mL 于离心管中,12 000r/min离心2 min,弃上清液提取基因组DNA 作为模板,详细操作步骤按照细菌基因组DNA 提取试剂盒说明书进行。对提取的DNA 用超微量核酸测定仪测定DNA浓度及纯度。测得DNA 浓度均为100~150 ng,OD260/280 比值约为1.83。
1.3.3 引物的设计及合成
通过NCBI-Blastn 对单核细胞增生李斯特氏菌的prfA基因、蜡样芽孢杆菌的gyrB基因、鼠伤寒沙门氏菌的invA基因和肠道出血性大肠埃希氏菌O157∶H7的stx2A基因进行同源比对,利用Primer 5.0 和Oligo 6.0 软件对目的基因进行引物设计,选取软件分析得分高且扩增片段大小不同的4 对引物,委托生工生物工程有限公司(上海)合成。引物序列及扩增片段长度如表1 所示。

表1 多重PCR 引物序列
1.3.4 引物特异性验证
用表1 中的引物分别对4 种菌进行PCR 扩增。单重PCR 反应体系:2×Rapid Taq Master Mix 10 μL、10 μmol/L 上下游引物各0.8 μL、DNA 模板0.3 μL,添加无菌ddH2O 补足至20 μL;单重PCR 反应程序:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸25 s,32 个循环;72 ℃延伸5 min。PCR 产物经1%琼脂糖凝胶对电泳后,采用Omega 胶回收试剂盒对电泳条带回收,连接到pTOPO-Blunt 载体上,并转入到DH5α 感受态细胞中,37 ℃过夜培养,选取阳性克隆寄送擎科生物科技有限公司(北京)测序,并对测序结果比对分析。
1.3.5 多重PCR 退火温度优化
用筛选得到的引物进行多重PCR 退火温度优化试验。多重PCR 反应体系:2×Rapid Taq Master Mix 10 μL、10 μmol/L 上下游引物各0.8 μL,DNA 模板各0.3 μL,添加无菌ddH2O 补足至20 μL;多重PCR 反应程序:95 ℃预变性5 min,95 ℃变性15 s,退火20 s,退火温度分别设定50、52、54、56、58、60、72 ℃延伸25 s,32 个循环;72 ℃后再延伸5 min。 PCR 扩增产物经3%琼脂糖凝胶电泳后,采用凝胶成像分析系统观察结果。
1.3.6 多重PCR 引物浓度确定
用筛选得到的引物进行多重PCR 引物浓度优化试验。多重PCR 反应体系:2×Rapid Taq Master Mix 10 μL、10 μmol/L 的引物用量按照表2 进行4 因素3水平正交试验进行优化[30],DNA 模板各0.3 μL,无菌ddH2O 补足至20 μL。多重PCR 反应程序:95 ℃预变性5 min;95 ℃变性15 s,58 ℃退火20 s,72 ℃延伸25 s,32 个循环;72 ℃延伸5 min。PCR 扩增产物经3%的琼脂糖凝胶电泳后,采用凝胶成像分析系统观察结果,以确定反应体系中最佳引物浓度。

表2 正交试验
1.3.7 多重PCR 特异性试验
为了检测建立的多重PCR 扩增的特异性,利用优化得到的多重PCR 检测体系对非目标菌DNA 模板进行扩增。取金黄色葡萄球菌等14 种非目标菌DNA 各0.3 μL 混合作为阴性对照,4 种目标菌按照表3 添加模板DNA 于同一个反应管中进行扩增反应,根据扩增条带分析有无反应内交叉错配现象[31]。

表3 特异性验证试验
1.3.8 多重PCR 检出限确定
用无菌的ddH2O 分别对单核细胞增生李斯特氏菌、蜡样芽胞杆菌、鼠伤寒沙门氏菌和肠道出血性大肠埃希氏菌O157:H7 的菌悬液进行10 倍梯度的稀释,通过平板计数来确定其浓度。分别提取DNA 作为多重PCR 反应的模板,在优化的多重PCR 反应体系中进行扩增以确定各目标菌的最低检出限。
1.3.9 多重PCR 检测方法检验人工污染乳制品
目前,我国食品中致病菌的检测基本上采用的是“国标法”[32]。为了验证四重PCR 检测方法的有效性,分别用多重PCR 方法和GB 4789.30—2010《食品微生物学检验单核细胞增生李斯特菌检验》、GB4789.14—2003《食品微生物学检验蜡样芽胞杆菌检验》、GB 4789.4—2016《食品微生物学检验沙门氏菌检验》、GB 4789.36—2016《食品微生物学检验大肠埃希氏菌O157∶H7 菌检验》对不同人工接种污染新鲜牛奶处理样品(样品中各种致病菌浓度为102CFU/mL)进行检测。以人工接种病原菌新鲜牛奶在37 ℃下恒温振荡培养3 h 作为DNA 提取的试验样品。
2 结果与分析
2.1 引物特异性验证结果
用表1 中的引物分别对单核细胞增生李斯特氏菌、蜡样芽胞杆菌、鼠伤寒沙门氏菌和肠道出血性大肠埃希氏菌O157∶H7 进行扩增,以14 种非目标菌和ddH2O 作为对照。扩增结果如图1 所示,在各添加目标菌DNA 的反应中均能扩增出目的条带,分别为274、221、482、108 bp,而对非目标菌均无扩增条带,说明设计的4 对引物都只对目标菌的模板DNA 具有特异性扩增。将目的片段纯化回收、构建重组质粒克隆、送公司测序,经序列比对发现扩增片段与GenBank 数据库中序列完全一致。
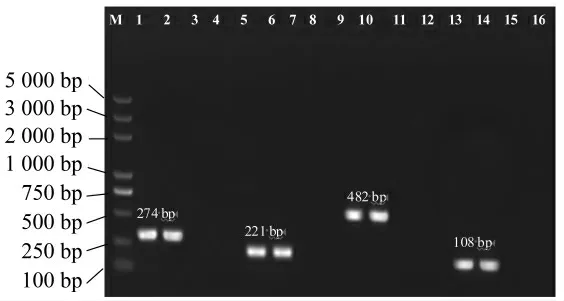
图1 引物特异性扩增结果
2.2 多重PCR 退火温度优化结果
在PCR 反应中,退火温度过低会因引物的错配而产生非特异性扩增,退火温度过高会抑制引物与模板的结合从而导致扩增效率下降[30]。本试验中对PCR退火温度优化结果如图2 所示,退火温度较低(1、2 泳道)时,单增李斯特菌和蜡样芽胞杆菌中没有扩增出目的条带,且出现了非特异条带;随着退火温度升高(3~5 泳道),各目标菌模板DNA 逐渐扩增出清晰可见的条带;当退火温度上升到60 ℃时,单增李斯特菌和蜡样芽胞杆菌中又没有扩增出目的条带。综上分析,选取泳道5 中4 条目的条带清晰、明亮的58 ℃作为最佳退火温度进行后续试验。
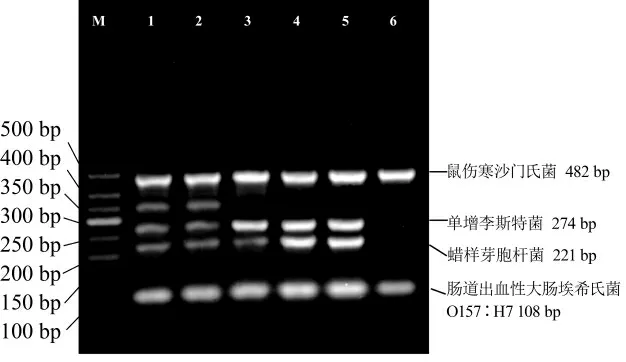
图2 不同退火温度的多重PCR 扩增结果
2.3 多重PCR 引物浓度优化结果
每对引物在单重PCR 扩增时表现出清晰明亮的条带,当多对引物进行多重PCR 扩增时由于引物间彼此干扰会出现条带亮度不一现象,引物浓度过低时目标条带暗淡,引物浓度过高时目标条带过于明亮而弥散[30]。本试验对引物浓度优化的结果如图3 所示,在泳道1~5 中,由于单增李斯特菌引物prfA加入量过低,扩增的目的条带暗淡;在泳道9 中,由于大肠杆菌O157∶H7 引物stx2A加入量过低,扩增的目的条带也较暗;在泳道6~8 中,4 条目标条带都清晰明亮。综合考虑条带明亮度的均一性及最大限度提高扩增效率,确定泳道6 中invA基因引物添加量0.6 μL、prfA基因引物添加量0.8 μL、gyrB基因引物添加量1 μL 和stx2A基因引物添加量0.8 μL 为较佳的引物用量组合。
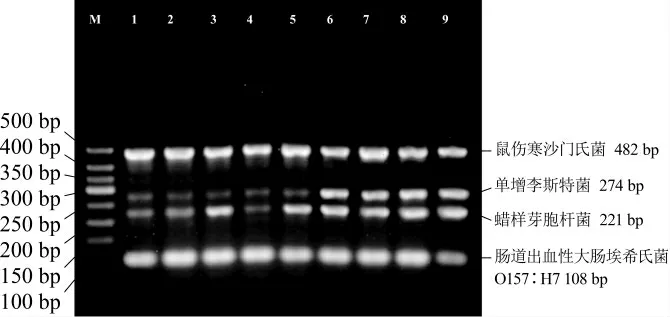
图3 不同引物浓度的多重PCR 扩增结果
2.4 多重PCR 特异性试验结果
利用建立的四重PCR 反应体系,进行扩增的特异性验证试验,结果如图4 所示,对比泳道1 和2,在同一反应中只要添加有4 种目标菌模板DNA 时都能扩增出4 条特异性目的条带(482、274、221、108 bp),其它非目标菌DNA 没有表现出对PCR 扩增结果的干扰和假阳性影响;在泳道3~6 中,分别只扩增出对应的3 种目标菌的目的片段,没有出现非特异性扩增条带。综合上述试验结果表明,基于检测4 种目标致病菌设计引物而建立的四重PCR 扩增体系具有良好的特异性。
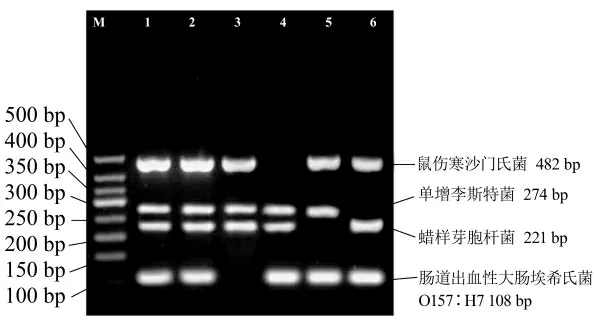
图4 多重PCR 体系的特异性验证
2.5 多重PCR 检出限结果
分别将4 种致病菌的菌悬液(单增李斯特菌1.2×107CFU/mL,蜡样芽胞杆菌1.8×107CFU/mL,鼠伤寒沙门氏菌3.4×107CFU/mL,肠道出血性大肠埃希氏菌O157∶H7 2.5×107CFU/mL)进行100~10-7梯度稀释,提取DNA 后进行同一稀释梯度等级的多重PCR扩增试验,结果如图5 所示,4 种致病菌的最低检出限分别为单核细胞增生李斯特氏菌1.2×102CFU/mL,蜡样芽胞杆菌1.8×102CFU/mL,鼠伤寒沙门氏菌3.4 CFU/mL,肠道出血性大肠埃希氏菌O157∶H7 2.5×102CFU/mL。

图5 不同稀释梯度下多重PCR 扩增结果
2.6 多重PCR 检测方法检验人工污染乳制品
采用多重PCR 检测方法和国标法分别对17 份样品检测。结果由表4 可知,多重PCR 检测方法和菌株分离培养法2 种方法的检测结果完全一致,符合率均为100%。但是传统的菌株分离培养法需要5~7 d,本多重PCR 检测方法仅需要5~6 h,大大提高了检测效率。
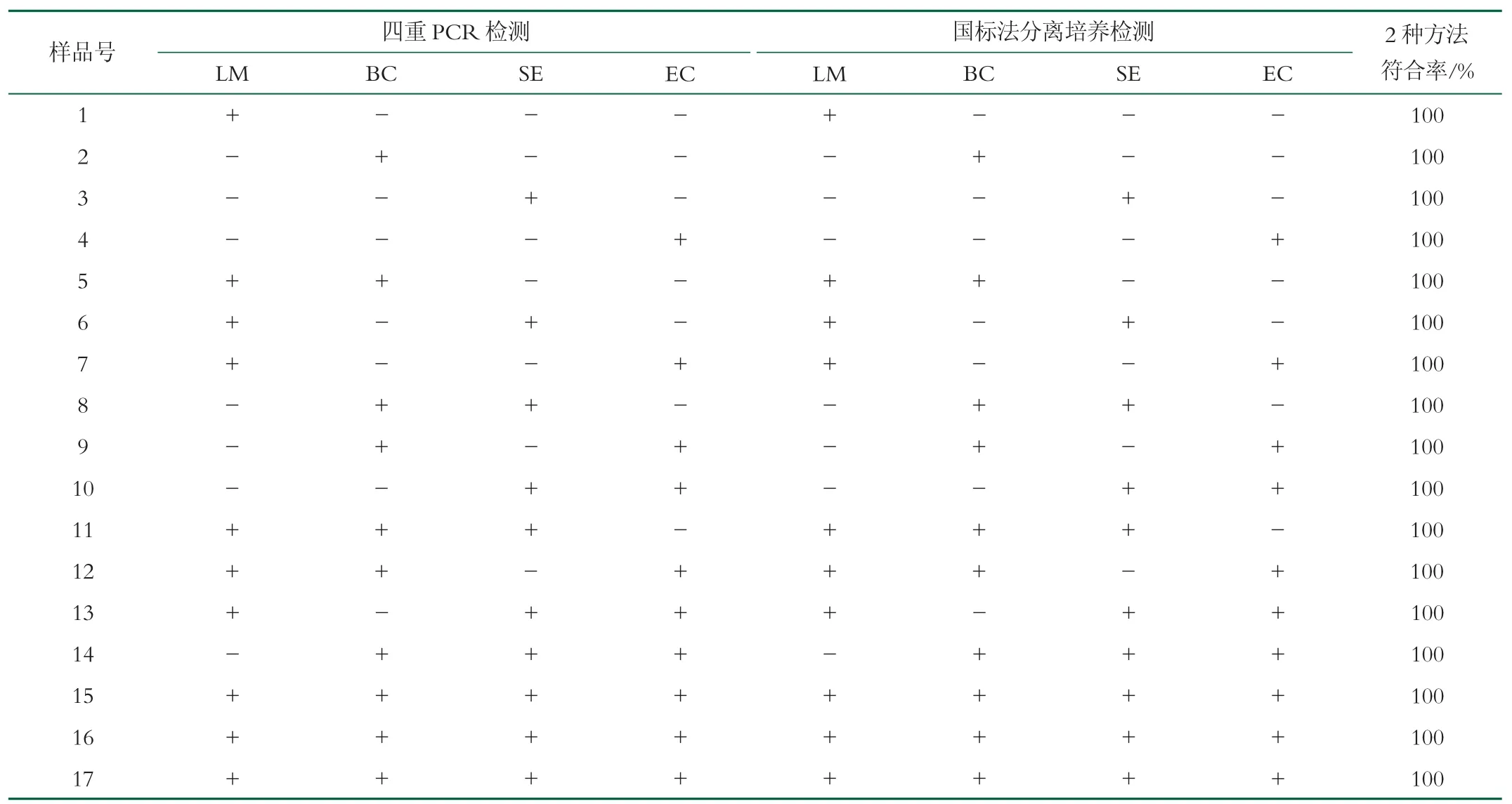
表4 多重PCR 方法和菌株分离培养法检测染菌牛奶样品的结果比较
3 结 论
建立了乳品中单增李斯特菌、蜡样芽胞杆菌、鼠伤寒沙门氏菌和肠道出血性大肠埃希氏菌O157∶H7四重PCR 检测方法。采用4 对引物在一个反应体系中扩增出可鉴别4 种目标菌的特异性基因片段,缩短了检测时间,提高了检测效率。通过对4 种目标菌和14 种非目标菌的特异性验证试验,证明了本方法具有良好的特异性。此外,本方法具有良好的灵敏度,最低检出限为10~102CFU/mL,比冯可等[30]检出限105CFU/mL提高了103倍,一定程度上说明本研究设计的引物与靶标序列具有良好的匹配性和建立的多重PCR 扩增体系优良。对17 份人工染菌牛奶样品进行检测,检测结果与国标法中分离培养检测符合率达到100%,说明本多重PCR 方法应用于乳品中致病菌检测是可行的。检测时间由国标法的5~7 d 缩减到5~6 h,极大缩短了检测周期、提高了检测效率。综上可知,本研究建立的多重PCR 检测方法具有良好的特异性、敏感性和稳定性,为快速、高效检测乳品中多种致病菌提供了切实可行的技术手段,在保障食品安全方面具有重要实践意义。

