miR-223 对脂多糖诱导的奶牛乳腺上皮细胞炎症反应的影响
赵天夺,王若薇,张莉,魏祥飞,杨慧琳,符海鑫,王春梅
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
0 引 言
MicroRNA(miRNAs)是一类长度约22 个核苷酸且高度保守的内源性非编码RNA,通过与mRNA 的3’UTR 结合,降解和/或抑制翻译其结合的靶基因,在转录后调节基因的表达[1-4]。成熟的miR-223 长度为22 nt,它的基因位于奶牛、人类和小鼠的X 染色体中[5-8]。目前对于miR-223 的研究大多都集中于癌症和炎症性疾病方面[5,9-13],如miR-223 已被证实通过靶向FOXO3a 来抑制肝癌细胞中的过度自噬[14],也可靶向RhoB 来促进胃癌中的肿瘤进展[12]。然而也有研究报道,miR-223-3p 通过靶向NLRP3 来抑制视神经胶质瘤细胞增殖,发挥抗癌作用[11],同样也有研究发现,miR-223 在奶牛乳腺炎和牛子宫内膜炎等组织中的表达量均显著上调[15-16],因而被认为是炎症性疾病的关键调节因子。众所周知,奶牛乳腺炎严重束缚着奶业的进展,病原微生物的感染是造成奶牛乳腺炎的原因之一。研究发现miR-223 可通过靶向CBLB 和抑制下游的PI3K/AKT/NF-κB 通路来减轻金黄色葡萄球菌诱导的炎症进展[17],并且大肠杆菌也是引起奶牛乳腺炎的主要病原体之一,其通过产生内毒素LPS诱发炎症反应[18-19]。在前期的实验中发现LPS 的添加可导致DCMECs 中miR-223 的表达有所差异,而目前miR-223 是否可以调控LPS 诱导的奶牛乳腺炎与乳脂合成还没有研究报道。因此本研究以DCMECs为研究模型,探究miR-223 对使用LPS 炎症造模后的细胞炎症反应及乳脂合成的影响,旨在为治疗乳腺炎和提高乳品质提供参考。
1 材料方法
1.1 主要试剂与仪器
胎牛血清,Absin;DF12 培养液干粉、胶原酶Ⅳ、脂多糖(LPS)、尼罗红(Nile Red),Sigma;TRIzol,Ambion;胰酶,Giboc;角蛋白18(CK-18)抗体、驴抗兔lgG/FITC 二抗,Bioss;β-actin 抗体,Santa Cruz;TNFα 抗体,Wanleibio;FASN 抗体、HRP-山羊抗兔/鼠lgG 抗体,ABclonal;miR-223 过表达片段(mimics)、过表达阴性对照片段(mimics NC)、染料法Hairpin-it miRNAs qRT-PCR 定量试剂盒,吉玛基因;LipofectamineTM2000(Lipo2000)脂质体转染试剂,invitrogen;4',6-二脒基-2-苯基吲哚(DAPI)、Annexin V-FITC细胞凋亡检测试剂盒,碧云天;细胞培养箱、荧光显微镜、荧光定量PCR 仪,Thermo。
1.2 奶牛乳腺上皮细胞的原代培养与鉴定
取处于泌乳期健康的中国荷斯坦奶牛乳腺组织,采用胶原酶消化法体外分离培养原代DCMECs。培养5 d 左右,根据成纤维细胞与乳腺上皮细胞对胰酶耐受程度的不同,进一步纯化获取DCMECs。将纯化后的DCMECs 采用免疫荧光方法鉴定CK-18,应用FITC 标签的荧光二抗标记CK-18,DAPI 标记细胞核。
1.3 添加LPS 对奶牛乳腺上皮细胞炎症蛋白因子的影响
将处于对数生长期的DCMECs 传于6 孔板,当细胞密度达80%时,弃培养液,分别加入含有LPS 终浓度为0.1、1、10 μg/mL 的细胞培养液,同时建立不加LPS 的对照组。培养24 h 后提各组总蛋白,Western blot 检测蛋白变化。应用SDS-PAGE 凝胶电泳分离蛋白,75 V、70 min 湿转至0.22 μm 的硝酸纤维素薄膜上,随后用含5%脱脂乳的TBS/T 缓冲液封闭2 h,用TNF-α、β-Actin 一抗4 ℃过夜孵育,TBS/T 清洗后,二抗37 ℃孵育1 h,TBS/T 清洗后,用发光液显色,蛋白条带用曝光机捕获。
1.4 添加LPS 对奶牛乳腺上皮细胞miR-223 表达的影响
同上,6 孔板细胞密度达80%时,加入含有LPS 终浓度为1 μg/mL 的细胞培养液,同时建立不加LPS 的对照组。培养24 h 后采用TRIzol 法提各组总RNA,应用染料法Hairpin-it miRNAs qRT-PCR 定量试剂盒检测miR-223 的相对表达量。引物如表1 所示。

表1 荧光定量PCR 引物序列
1.5 奶牛乳腺上皮细胞转染miR-223 mimics
将DCMECs 传于6 孔板,细胞融合至80%左右时,加入无血清无双抗培养液,使用Lipo2000 脂质体转染试剂转染miR-223。miR-223 处理组:6 μL Lipo2000、70 nmol/L miR-223 mimics;miR-223 阴性对照组:6 μL Lipo2000、70 nmol/L mimics NC。转染6 h后,更换带血清及双抗的完全培养液。转染24 h 后,同上述方法提总RNA,应用qRT-PCR 检测miR-223的相对表达量。
1.6 miR-223 过表达对LPS 诱导的DCMECs 相关蛋白表达的影响
同上,将细胞接种6 孔板中,细胞融合密度达80%左右时转染miR-223 处理组、阴性对照组,转染24 h 后分别加入LPS 终浓度为1 μg/mL 的细胞培养液,同时建立不添加LPS 的空白对照组,37 ℃继续培养24 h,Western blot 检测TNF-α、FASN 蛋白表达变化。
1.7 miR-223 过表达对LPS 诱导的DCMECs 凋亡的影响
同上,6 孔板细胞转染miR-223 mimics 与mimics NC,添加LPS 刺激24 h 后,按照Annexin V-FITC细胞凋亡检测试剂盒说明书,应用原位荧光检测贴壁细胞凋亡情况。
1.8 miR-223 过表达对LPS 诱导的DCMECs 乳脂合成的影响
同上,6 孔板细胞转染miR-223,LPS 刺激24 h后,PBS 清洗2 次,4 %多聚甲醛固定30 min,PBS 清洗后用1 μg/mL 的Nile Red 工作液37 ℃避光孵育15 min,PBS 清洗后用DAPI 染核,置于荧光显微镜观察。
1.9 数据分析
蛋白条带和原位荧光图应用Image J 软件分别扫描灰度值与荧光强度。原始数据使用SPSS 软件进行差异分析,数据以平均数±标准差(x±s)表示,样本间差异性比较进行t检验或方差分析,使用GraphPad Prism 8 软件作图,“ns”表示无统计学差异(P>0.05),“**”表示有极显著统计学差异(P<0.01)。
2 结果与分析
2.1 奶牛乳腺上皮细胞的原代培养与鉴定结果
如图1 所示,图(a)为倒置显微镜下培养5 d 后的原代DCMECs,底部附着组织团块,且贴壁细胞大多数为放射状的成纤维细胞。图(b)为经胰酶纯化后的DCMECs,呈多角形、鹅卵石状紧密排列的上皮细胞。将纯化后的DCMECs 采用免疫荧光技术对其进行CK-18 的鉴定,如图2 所示,蓝色椭圆形为DAPI 染色的细胞核,绿色拉网状的为FITC 标记的CK-18 蛋白。由此可知,已成功获得纯的DCMECs。

图1 DCMECs 的原代培养与纯化

图2 DCMECs CK-18的鉴定
2.2 添加LPS 对奶牛乳腺上皮细胞炎症蛋白因子的影响
分别用不同浓度(0.1、1、10 μg/mL)的LPS 处理DCMECs,24 h 后应用Western blot 检测细胞炎症蛋白因子TNF-α 的表达情况。结果如图3 所示,与空白对照组相比,LPS 促进了TNF-α 的表达。与0.1 μg/mL处理组相比,1 μg/mL 处理组TNF-α 表达显著上调(P<0.01)。10 μg/mL 处理组与1 μg/mL 处理组相比,TNF-α 表达有所上调,但无统计学差异(P>0.05)。由此可得,1 μg/mL 的LPS 为诱导DCMECs 炎症反应的最佳浓度,后续采用浓度1 μg/mL 的LPS 进行炎症造模探究。
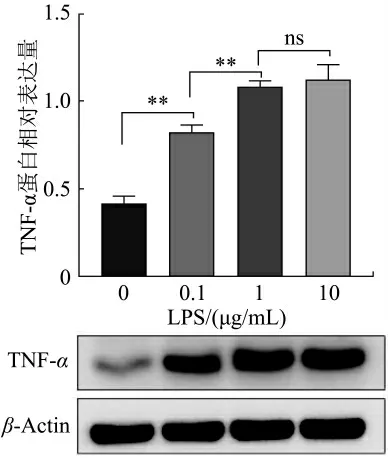
图3 LPS 对DCMECs 炎症蛋白因子的影响
2.3 添加LPS 对奶牛乳腺上皮细胞miR-223 表达的影响
用浓度为1 μg/mL 的LPS 处理DCMECs,24 h后提取细胞总RNA,应用qRT-PCR 检测miR-223表达情况。如图4 所示,经LPS 诱导的DCMECs miR-223表达显著上调(P<0.01)。结果表明,LPS 可促进DCMECs miR-223 的表达。

图4 LPS 对奶牛乳腺上皮细胞miR-223 表达的影响
2.4 转染miR-223 mimics 对miR-223 表达的影响
将miR-223 mimics 与mimics NC 分别转染至细胞,24 h 后应用qRT-PCR 检测miR-223 表达情况。如图5 所示,miR-223 过表达后,较阴性对照组上调约400 倍。结果表明,miR-223 成功转染至细胞中,且转染效率显著(P<0.01)。

图5 转染miR-223 mimics 对miR-223 表达的影响
2.5 miR-223 过表达对LPS 诱导的DCMECs 相关蛋白表达的影响
将miR-223 mimics 与mimics NC 分别转染至细胞24 h 后,吸弃培养液,分别添加1 μg/mL 的LPS 继续培养24 h 后,应用Western blot 检测细胞炎症蛋白因子TNF-α 与乳脂合成相关蛋白FASN 的表达情况。如图6 所示,与空白对照组相比,LPS 处理下TNF-α 表达显著上调,FASN 表达显著下调(P<0.01)。转染miR-223 mimics+LPS 组与mimics NC+LPS 组相比,TNF-α 表达显著下调,FASN 表达显著上调(P<0.01)。结果表明,miR-223 过表达可以显著抑制LPS 诱导的DCMECs 炎性因子TNF-α 并促进乳脂合成相关蛋白FASN 的表达。
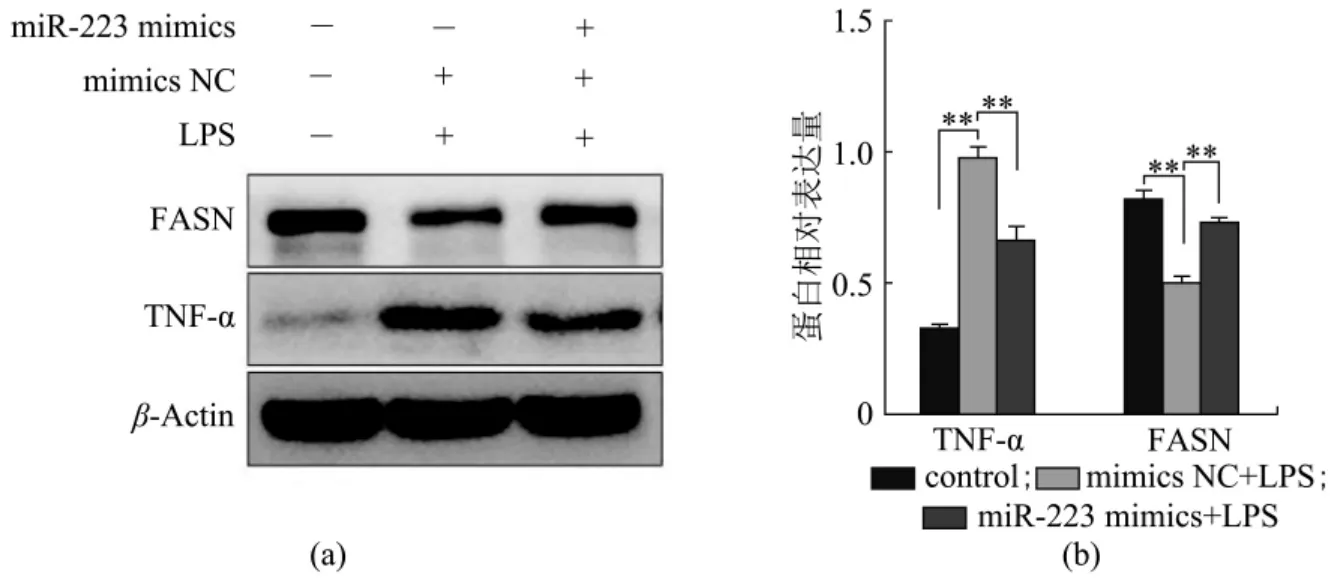
图6 miR-223 过表达对LPS 诱导的DCMECs 相关蛋白表达的影响
2.6 miR-223 过表达对LPS 诱导的DCMECs 凋亡的影响
同上,将miR-223 转染至细胞24 h 后分别添加1 μg/mL 的LPS 再继续培养24 h 后,应用原位荧光检测细胞凋亡情况。如图7 所示,绿光为FITC 标记的凋亡细胞,红光为PI 标记的坏死细胞的细胞核。与空白对照组相比,LPS 组凋亡细胞数明显增多,而转染miR-223 mimics+LPS 组与mimics NC+LPS 组相比,细胞凋亡数显著减少。结果表明,miR-223 过表达可以显著抑制LPS 诱导的DCMECs 凋亡。

图7 miR-223 过表达对LPS 诱导的DCMECs 凋亡的影响
2.7 miR-223 过表达对LPS 诱导的DCMECs 乳脂合成的影响
同上,转染后添加1 μg/mL 的LPS 再继续培养24 h 后,应用Nile Red 染色,荧光显微镜观察细胞内甘油三酯合成情况。如图8 所示,与空白对照组相比,LPS 组甘油三酯含量显著下调(P<0.01),而转染miR-223 mimics+LPS 组与mimics NC+LPS 组相比,细胞内甘油三酯含量显著上调(P<0.01)。结果表明,miR-223 过表达可以显著上调LPS 诱导的DCMECs内甘油三酯含量,促进乳脂合成。

图8 miR-223 过表达对LPS 诱导的DCMECs 乳脂合成的影响
3 讨 论
奶牛乳腺炎可分为亚临床和临床乳腺炎,在我国发病率约为46%~70%[20],而亚临床乳腺炎通常症状不明显,使其易于在牛群中传播,对产乳量和乳品质造成很大影响[21-22]。对此大量研究通过使用灭活的金黄色葡萄球菌或大肠杆菌构建乳腺炎模型,应用RNASeq 技术分析牛乳腺上皮细胞的miRNAs 的差异表达[23-24]。如LI R 等[25]通过对比葡萄球菌感染的乳腺组织发现有77 个miRNAs 的表达量有显著差异:miR-223、miR-132、miR-184、miR-1246 与miR-130b 表达上调,而miR-205、miR-200b、miR-196a、miR-145与miR-31 表达下调。SUGATANI T 等[26]发现LPS 刺激小鼠支气管和肺泡上皮细胞后的miR-223 表达上调。ZHAO G 等[16]也发现LPS 诱导的子宫内膜炎中NF-κB 的活化促进了miR-223 的转录,从而抑制了其靶基因NLRP3 介导炎症介质的激活,来保护子宫免受炎症损伤。本研究发现,应用LPS 诱导DCMECs构建的奶牛乳腺炎细胞模型与对照组相比miR-223的表达上调3 倍左右,这恰与上述前人的研究结论相符,可知miR-223 参与了LPS 诱导的DCMECs 炎症的发展,具有很高的研究价值。
关于miR-223 在炎症性疾病方面发挥机制的研究,ZHANG L 等[10]发现在人乳腺癌细胞中,miR-223-3p 诱导NLRP3 炎症小体失活,抑制肿瘤生长,增强抗癌免疫。ZHOU W 等[27]表明,吞噬细胞和上皮细胞中的miR-223 通过抑制典型的NF-κB 通路共同限制炎症的程度。众多研究证明在巨噬细胞中,miR-223 可负调节NF-κB 活化并下调促炎因子(NF-κB、IL-1β 和IL-6 等)的表达,从而可减轻骨骼肌损伤的慢性炎症反应的发展[9,28-29]。同样LIAN F 等[30]发现在大鼠海马神经元细胞中,miR-223-3p 负调节FOXO1 以抑制炎症因子的表达。因此,miR-223 常被作为一种抗炎的miRNA。在本研究中,我们发现miR-223的过表达可下调LPS 诱导诱导的炎症因子TNF-α的表达,并降低细胞凋亡比率,从而减缓DCMECs 炎症反应的发展。然而也有研究表明,在真菌性角膜炎中沉默miR-223-3p 的表达可以通过靶向自噬相关16 样蛋白1(ATG16L1)来促进自噬和缓解炎症[31]。提示miR-223 对炎症性疾病的作用与其在不同状态细胞下的多功能性和抑制不同的靶基因有关。总之,在本研究中发现LPS 刺激DCMECs 可使miR-223 的表达上调,通过筛选出LPS 构建乳腺炎模型的最佳浓度后,发现过表达miR-223 可抑制LPS 诱导的炎症因子TNF-α 的产生,减轻细胞凋亡,促进LPS 诱导的乳脂合成相关蛋白FASN 的表达,恢复LPS 破坏的乳脂合成能力,对LPS 诱导的DCMECs 具有正向调节作用。而miR-223 的作用机制是否是通过以往研究发现的靶点(FOXO 家族、Rho 家族、NF-κB 及NLRP3 等)发挥作用,还需要进一步深入探究。
4 结 论
1 μg/mL 的LPS 为诱导DCMECs 炎症反应的最佳浓度,LPS 刺激DCMECs 可促进miR-223 的表达,miR-223 过表达能够抑制LPS 诱导的DCMECs 炎症因子TNF-α 的表达,减轻LPS 诱导的DCMECs 凋亡反应,促进LPS 诱导的DCMECs 乳脂合成相关蛋白FASN 的表达及乳脂合成,提示miR-223 在DCMECs 中具有抵抗LPS 诱导的炎症反应的作用。

