HIV低病毒载量患者耐药检测的可行性及临床预后研究
杨壁珲
云南省传染病医院检验科,云南昆明 650301
通过有效的抗病毒治疗,目前艾滋病遏制已取得了较大的进展,艾滋病病死率下降,尽管取得了这些成效,但低病毒载量对于治疗效果仍具有挑战性。当血浆中病毒载量较低或无法检测到时,从血浆中获取病毒进行耐药检测成功率会降低,这就需要一种替代方法来进行耐药检测。从全血中提取前病毒DNA可以进行耐药检测,并且可以为抗病毒治疗提供耐药检测信息[1]。但国外有些研究表明抗病毒治疗启动后前病毒DNA基因型耐药性检测(DNA GRT)与治疗前血浆中HIV RNA基因型耐药性检测(RNA GRT)结果相比,DNA GRT并不能识别所有的耐药突变位点[2-3],而有研究则发现二者之间存在良好的一致性[4-5],但我国相关研究报道较少。故本研究探讨了低病毒载量样本RNA GRT和DNA GRT扩增率及2种方法检测结果的一致性,并分析了低病毒载量耐药对治疗的影响,现报道如下。
1 资料与方法
1.1一般资料 收集2018年1月至2021年12月云南省传染病医院HIV低病毒载量(HIV RNA在200~1 000 copy/mL)样本212份,包括血浆和全血,其中昆明市105份、曲靖市57份、红河哈尼族彝族自治州50份;男120例(57%),女92(43%)例;平均年龄(43.0±13.2)岁;病毒载量200~500 copy/mL样本113份,>500~1 000 copy/mL样本99份。本研究中涉及4种类型的低病毒载量情况:(1)基线低病毒载量;(2)抗病毒治疗失败后的低病毒载量,即抗病毒治疗时间>6个月,且抗病毒治疗失败(HIV RNA>1 000 copy/mL),每次病毒载量检测间隔时间>6个月,目前处于低病毒载量;(3)持续性低病毒载量,即抗病毒治疗时间>6个月,每次病毒载量检测间隔时间>6个月,至少连续2次出现低病毒载量;(4)一过性低病毒载量,即在达到病毒学抑制(HIV RNA<50 copy/mL)后单独出现过一次低病毒载量,之后再次呈现病毒学抑制。
1.2方法
1.2.1RNA GRT 212份低病毒载量标本全部进行RNA GRT。采用德国Qiagen公司QIAamp Viral RNAMini Kit试剂盒从血浆中抽提HIV RNA,进行HIV RNA核酸提取和基因扩增。把1 mL血浆进行超速离心(23 000 r/min)60 min,弃去多余的上清液后进行核酸提取。提取的RNA通过in-house耐药检测方法进行巢式聚合酶链反应扩增蛋白酶区和反转录酶区基因序列,扩增产物递交云南科耀生物公司进行Sanger测序。
1.2.2DNA GRT 从昆明市挑选40份全血样本进行DNA GRT。使用海力特核酸提取试剂从全血中提取HIV cDNA,进行全血HIV cDNA核酸提取和基因扩增。通过in-house耐药检测方法,进行巢式聚合酶链反应扩增蛋白酶区和反转录酶区基因序列,委托海力特公司完成Sanger测序得到蛋白酶区和发转录酶区基因序列。
1.2.3序列分析及应用 整理序列提交美国斯坦福大学HIV耐药数据库获得耐药位点和耐药程度分析结果。耐药程度分为敏感(S)、潜在耐药(P)、低度耐药(L)、中度耐药(I)、高度耐药(H),敏感和潜在耐药判定为敏感毒株,低度耐药、中度耐药和高度耐药判定为耐药毒株。
1.3观察指标 (1)低病毒载量样本的扩增效果;(2)评价RNA GRT和DNA GRT 2种方法检测结果的一致性;(3)低病毒载量的耐药情况;(4)低病毒载量对临床治疗效果的影响。
1.3统计学处理 采用Excel 2010进行数据收集和整理。
2 结 果
2.1低病毒载量样本的扩增效果
2.1.1RNA GRT 212份样本中扩增成功107份,扩增率为59.22%。其中昆明市未经反复冻融样本105份,扩增成功67份,扩增率为63.81%,曲靖市、红河哈尼族彝族自治州反复冻融样本107份,扩增成功40份,扩增率为37.38%。病毒载量在200~500 copy/mL的标本扩增率为44.25%(50/113),>500~1 000 copy/mL的标本扩增率为57.58%(57/99)。
2.1.2DNA GRT 检测的40份标本中,扩增成功24例,扩增率为60.0%。
2.1.3RNA GRT联合DNA GRT 40份样本中RNA GRT联合DNA GRT总扩增率为90.0%(36/40),其中2种方法共同扩增成功21份。
2.2低病毒载量的耐药情况分析 107份RNA GRT扩增成功的样本中,有32份是经过抗病毒治疗失败后的低病毒载量,有30份是持续性低病毒载量,有29份是一过性低病毒载量,有16份是基线低病毒载量。30份持续性低病毒载量样本中,有2份样本为同一患者不同时间点检测结果,经过8个月该患者耐药位点增加2个(K219Q、P225H)且耐药程度加深。持续性和一过性低病毒载量患者初始治疗方案基于齐多夫定(AZT)/替诺福韦(TDF)+拉米夫定(3TC)+依非韦伦(EFV)/奈韦拉平(NVP)有55例,基于AZT+3TC+LPV/洛匹那韦/利托那韦(r)有2例,基于艾维雷韦/考比司他(EVG/c)/恩曲他滨(FTC)/丙酚替诺福韦(TAF)有1例。持续性低病毒载量耐药发生率为48.28%(14/29),一过性低病毒载量耐药发生率为41.38%(12/29)。持续性和一过性低病毒载量患者核苷类反转录酶抑制剂(NRTIs)耐药突变位点主要为M184V,非核苷类反转录酶抑制剂(NNRTIs)耐药突变位点主要为E138Q/A,这两类低病毒载量患者各有1例检出蛋白酶体抑制剂(PI)耐药突变位点。持续性和一过性低病毒载量患者对AZT、3TC、TDF的耐药率均为6.89%、27.59%、6.89%,对EFV、NVP的耐药率均为27.59%、31.03%,对LPV/r的耐药率均为3.45%。16例基线低病毒载量患者中有1例检出NRTIs耐药突变位点M41L,引起AZT低度耐药,耐药率为6.25%。见表1。
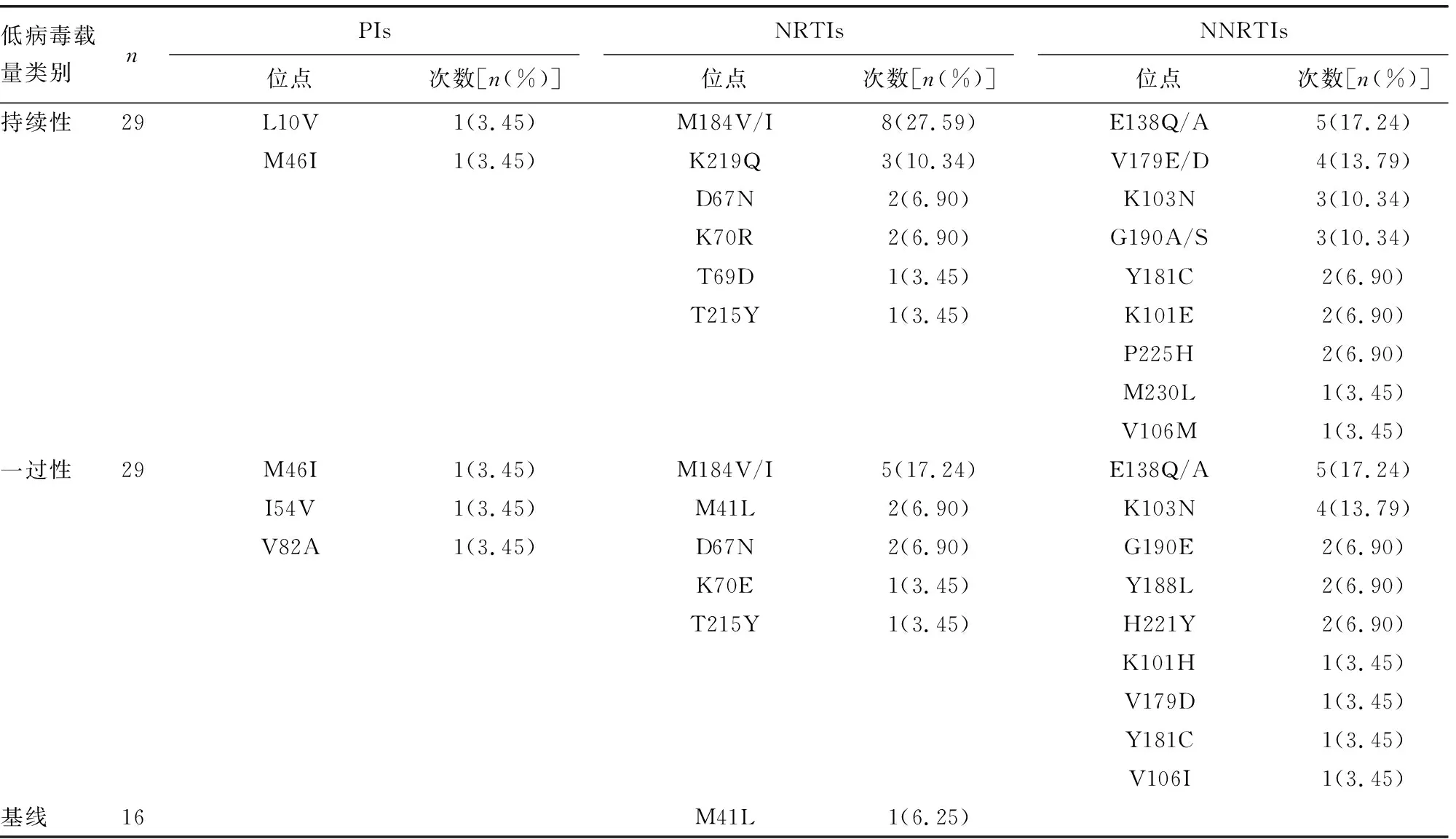
表1 低病毒载量耐药突变位点情况
2.3共同扩增标本的2种方法耐药突变位点检测结果比较 2种方法共同扩增成功的21份样本中,10份样本(47.62%)使用2种方法检出的耐药结果完全一致。RNA GRT共检出40个主要耐药突变位点,DNA GRT共检出17个主要耐药突变位点;有8份样本在RNA GRT中是检出耐药突变位点而在DNA GRT中是耐药位点缺失;有1份样本在DNA GRT中是检出耐药突变位点而在RNA GRT中是耐药位点缺失;有2份样本在RNA GRT中检出耐药突变位点但在DNA GRT中出现混合碱基引起不一致。PI耐药突变位点的不一致率为9.52%(2/21),NRTIs和NNRTIs耐药突变位点的不一致率均为42.86%(9/21)。见表2。
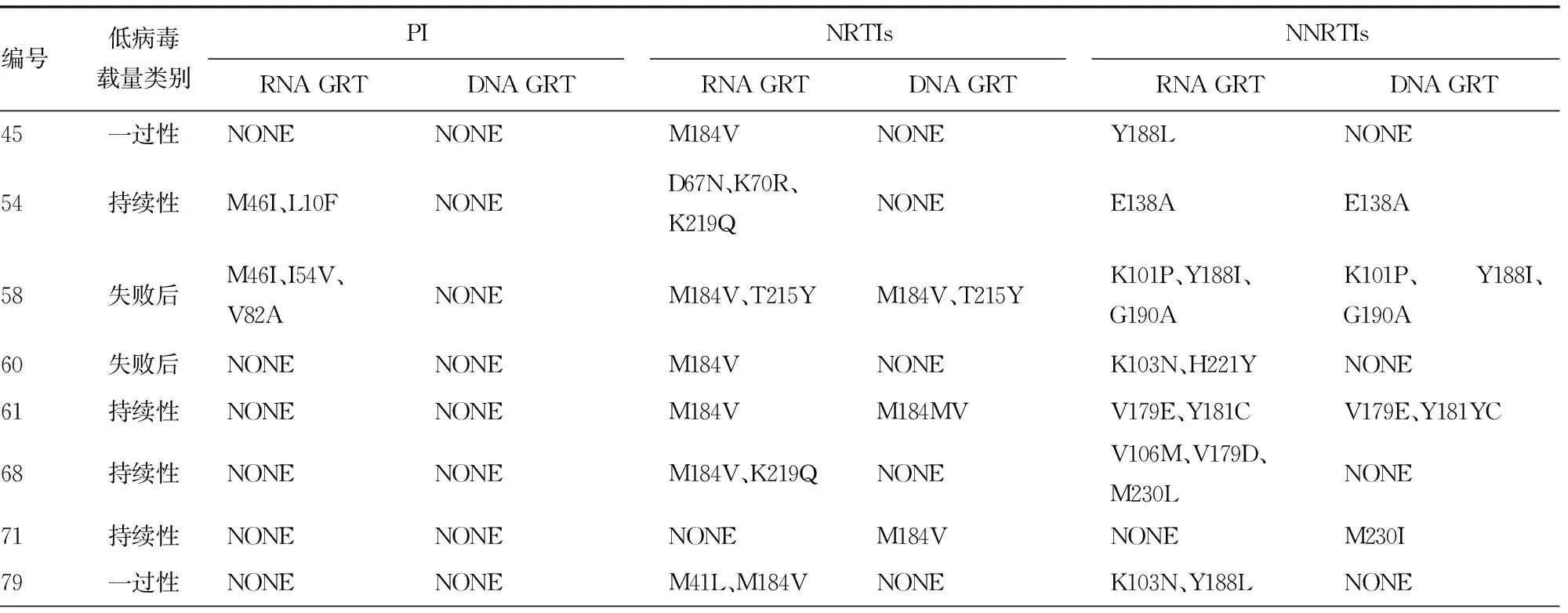
表2 2种方法检测不一致耐药突变位点情况
2.4低病毒载量对临床治疗效果的影响 29份持续性低病毒载量样本中,在12个月随访中有14份(48.27%)病毒载量<50 copy/mL,有13份(44.83%)病毒载量在>50~1 000copy/mL,有2份(6.90%)病毒载量>1 000 copy/mL。16份基线低病毒载量样本中,在12个月随访中有1份(6.25%)出现病毒载量>1 000 copy/mL,其余病毒载量均<50 copy/mL。
3 讨 论
无论是在全球范围还是在中国国内,HIV耐药检测都需引起高度重视,通过耐药结果可监测整个抗病毒治疗过程的有效性[6-8]。在发达国家,一旦患者HIV RNA病毒载量>50 copy /mL,立即给予干预如加强随访,耐药检测,药代动力学评估,甚至更换治疗药物。在我国由于医疗资源有限,只针对患者抗病毒治疗1年以上且病毒载量>1 000 copy/mL时进行耐药基因型检测,根据检测结果更换药物。当病毒载量≤1 000 copy /mL时,往往血浆RNA GRT扩增成功率不高,只有60%左右[9],加上目前指南尚无明确指导性方案及处理原则,因此导致治疗后病毒载量在>50~1 000 copy/mL的患者临床管理处于“灰色地带”,同时低病毒载量是目前实验室耐药监测中的盲区。在抗病毒治疗期间由于药物选择性压力产生的耐药毒株可能潜伏在病毒库中,那么当血浆中病毒载量较低或无法检测到时,血细胞中的前病毒DNA GRT可能有助于指导更换药物[10]。
本研究发现,低病毒载量未经反复冻融样本及时检测可提高血浆RNA GRT扩增率,且病毒载量越高扩增成功率越高。RNA GRT联合DNA GRT总扩增率可以达到90.0%。对于低病毒载量样本,全血中前病毒DNA GRT与血浆中RNA GRT结果之间存在一定的相关性,相对于RNA GRT,DNA GRT会有一定程度的耐药信息丢失。在本研究中只有基线低病毒载量样本2种方法检测结果呈现出高度的一致性,这与之前的一些研究结果相似[11-12],有研究报道只有在没有发生抗病毒治疗失败的情况下二者检测结果才具有高度的一致性[13]。DNA GRT可能无法检测到所有随时间发生变化的耐药突变位点[14]。本研究中DNA GRT检测出耐药位点而RNA GRT未检测出,可能是耐药位点的积累经历了这4个阶段:(1)HIV DAN碱基出现优势耐药突变位点;(2)HIV DNA的优势耐药突变位点被复制扩增,开始出现耐药病毒;(3)随着优势耐药突变位点的积累及耐药病毒复制,可能出现低病毒血症;(4)耐药病毒快速增加,临床表现为病毒反弹或治疗失败[15]。尽管RNA GRT可能更直接地反映患者体内耐药情况,但HIV前病毒DNA也能在一定程度上反映患者耐药情况,并能将耐药出现的时间点提前。RNA GRT检测出耐药位点而DNA GRT未检测出的原因可能为HIV病毒耐药基因PCR模板来源于全血中的HIV前病毒DNA,所采用的Sanger测序策略通过优先测序总序列中丰度占比最高的优势DNA序列,这些优势序列的占比理论上要超过总序列数的40%,更加倾向于检测优势耐药毒株。HIV DAN水平的耐药突变信息,代表HIV感染者外周血HIV储存库中的优势耐药毒株,在DNA突变位点未成为优势耐药突变位点时仍可转录出突变的病毒,这是Sanger测序的局限性。在接下来的研究中有必要使用深度测序技术,以便尽早发现HIV感染者出现病毒学失败,为临床抗病毒治疗方案的制订和调整提供有效的参考意见。
本研究发现,持续性低病毒载量患者耐药发生率为48.28%,主要突变位点是NRTIs M184V和NNRTIs E138Q/A,PI耐药突变位点较少,只检出1例,可能与研究对象中二线药物使用率低有关。本研究中有1例持续性低病毒载量患者在8个月内出现新增耐药位点且药物耐药程度加深。在持续性低病毒载量患者中,在12个月随访中有48.28%病毒载量<50 copy/mL,44.83%病毒载量>50~1 000 copy/mL,病毒载量>1 000 copy/mL只有6.9%,这时仍有可能及时抑制病毒,重新获得较好的治疗效果。因此在低病毒载量检出耐药结果后,尽快采取干预措施,降低后期病毒学失败风险。有研究报道持续性低病毒载量耐药位点的积累可能会增加后续治疗病毒学失败风险[16],基线低病毒载量患者与基线没有发生低病毒载量患者相比,后期发生病毒学失败的风险高36倍[17]。单次出现病毒载量>400 copy/mL患者病毒学失败风险增加[18-19]。因此还应当关注基线低病毒载量和单次出现低病毒载量患者。
综上所述,低病毒载量进行耐药基因型检测是可行的,RNA GRT和DNA GRT 2种检测方法结果存在一定的相关性。美国治疗指南建议,当病毒载量在20~1 000 copy/mL时使用前病毒DNA GRT进行检测,但在解释结果时需谨慎[20]。总之,应尽早识别耐药突变位点,更换治疗方案,预防后期治疗失败。

