血清Klotho、SDF-1在POAG患者中的水平及意义
李 宁,杨清清
西电集团医院眼科,陕西西安 710077
原发性开角型青光眼(POAG)是一种因病理性眼压升高导致的视野缺损与视神经乳头状受损的眼部疾病,该病早中期发病隐匿且无典型症状,目前临床上主要围绕降低眼压和缓解视力损害对该病进行治疗,虽然可取得一定的疗效,但视野改善效果有限[1]。POAG的发病机制较为复杂,可能与眼部血流动力学改变、炎症反应、巩膜内管异常及小梁网异常等因素有关[2-3]。Klotho是一种抗衰老蛋白,具有保护血管、抑制炎症反应、调节氧化应激和抑制细胞凋亡等多种生理功能,参与动脉粥样硬化、高血压、糖尿病等相关疾病的进展[4],另有研究表明Klotho可改善血管内皮损伤,维持血管功能稳定[5]。基质细胞衍生因子-1(SDF-1)是趋化因子家族成员,在促进血管生成、介导炎症因子释放方面发挥重要作用,已被证实与糖尿病周围神经病变相关[6]。笔者推测血清Klotho和SDF-1可能与POAG病理进展有关,故本文探讨了POAG患者血清Klotho、SDF-1与炎症因子和视神经损伤的关系,以及血清Klotho、SDF-1对POAG的诊断价值,以期为POAG的诊断和治疗提供参考。现报道如下。
1 资料与方法
1.1一般资料 选择2017年1月至2022年12月本院收治的POAG患者110例(143眼)作为研究对象,根据视神经损伤程度相关标准[7]进行分组,将视野平均缺损值<6 dB的39例患者(51眼)分为轻度组,6~12 dB的37例患者(48眼)分为中度组,>12 dB的34例患者(44眼)分为重度组。纳入标准:(1)符合POAG的临床诊断标准[8],存在视神经受损;(2)首次发病,年龄≥18岁;(3)无既往视网膜、眼内手术史。排除标准:(1)视野改变无法满足静态视野检查者;(2)近期使用过抗菌药物或有青光眼治疗史者;(3)合并急性感染性疾病、恶性肿瘤、其他眼部疾病、自身免疫性疾病者;(4)有肝、肾、心等脏器功能不全者。另选择本院同期收治的白内障患者(符合白内障的相关临床诊断标准[9],年龄>18岁,无既往视网膜、眼内手术史)34例(48眼)为白内障组,以及同期在本院体检的健康志愿者(裸眼或矫正视力>0.6,年龄>18岁,无白内障家族、青光眼史,视野检测正常,无视神经疾病,无既往视网膜、眼内手术史)34例(68眼)为对照组。各组研究对象的一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。本研究经本院医学伦理委员会批准(审批号:20161207158),所有研究对象或其家属均自愿签署知情同意书。

表1 各组研究对象的一般资料比较[n(%)或
1.2方法 POAG患者和白内障患者于入院次日、对照组志愿者于体检当日采集清晨空腹肘静脉血6 mL,经2 500 r/min离心12 min,离心半径8 cm,提取上清液,采用酶联免疫吸附试验(ELISA)检测所有研究对象血清Klotho、SDF-1、白细胞介素-2(IL-2)、白细胞介素-6(IL-6)、白细胞介素-18(IL-18)、肿瘤坏死因子-α(TNF-α)水平。Klotho试剂盒购于江苏晶美生物科技有限公司,SDF-1试剂盒购于上海雅吉生物科技有限公司,IL-2、IL-6、IL-18、TNF-α试剂盒均购于上海双赢生物科技有限公司。检测过程中的标准品稀释、加样、温育、配液、洗涤、加酶、显色等操作均严格按照试剂盒说明进行,终止反应后15 min内在450 nm波长处测量各孔吸光度,并检测各指标水平,重复3次取平均值。

2 结 果
2.1各组血清Klotho、SDF-1水平比较 血清Klotho水平为重度组<中度组<轻度组<白内障组<对照组,且任意两组间比较,差异均有统计学意义(P<0.05)。血清SDF-2水平为重度组>中度组>轻度组>白内障组>对照组,且任意两组间比较,差异均有统计学意义(P<0.05)。见表2。
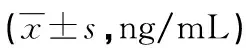
表2 各组血清Klotho、SDF-1水平比较
2.2各组血清IL-2、IL-6、IL-18、TNF-α水平比较 血清IL-2、IL-6、IL-18、TNF-α水平为重度组>中度组>轻度组>白内障组>对照组,且任意两组间比较,差异均有统计学意义(P<0.05)。见表3。
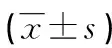
表3 各组血清IL-2、IL-6、IL-18、TNF-α水平比较
2.3POAG患者治疗前血清Klotho、SDF-1水平与IL-2、IL-6、IL-18、TNF-α水平的相关性 POAG患者治疗前血清Klotho水平与IL-2、IL-6、IL-18、TNF-α水平呈负相关(P<0.05),血清SDF-1水平与IL-2、IL-6、IL-18、TNF-α水平呈正相关(P<0.05)。见表4。

表4 POAG患者血清Klotho、SDF-1与IL-2、IL-6、IL-18、TNF-α的相关性
2.4血清Klotho、SDF-1单独及联合诊断POAG的价值 血清Klotho、SDF-1及2项指标联合诊断POAG的曲线下面积(AUC)分别为0.879、0.875和0.938。见表5和图1。

图1 血清Klotho、SDF-1单独及联合诊断POAG的ROC曲线

表5 血清Klotho、SDF-1单独及联合诊断POAG的价值
3 讨 论
POAG是一种不可逆性致盲眼病,会严重影响患者的视觉功能、降低其生活质量,该病的视神经损伤机制尚不完全清楚,相关研究表明POAG主要与视网膜神经节细胞的凋亡相关[10]。另有研究发现炎症反应参与了POAG的病理进展过程,一方面炎症介质可以促进视网膜神经节细胞凋亡[11];另一方面,炎症因子可促使虹膜、房角发生病理性改变,导致虹膜与小梁网粘连,引起视野缺损与视神经损伤[12]。本研究显示,血清IL-2、IL-6、IL-18、TNF-α水平为重度组>中度组>轻度组>白内障组>对照组,任意两组间比较,差异均有统计学意义(P<0.05),表明炎症反应在POAG的病理进展过程中扮演着重要角色,且炎症反应程度与POAG视神经损伤程度有密切的关系,炎症反应越激烈视神经损伤程度越严重。
Klotho属于一种跨膜蛋白,具有β-葡萄糖醛酸苷酶活性,起调节钙磷代谢、保护心血管、抗炎和抗细胞凋亡等生物学作用[13]。文雪薇[14]的一项研究表明,Klotho蛋白可激活PI3K/Akt-Nrf2/HO-1信号通路,增强对氧化应激和炎症的抵抗,保护视网膜健康。因此推测Klotho蛋白参与了POAG的进程进展。本研究结果显示,血清Klotho水平为重度组<中度组<轻度组<白内障组<对照组,任意两组间比较,差异均有统计学意义(P<0.05),提示Klotho可能参与了POAG的病理变化过程,且与视神经损伤程度密切相关。推测其可能的机制:(1)Klotho水平降低,抗细胞凋亡功能减弱,促使血管内皮细胞凋亡增加,引起血管受损导致血管收缩功能障碍,造成视网膜灌注不足引起视神经损伤[15];(2)Klotho水平降低,抗细胞凋亡功能减弱,使视网膜神经节细胞凋亡增加,进而引起视神经损伤[16];(3)Klotho水平降低,其抗炎抗氧化能力减弱,导致眼部炎症反应加剧,加重POAG患者视神经损伤[17]。本研究的相关性分析结果显示,POAG患者血清Klotho水平与IL-2、IL-6、IL-18、TNF-α水平呈负相关(P<0.05),进一步证实了Klotho通过介导炎症反应参与POAG病理变化过程。
SDF-1又称趋化因子CXCL12,属于趋化因子蛋白家族,是小分子的细胞因子,可与其配体CXCR4特异性结合,刺激中性粒细胞进入毛细血管中,参与血液循环并介导炎症反应[18]。本研究结果显示,血清SDP-1水平为重度组>中度组>轻度组>白内障组>对照组,任意两组间比较差异均有统计学意义(P<0.05),且POAG患者血清SDF-1水平与IL-2、IL-6、IL-18、TNF-α水平呈正相关(P<0.05),提示SDF-1可能参与了POAG的病理变化过程,且与视神经损伤程度和炎症因子密切相关。其机制可能是:(1)SDF-1水平升高介导产生更多的炎症因子,加剧炎症反应,促使虹膜、房角产生病理变化,造成视神经损伤[19];(2)SDF-1水平升高刺激了血管内皮收缩,产生促血管生长因子,引起眼部血流动力学改变和巩膜内管异常,加深患者视神经损伤[20]。
本研究ROC曲线结果显示,血清Klotho、SDF-1单独及2项联合诊断POAG的AUC分别为0.879、0.875和0.938,灵敏度分别为92.73%、78.18%和87.27%,特异度分别为70.59%、86.76%和85.29%。表明血清Klotho、SDF-1均对POAG具有一定的诊断价值,且2项联合检测对POAG的诊断效能优于各指标单独检测。提示2项指标联合检测能更全面反映POAG患者的病情或状态,具有较高预测效能。
综上所述,POAG患者血清Klotho、SDF-1水平与IL-2、IL-6、IL-18、TNF-α水平和视神经损伤有关,并参与了POAG患者病理进展过程,血清Klotho、SDF-1联合检测对POAG具有较好的诊断价值,值得临床推广。但本研究也存在部分不足,如仅进行单次指标检测,未考虑未来病情变化对指标水平的影响;各组样本量少,且来源单一,研究结果可能存在偏倚,未来还需扩大样本量开展多中心研究以进一步验证。

