八珍汤合白术附子汤对多囊卵巢综合征大鼠糖代谢及雌激素水平的调节作用
陈俊杰 许雪梅 李岩 傅金英


摘要:目的 探討八珍汤合白术附子汤对多囊卵巢综合征大鼠糖代谢及雌激素水平的调节作用。方法 采用皮下注射人绒毛膜促性腺激素(HCG)联合胰岛素方法建立多囊卵巢综合征大鼠模型,随机分为多囊卵巢综合征组、白术附子汤组(6.4 g/kg)、八珍汤组(9.2 g/kg)、八珍汤合白术附子汤组(11.55 g/kg)及己烯雌酚组(0.5 mg/kg),另设空白对照组(未造模大鼠),每组10只。测定并计算子宫指数,采用血糖仪测定空腹血糖(FBG)、餐后2 h血糖(2 h PBG),测定空腹胰岛素(FINS)并计算胰岛素敏感指数(ISI)和胰岛素抵抗指数(IR),采用酶联免疫吸附试验(ELISA)检测血清雌二醇(E2)、睾酮(T)、黄体生成素(LH)、卵泡刺激素(FSH)、泌乳素(PRL)、抗苗勒氏管激素(AMH)、胰岛素样生长因子1(IGF-1),卵巢组织C反应蛋白(CRP)、白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α、总过氧化物酶活性(T-AOC)、超氧化物歧化酶(SOD)及丙二醛(MDA)水平,苏木精-伊红(HE)染色法检查卵巢组织病理学变化,实时定量聚合酶链式反应(qPCR)测定子宫内膜雄激素受体相关蛋白(ARA)70、肉瘤基因羧基末端激酶结合蛋白(CBP)、可溶性补体受体1型(SCR1)、同源框异型基因A10(HOXA10) mRNA水平及卵巢组织腺苷酸激活蛋白激酶(AMPK)、葡萄糖转运蛋白4(GLUT4)、过氧化物酶体增殖物激活受体γ(PPARγ) mRNA表达,Western blot测定卵巢组织AMPK、GLUT4、PPARγ蛋白表达。结果 与多囊卵巢综合征组比较,白术附子汤组、八珍汤组和八珍汤合白术附子汤组大鼠子宫指数,FINS、FBG、2 h PBG、IR水平,血清T、LH、FSH、PRL、AMH、IGF-1水平,卵巢组织CRP、IL-6、TNF-α、T-AOC和MDA水平,子宫内膜ARA70、CBP、SCR1 mRNA水平均降低(P<0.05);ISI,血清E2,卵巢组织SOD,子宫内膜HOXA10 mRNA表达,卵巢组织AMPK、GLUT4、PPARγ mRNA和蛋白表达水平升高(P<0.05);八珍汤合白术附子汤组以上指标变化均较白术附子汤组和八珍汤组显著(P<0.05)。结论 八珍汤合白术附子汤可通过改善多囊卵巢综合征大鼠糖代谢、卵巢组织氧化及炎症损伤、子宫内膜容受性、雌激素水平,抑制多囊卵巢综合征疾病进展,其机制可能与调节AMPK/GLUT4/PPARγ通路有关。
关键词:术附汤;八珍汤;多囊卵巢综合征;雌激素类;糖代谢;八珍汤合白术附子汤
中图分类号:R285.5文献标志码:ADOI:10.11958/20230549
Effects of Bazhen Decoction combined with Baizhu Fuzi Decoction on glucose metabolism and estrogen levels in rats with polycystic ovary syndrome
Abstract: Objective To study the regulation effects of Bazhen Decoction combined with Baizhu Fuzi Decoction on glucose metabolism and estrogen level in rats with polycystic ovary syndrome. Methods The rat model of polycystic ovary syndrome was established by subcutaneous injection of human chorionic gonadotropin (HCG) combined with insulin. Rats were randomly divided into the polycystic ovary syndrome group, the Baizhu Fuzi Tang group (6.4 g/kg), the Bazhen Tang group (9.2 g/kg), the Bazhen Tang combined with Baizhu Fuzi Tang group (11.55 g/kg) and the diethylstilbestrol group (0.5 mg/kg). A blank control group (unmodulated rats) was set up with 10 rats in each group. The uterine index of rats was determined and calculated. Fasting blood glucose (FBG), 2 h postprandish blood glucose (2 h PBG) and fasting insulin (FINS) were determined and insulin sensitivity index (ISI) and insulin resistance index (IR) were calculated. Serum estradiol (E2), testosterone (T), luteinizing hormone (LH), follicle stimulating hormone (FSH), prolactin (PRL), anti-Mullerian tube hormone (AMH) and insulin-like growth factor 1 (IGF-1), C-reactive protein (CRP), interleukin (IL)-6, tumor necrosis factor (TNF)-α, total peroxidase activity (T-AOC), superoxide dismutase (SOD) and malondialdehyde (MDA) levels in ovarian tissue were detected by enzyme-linked immunosorbent assay (ELISA). The pathological changes of ovarian tissue were detected by hematoxylin-eosin (HE) staining. Real-time quantitative polymerase chain reaction (qPCR) was used to determine mRNA levels of ARA70, CBP, SCR1 and HOXA10 in endometrium and mRNA expressions of AMPK, GLUT4 and PPARγ in ovarian tissue. Western blot assay was used to determine expression levels of AMPK, GLUT4 and PPARγ in ovarian tissue. Results Compared with the polycystic ovary syndrome group, uterine index, FINS, FBG, 2 h PBG, IR levels, serum T, LH, FSH, PRL, AMH, IGF-1 levels, ovarian tissue CRP, IL-6, TNF-α, T-AOC and MDA level, endometrial ARA70, CBP, SCR1 mRNA level of rats decreased significantly in the Baizhu Fuzi decoction group, the Bazhen decoction group and the Bazhen decoction combined with Baizhu Fuzi decoction group (P<0.05). ISI level, serum E2 level, ovarian tissue SOD level, endometrial HOXA10 mRNA level, ovarian tissue AMPK, GLUT4 and PPARγ mRNA and protein levels were significantly increased (P<0.05). The above indexes were significantly changed in the Bazhen decoction and Bazhu Fuzi decoction group than those of the Bazhu Fuzi decoction group and the Bazhen decoction group (P<0.05). Conclusion Bazhen Decoction combined with Baizhu Fuzi Decoction can regulate glucose metabolism, inhibit ovarian tissue oxidation and inflammatory damage, improve endometrium tolerance, regulate estrogen level, and improve the progression of polycystic ovary syndrome in rats. The mechanism may be related to the regulation of AMPK/GLUT4/PPARγ pathway.
Key words: Zhu Fu Tang; Ba Zhen Tang; polycystic ovary syndrome; estrogens; glucose metabolism; Bazhen Decoction combined with Baizhu Aconite Decoction
多囊卵巢综合征是临床常见的妇科内分泌性疾病,以多毛、闭经、不孕等多种临床症状为主要表现,严重影响患者身心健康及生活质量[1-2]。然而,目前临床用于治疗多囊卵巢综合征的药物有限,且存在有效率低、患者依从性差等缺点[3]。研究表明,糖代谢紊乱及胰岛素抵抗与多囊卵巢综合征的发生及进展密切相关,多囊卵巢综合征患者糖代谢异常会影响体内雄激素水平,促进患者卵巢组织病理进展[4]。八珍汤及白术附子汤是以中医理论为基础,由中药饮片组成的中药方剂。近年来研究表明,八珍汤及白术附子汤对多囊卵巢综合征具有一定的治疗效果[5-6]。然而目前关于八珍汤及白术附子汤对多囊卵巢综合征的药理作用及机制尚鲜见研究报道。本研究通过研究八珍汤合白术附子汤对多囊卵巢综合征大鼠糖代谢及雌激素水平的调节作用,为八珍汤合白术附子汤的药理作用研究提供参考。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂 八珍汤由人参3 g、白术10 g、白茯苓8 g、当归10 g、川芎5 g、白芍药8 g、熟地黄15 g、炙甘草5 g、大枣10 g及生姜5 g组成;白术附子汤由白术15 g、附子15 g、生姜9 g、炙甘草12 g、大枣10 g组成;八珍汤合白术附子汤由人参3 g、白术15 g、白茯苓8 g、当归10 g、川芎5 g、白芍药8 g、熟地黄15 g、炙甘草12 g、大枣10 g、生姜9 g及附子15 g组成。各方剂均按照以下方法制备:分别将药材饮片置于1 000 mL蒸馏水中浸泡1 h,煎煮45 min,过滤,留取滤液,将药材残渣置于800 mL蒸馏水中再次煎煮45 min,过滤,合并2次滤液,蒸发浓缩,八珍汤和白术附子汤制成生药含量为1 g/mL的制剂,八珍汤合白术附子汤制成生药含量为2 g/mL的制剂;所有药材饮片购自北京同仁堂药业有限公司。
己烯雌酚购自上海信谊天平药业有限公司;二喹啉甲酸(BCA)试剂盒、磷酸盐缓冲液(PBS)、增强型发光液(ECL)购自北京索莱宝科技有限公司;空腹胰岛素(FINS)酶联免疫吸附试验(ELISA)试剂盒购自天津本生健康科技有限公司;雌二醇(E2)、睾酮(T)ELISA试剂盒购自武汉华美生物工程有限公司;黄体生成素(LH)、泌乳素(PRL)ELISA试剂盒购自上海酶研生物科技有限公司;抗苗勒氏管激素(AMH)、C反应蛋白(CRP)ELISA试剂盒购自上海恒斐生物科技有限公司;卵泡刺激素(FSH)、胰岛素样生长因子1(IGF-1) ELISA试剂盒购自武汉菲恩生物科技有限公司;白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α、总过氧化物酶活性(T-AOC)、超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA试剂盒,山羊抗兔二抗PCR试剂盒、逆转录试剂盒购自上海碧云天生物技术有限公司;兔抗鼠腺苷酸激活蛋白激酶(AMPK)、葡萄糖转运蛋白4(GLUT4)、过氧化物酶体增殖物激活受体γ(PPARγ)、甘油醛-3-磷酸脱氢酶(GAPDH)一抗购自艾博抗(上海)贸易有限公司;PCR引物设计及合成由赛默飞世尔科技有限公司完成。
1.1.2 设备及仪器 E-Gel Imager凝胶成像仪购自赛默飞世尔科技有限公司;EnVision多功能酶标仪购自珀金埃尔默企业管理有限公司;IX83荧光倒置显微镜购自日本奥林巴斯公司;Accu-Chek Performa血糖仪购自罗氏诊断产品有限公司;Mastercycler nexus梯度PCR仪购自Eppendorf艾本德中国有限公司。
1.1.3 实验动物 63只SD大鼠,雌性,清洁级,6~8周龄,体质量200~220 g,购自河南省实验动物中心,实验动物生产许可证号:SCXK(豫)2022-0001,饲养于实验动物房,温度20~25 ℃,相对湿度40%~70%,光照阴暗12 h交替。本实验方案经河南省中医院伦理委员会批准(批准号:ky20211027016)。
1.2 实验方法
1.2.1 多囊卵巢综合征大鼠模型的建立 按照随机数字表法将大鼠分为空白对照组(10只)及造模组(53只)。造模组参照文献[7]采用皮下注射人絨毛膜促性腺激素(HCG)联合胰岛素方法建立多囊卵巢综合征大鼠模型,同时检测大鼠阴道涂片,并随机抽取3只大鼠进行卵巢组织病理检查,以大鼠完全失去动情周期变化及卵巢组织出现病理性改变视为造模成功。53只大鼠均造模成功。
1.2.2 分组及给药 造模后,按照随机数字表法将大鼠分为多囊卵巢综合征组、白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组,每组10只。白术附子汤组、八珍汤组、八珍汤合白术附子汤组分别灌胃白术附子汤6.4 g/kg[6]、八珍汤9.2 g/kg[8]、八珍汤合白术附子汤11.55 g/kg(以生药含量计),己烯雌酚组灌胃己烯雌酚0.5 mg/kg[9],空白对照组及多囊卵巢综合征组灌胃生理盐水,1次/d,连续30 d。
1.2.3 大鼠子宫指数的测定 末次给药12 h后测定大鼠体质量(记为W),大鼠颈椎脱臼法处死后迅速分离子宫并称质量(记为H),计算大鼠子宫指数=H(mg)/W(g)。
1.2.4 大鼠FINS、空腹血糖(FBG)、餐后2 h血糖(2 h PBG)、胰岛素敏感指数(ISI)和胰岛素抵抗指数(IR)的测定 大鼠末次给药后禁食12 h,眼眶取血,使用罗氏Accu-Chek Performa血糖仪测定FBG水平,使用ELISA试剂盒测定FINS水平。按照2 g/kg灌胃20%葡萄糖溶液,2 h后尾静脉取血,使用血糖仪测定2 h PBG,严格按照试剂盒说明书进行操作,计算IR及ISI。IR=FBG×FINS/22.5,ISI=-ln(FBG×FINS)。
1.2.5 大鼠血清E2、T、LH、FSH、PRL、AMH、IGF-1的测定 大鼠腹腔注射10%水合氯醛(3 mL/kg)麻醉后,腹主动脉取血,使用ELISA试剂盒分别测定E2、T、LH、FSH、PRL、AMH、IGF-1水平,严格按照试剂盒说明书进行操作。
1.2.6 大鼠卵巢组织CRP、IL-6、TNF-α、T-AOC、SOD及MDA的测定 大鼠颈椎脱臼法处死并分离卵巢组织,置于蒸馏水中并用组织匀浆器充分裂解匀浆,4 ℃、8 000 r/min离心10 min,取上清液,使用ELISA法測定CRP、IL-6、TNF-α、T-AOC、SOD及MDA水平,严格按照试剂盒说明书进行操作。
1.2.7 大鼠卵巢组织病理学检查 大鼠颈椎脱臼法处死后,迅速分离大鼠卵巢组织,中性甲醛固定24 h后石蜡包埋并制成5 μm切片,行常规苏木精-伊红(HE)染色,置于显微镜下观察拍照。
1.2.8 qPCR检测大鼠子宫内膜和卵巢组织子宫内膜雄激素受体相关蛋白(ARA)70、肉瘤基因羧基末端激酶结合蛋白(CBP)、可溶性补体受体1型(SCR1)、同源框异型基因A10(HOXA10)、AMPK、GLUT4、PPARγ基因表达 大鼠颈椎脱臼法处死,分离子宫内膜和卵巢组织,分别提取总RNA,逆转录为cDNA后,使用PCR试剂盒测定子宫内膜ARA70、CBP、SCR1、HOXA10和卵巢组织AMPK、GLUT4、PPARγ mRNA水平。反应条件:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共计30个循环,72 ℃最终延伸10 min。以GAPDH为内参,采用2-ΔΔCt法测定各基因相对水平。引物序列见表1。
1.2.9 Western blot检测大鼠卵巢组织AMPK、GLUT4及PPARγ蛋白表达 以颈椎脱臼法处死大鼠,分离卵巢组织,置于组织裂解液中在冰盒上裂解,组织匀浆器充分匀浆,4 ℃、8 000 r/min离心10 min,取上清液,使用BCA试剂盒测定总蛋白水平,样本经10%葡聚糖-聚丙烯酰胺凝胶电泳(110 V恒压)分离,然后按照200 mA恒流电转移2 h后,加入1∶500稀释的兔抗大鼠GAPDH、AMPK、GLUT4及PPARγ抗体,4 ℃孵育过夜,TBST漂洗后用1∶2 000稀释的辣根过氧化物酶标记的山羊抗兔IgG二抗孵育1 h,漂洗后用ECL化学发光试剂盒增强发光,利用E-Gel Imager凝胶成像仪成像,以GAPDH为内参,使用Image J 12.0软件测定蛋白相对表达量。
1.3 统计学方法 采用SPSS 26.0软件进行数据分析。计量资料均符合正态分布且方差齐,以均数±标准差([[x] ±s
])表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠子宫指数比较 空白对照组、多囊卵巢综合征组、白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组子宫指数(mg/g)分别为1.06±0.45、2.94±0.12、2.14±0.34、1.75±0.42、1.27±0.06和1.13±0.08,差异有统计学意义(n=10,F=75.781,P<0.05)。与空白对照组比较,多囊卵巢综合征组子宫指数升高(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组大鼠子宫指数降低(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组子宫指数降低(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组子宫指数差异无统计学意义(P>0.05)。
2.2 各组大鼠FINS、FBG、2 h PBG、ISI以及IR比较 与空白对照组比较,多囊卵巢综合征组FINS、FBG、2 h PBG和IR水平升高,ISI水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组和八珍汤合白术附子汤组大鼠FINS、FBG、2 h PBG和IR水平降低,ISI水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组FINS、FBG、2 h PBG和IR水平降低,ISI水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组FINS、FBG、2 h PBG和IR水平降低,ISI水平升高(P<0.05),见表2。
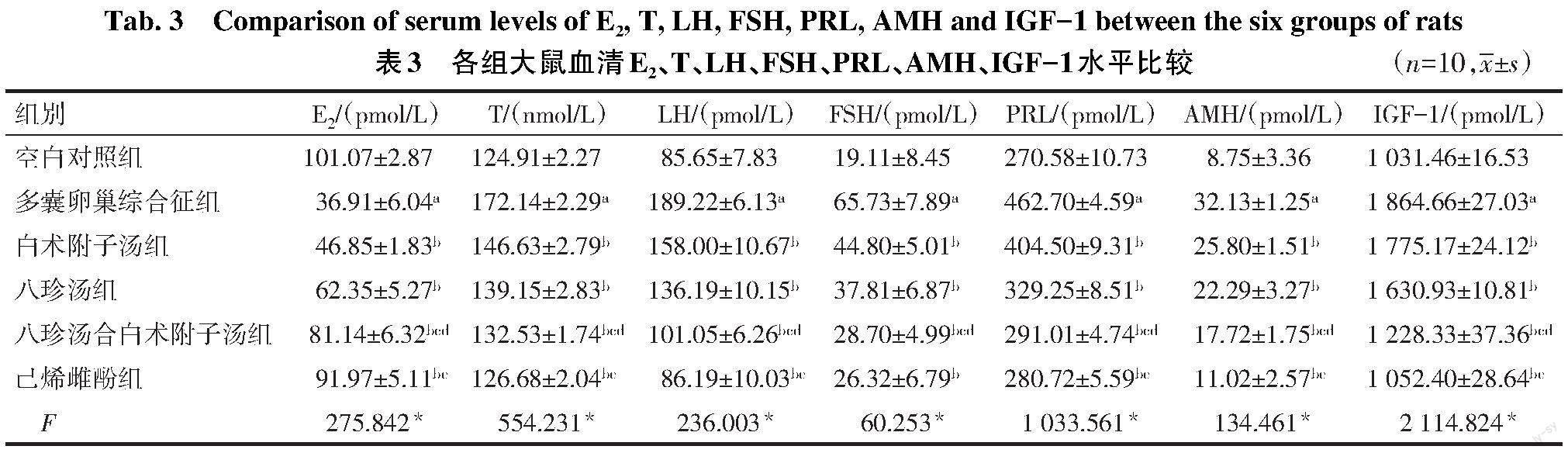
2.3 各组大鼠血清E2、T、LH、FSH、PRL、AMH和IGF-1比较 与空白对照组比较,多囊卵巢综合征组血清T、LH、FSH、PRL、AMH和IGF-1水平升高,E2水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组血清T、LH、FSH、PRL、AMH和IGF-1水平降低,E2水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组血清T、LH、FSH、PRL、AMH和IGF-1水平降低,E2水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组T、LH、PRL、AMH和IGF-1水平升高,E2水平降低(P<0.05),见表3。
2.4 各组大鼠卵巢组织CRP、IL-6、TNF-α、T-AOC、SOD和MDA水平比较 与空白对照组比较,多囊卵巢综合征组卵巢组织CRP、IL-6、TNF-α、T-AOC和MDA水平升高,SOD水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组卵巢组织CRP、IL-6、TNF-α、T-AOC和MDA水平降低,SOD水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组卵巢组织CRP、IL-6、TNF-α、T-AOC和MDA水平降低,SOD水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组CRP、IL-6、TNF-α、T-AOC和MDA水平降低,SOD水平升高(P<0.05),见表4。
2.5 各组大鼠卵巢组织病理学改变 空白对照组卵巢组织细胞排列整齐,无明显病理性改变;与空白对照组比较,多囊卵巢综合征组卵巢组织细胞排列杂乱,卵巢组织多囊样改变;与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组卵巢组织病理明显改善,见图1。
2.6 各组大鼠子宫内膜ARA70、CBP、SCR1、HOXA10 mRNA水平比较 与空白对照组比较,多囊卵巢综合征组子宫内膜ARA70、CBP、SCR1 mRNA水平升高,HOXA10 mRNA水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组子宫内膜ARA70、CBP、SCR1 mRNA水平降低,HOXA10 mRNA水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组子宫内膜ARA70、CBP、SCR1 mRNA水平降低,HOXA10 mRNA水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组ARA70、CBP、HOXA10 mRNA水平降低,SCR1 mRNA水平升高(P<0.05),见表5。
2.7 各组大鼠卵巢组织AMPK、GLUT4、PPARγ mRNA表达水平比较 与空白对照组比较,多囊卵巢综合征组卵巢组织AMPK、GLUT4、PPARγ mRNA水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组卵巢组织AMPK、GLUT4、PPARγ mRNA水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组卵巢组织AMPK、GLUT4、PPARγ mRNA水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组AMPK、GLUT4、PPARγ mRNA水平升高(P<0.05),见表6。
2.8 各组大鼠卵巢组织AMPK、GLUT4和PPARγ蛋白表达水平比较 与空白对照组比较,多囊卵巢综合征组卵巢组织AMPK、GLUT4和PPARγ蛋白水平降低(P<0.05);与多囊卵巢综合征组比较,白术附子汤组、八珍汤组、八珍汤合白术附子汤组及己烯雌酚组卵巢组织AMPK、GLUT4和PPARγ蛋白水平升高(P<0.05);与白术附子汤组和八珍汤组比较,八珍汤合白术附子汤组卵巢组织AMPK、GLUT4和PPARγ蛋白水平升高(P<0.05);与己烯雌酚组比较,八珍汤合白术附子汤组AMPK、GLUT4和PPARγ蛋白水平升高(P<0.05),见图2、表7。
3 讨论
目前,临床主要采用药物和手术治疗多囊卵巢综合征,其中,药物治疗以降低高雄激素药物、促排卵药物及胰岛素增敏剂等为主,但存在有效率低、复发率高等缺点,对于多囊卵巢综合征治疗药物的研发仍是当前主要工作重点之一。
八珍汤记载于中医学著作《正体类要》,由人参、白术、白茯苓、当归、川芎、白芍药、熟地黄、甘草、大枣及生姜组成,方中人参、熟地黄共为君药,起到补脾益肺,益气补血之功效,白术、茯苓、当归、芍药共为臣药,发挥健脾益气,燥湿利水,活血化瘀,消肿止痛之功效,川芎、大枣及生姜共为佐药,起活血行气,祛风止痛,益气生津之功效,甘草为使药,调和诸药。白术附子汤出自中医学著作《金匮要略》,由白术、附子、炙甘草、生姜、大枣组成,方中附子散寒止痛、回阳救逆,为君药,生姜解表散寒,为臣药,白术、炙甘草、大枣共为佐药,起到化湿祛风,健脾益气之功效,全方共奏,温阳通经,祛风除湿。张玉红等[5]研究表明,八珍汤能够显著改善青春期多囊卵巢综合征患者性激素水平,恢复月经周期;马要敏[6]研究证实,白术附子汤较传统西药治疗,能够显著改善多囊卵巢综合征患者卵巢窦卵泡数目及卵巢平均体积,调节患者体内睾酮及黄体生成素水平,显著改善患者月经周期。由此可见,八珍汤及白术附子汤在多囊卵巢综合征的治疗中具有较大潜力。
糖代谢异常与多囊卵巢综合征的发生及进展密切相关。董敏等[10]研究表明,降低血糖水平及IR能够显著改善多囊卵巢综合征大鼠卵巢组织损伤及病理进展;王琛等[11]研究证实调节多囊卵巢综合征患者血糖及IR水平能够显著改善患者性激素水平。本研究结果提示,八珍汤合白术附子汤能够显著调节多囊卵巢综合征大鼠血糖水平及IR,进而改善大鼠卵巢组织病理进展;且作用效果优于单独使用白术附子汤组及八珍汤;八珍汤合白术附子汤组对于多囊卵巢综合征的改善作用可能与其糖代谢调节作用密切相关。
ARA70、CBP、SCR1、HOXA10作为子宫内膜容受性相关基因,其水平体现了多囊卵巢综合征的发生及发展状态。张维怡等[12]研究表明升高多囊卵巢综合征大鼠子宫内膜组织HOXA10水平能够显著改善子宫内膜形态及组织病理学变化,改善子宫内膜容受性;郑冬雪等[13]研究证实,抑制多囊卵巢综合征大鼠子宫内膜ARA70、CBP、SCR1水平能够调节大鼠体内激素水平,促进卵泡发育,提高子宫内膜容受性。本研究结果提示,八珍汤合白术附子汤可通过调节ARA70、CBP、SCR1、HOXA10等基因表达改善多囊卵巢综合征大鼠子宫内膜容受性,且作用效果优于单独使用白术附子汤组及八珍汤。
E2、T、LH、FSH、PRL、AMH、IGF-1作为性激素的常用检验指标,其水平与多囊卵巢综合征的发生相关。张萍等[14]研究证实,抑制多囊卵巢综合征大鼠血清T、LH水平,升高E2、FSH水平能够显著改善多囊卵巢综合征大鼠卵巢组织疾病进展。本研究结果提示,八珍汤合白术附子汤能够通过调节多囊卵巢综合征大鼠性激素水平,促进卵巢组织及功能的恢复,且作用效果优于单独使用白术附子汤组及八珍汤。
CRP、IL-6、TNF-α、T-AOC、SOD和MDA作为组织细胞炎症损伤的标志性物质,其水平异常影响着卵巢组织病理状态及功能。周春玉[15]研究表明,抑制多囊卵巢綜合征患者体内CRP、TNF-α水平可改善患者卵巢组织病理变化及子宫内膜厚度;虎娜等[7]研究证实,多囊卵巢综合征大鼠卵巢组织T-AOC、SOD水平升高,MDA水平降低,可提高大鼠卵巢组织抗氧化能力,促进卵巢组织病理恢复。本研究结果提示,八珍汤合白术附子汤可抑制多囊卵巢综合征大鼠卵巢组织氧化应激反应及炎症损伤,修复卵巢组织病理改变。
本研究結果显示,八珍汤合白术附子汤可激活AMPK/GLUT4/PPARγ通路及相关蛋白表达,进而改善多囊卵巢综合征大鼠胰岛素抵抗,调节雌激素水平,抑制卵巢组织病理性改变。胡红梅等[16]研究表明提高PPARγ、GLUT4水平可促进小鼠糖代谢;万春平等[17]研究证实AMPK表达上调可改善胰岛素抵抗,调节糖代谢;罗新新等[18]研究表明,激活GLUT4、PPARγ表达可促进葡萄糖利用,调节糖代谢,改善胰岛素抵抗。唐阳琳等[19]研究表明,多囊卵巢综合征大鼠GLUT4水平升高可抑制胰岛素抵抗、卵巢组织及子宫内膜病变的发生。
综上所述,八珍汤合白术附子汤可调节多囊卵巢综合征大鼠糖代谢水平,抑制卵巢组织氧化及炎症损伤,改善大鼠子宫内膜容受性,调节雌激素水平,抑制多囊卵巢综合征疾病进展,其机制可能与调节AMPK/GLUT4/PPARγ通路有关。
参考文献
[1] ABRAHAM GNANADASS S,DIVAKAR PRABHU Y,VALSALA GOPALAKRISHNAN A. Association of metabolic and inflammatory markers with polycystic ovarian syndrome (PCOS):an update[J]. Arch Gynecol Obstet,2021,303(3):631-643. doi:10.1007/s00404-020-05951-2.
[2] AZZIZ R. Polycystic ovary syndrome[J]. Obstet Gynecol,2018,132(2):321-336. doi:10.1016/j.cnur.2018.04.008.
[3] ESCOBAR-MORREALE H F. Polycystic ovary syndrome:definition,aetiology,diagnosis and treatment[J]. Nat Rev Endocrinol,2018,14(5):270-284. doi:10.1038/nrendo.2018.24.
[4] 翁瑞文,刘义,张蔚,等. 多囊卵巢综合征患者雄激素与糖代谢指标的关系研究[J]. 中国全科医学,2022,25(32):4046-4051. WENG R W,LIU Y,ZHANG W,et al. Study on the relationship between androgen and glucose metabolism indexes in patients with polycystic ovary syndrome [J]. Chin J General Medicine,2022,25(32):4046-4051. doi:10.12114/j.issn.1007-9572.2022.0633.
[5] 张玉红,窦爱民,梁亚丽,等. 青春期多囊卵巢综合征补气养血法临床疗效观察[J]. 遵义医学院学报,2017,40(2):196-199. ZHANG Y H,DOU A M,LIANG Y L,et al. Clinical observation of invigorating Qi and nourishing blood for adolescent polycystic ovary syndrome [J]. Journal of Zunyi Medical College,2017,40(2):196-199. doi:10.3969/j.issn.1000-2715.2017.02.016.
[6] 马要敏. 白术附子汤治疗多囊卵巢综合征临床研究[J]. 河南中医,2020,40(5):711-714. MA Y M. Clinical study of Baizhu Aconzi Decoction in treating polycystic ovary syndrome [J]. Journal of Henan Traditional Chinese Medicine,2020,40(5):711-714. doi:10.16367/j.issn.1003-5028.2020.05.0179.
[7] 虎娜,孙苗,邢莎莎,等. 月见草油抵抗多囊卵巢综合征大鼠卵巢氧化应激[J]. 山东大学学报(医学版),2022,60(5):22-30. HU N,SUN M,XING S S,et al. Evening primrose oil resists ovarian oxidative stress in rats with polycystic ovary syndrome [J]. Journal of Shandong University (Medical Science),2022,60(5):22-30. doi:10.6040/j.issn.1671-7554.0.2022.0016.
[8] 张洋,张艳,姚娓. 不同治则方剂对心力衰竭大鼠心功能及GRP78与Caspase-12的影响[J]. 长春中医药大学学报,2020,36(4):659-661. ZHANG Y,ZHANG Y,YAO W. Effects of different treatment formulas on cardiac function and GRP78 and Caspase-12 in rats with heart failure [J]. Journal of Changchun University of Traditional Chinese Medicine,2020,36(4):659-661. doi:10.13463/j.cnki.cczyy.2020.04.015.
[9] 万颖,杨彩虹,孟焕然,等. 金雀异黄素对多囊卵巢综合征大鼠性激素水平的影响[J]. 中国临床药理学杂志,2021,37(5):556-559. WAN Y,YANG C H,MENG H R,et al. Effects of Auxin on sex hormone levels in rats with polycystic ovary syndrome [J]. Chin J Clinical Medicine,2021,37(5):556-559. doi:10.13699/j.cnki.1001-6821.2021.05.015.
[10] 董敏,徐敏,陈一源. 葛根素对多囊卵巢综合症大鼠糖代谢及TLR4/NF-κB信号通路的影响[J]. 中成药,2022,44(3):758-763. DONG M,XU M,CHEN Y Y. Effects of puerarin on glucose metabolism and TLR4/NF-κB signaling pathway in rats with polycystic ovary syndrome [J]. Chinese Patent Medicine,2022,44(3):758-763. doi:10.3969/j.issn.1001-1528.2022.03.013.
[11] 王琛,王海宁,洪天配,等. 二肽基肽酶4抑制剂治疗多囊卵巢综合征合并糖代谢异常患者的初步临床研究[J]. 中国糖尿病杂志,2014,22(10):879-882.WANG C, WANG H N, HONG T P, et al. Preliminary clinical study of dipeptidyl peptidase 4 inhibitor in the treatment of polycystic ovary syndrome complicated with abnormal glucose metabolism [J]. Chinese Journal of Diabetes,2014,22(10):879-882.
[12] 張维怡,黄光英,刘洁,等. 针刺对克罗米芬治疗的多囊卵巢综合征大鼠子宫内膜容受性的影响[J]. 华中科技大学学报(医学版),2009,38(5):649-654. ZHANG W Y,HUANG G Y,LIU J,et al. Effects of acupuncture on endometrial receptivities in rats with polycystic ovary syndrome treated with Clomiphene [J]. Journal of Huazhong University of Science and Technology (Medical Edition),2009,38(5):649-654. doi:10.3870/j.issn.1672-0741.2009.05.019.
[13] 郑冬雪,刘军莲,马兰,等. 从雄激素受体及其活化因子角度探讨多囊饮对多囊卵巢模型大鼠卵泡发育及子宫内膜容受性的影响[J]. 江苏中医药,2022,54(7):74-77. ZHENG D X,LIU J L,MA L,et al. Effects of polycystic drink on follicle development and endometrial receptivity of polycystic ovary model rats from the perspective of androgen receptor and its activating factors [J]. Jiangsu Journal of Traditional Chinese Medicine,2022,54(7):74-77. doi:10.19844/j.cnki.1672-397X.2022.07.025.
[14] 张萍,王维斌,邵岩飞,等. 二陈汤对多囊卵巢综合征大鼠卵巢组织Bcl-2及Bax蛋白表达的影响[J]. 北京中医药大学学报,2020,43(11):941-950. ZHANG P,WANG W B,SHAO Y F,et al. Effects of Erchen Decoction on the expression of Bcl-2 and Bax protein in ovarian tissue of rats with polycystic ovary syndrome [J]. Journal of Beijing University of Traditional Chinese Medicine,2020,43(11):941-950. doi:10.3969/j.issn.1006-2157.2020.11.009.
[15] 周春玉. 补肾活血方联合二甲双胍缓释片对多囊卵巢综合征患者血清TNF-α、IGF-1及CRP水平的影响[J]. 西部中医药,2017,30(6):4-7. ZHOU C Y. Effects of Bushen Huoxue Recipe combined with metformin sustained release tablets on serum levels of TNF-α, IGF-1 and CRP in patients with polycystic ovary syndrome [J]. Western Chinese Medicine,2017,30(6):4-7.
[16] 胡红梅,陈彩珍. 有氧运动和罗格列酮对KM小鼠PPARγ、GLUT4基因表达的影响[J]. 广州体育学院学报,2004,24(6):41-44. HU H M,CHEN C Z. Effects of aerobic exercise and rosiglitazone on the expression of PPARγ and GLUT4 genes in KM mice [J]. Journal of Guangzhou University of Physical Education,2004,24(6):41-44. doi:10.3969/j.issn.1007-323X.2004.06.012.
[17] 万春平,魏雅改,李晓雪,等. 胡椒碱对HepG2细胞胰岛素抵抗模型糖代谢AMPK信号通路上游靶点干预机制的研究[J]. 中国中药杂志,2017,42(3):542-547. WAN C P,WEI Y G,LI X X,et al. Effect of piperine on upstream target of AMPK signaling pathway of glucose metabolism in insulin resistance model of HepG2 cells [J]. Chinese Journal of Traditional Chinese Medicine,2017,42(3):542-547. doi:10.19540/j.cnki.cjcmm.20161222.059.
[18] 罗新新,朱水兰,李冰涛,等. 葛根芩连汤激活PPARγ上调脂联素和GLUT4表达改善脂肪胰岛素抵抗[J]. 中国中药杂志,2017,42(23):4641-4648. LUO X X,ZHU S L,LI B T,et al. Gegenqinlian Decoction activates PPARγ to up-regulate adiponectin and GLUT4 expression and improve insulin resistance in fat [J]. Chinese Journal of Traditional Chinese Medicine,2017,42(23):4641-4648. doi:10.19540/j.cnki.cjcmm.20170928.003.
[19] 唐陽琳,何宇,曾琳,等. 金雀异黄素对多囊卵巢综合征大鼠胰岛素抵抗及GLUT4、ERα、PR表达的影响[J]. 武警后勤学院学报(医学版),2019,28(2):6-11. TANG Y L,HE Y,ZENG L,et al. Effects of isoflavin on insulin resistance and GLUT4,ERα and PR expression in rats with polycystic ovary syndrome [J]. Journal of Armed Police Logistics College (Medical Edition),2019,28(2):6-11.

