急性髓系白血病合并血流感染的病原菌分布与耐药性变迁及患者死亡的危险因素分析
纪晓娟 韩浩 张丽侠


摘要:目的 探討成人急性髓系白血病(AML)合并血流感染的病原菌分布与耐药性变迁,并分析患者死亡的危险因素。方法 比较85例AML合并血流感染确诊时间的前30个月(2017年1月—2019年6月检出的病原菌)和后30个月(2019年7月—2021年12月)的病原菌检出率和主要病原菌耐药率变迁情况。并按患者血流感染后6个月预后分为死亡组33例和生存组52例。采用Logistic回归分析影响AML合并血流感染患者死亡的危险因素。结果 85例AML合并血流感染患者共检出98株病原菌,以革兰阴性菌为主(65/98,66.33%),其次为革兰阳性菌(29/98,29.59%)、真菌(4/98,4.08%)。后30个月检出真菌(均为念珠菌)比例较前30个月增多(P<0.05)。后30个月与前30个月检出革兰阴性菌、革兰阳性菌比例及大肠埃希菌、金黄色葡萄球菌耐药率比较差异均无统计学意义(P>0.05)。Logistic回归分析显示,确诊前1个月内抗生素使用史、感染性休克为AML合并血流感染患者死亡的独立危险因素(P<0.05)。结论 成人AML合并血流感染的病原菌以革兰阴性菌为主,但近年念珠菌感染率升高,且血流感染前使用抗生素及并发感染性休克者易出现预后不良。
关键词:白血病,髓样,急性;交叉感染;细菌感染;抗药性,细菌;危险因素
中图分类号:R733.71文献标志码:ADOI:10.11958/20230423
Pathogenic bacteria distribution, drug resistance changes and risk factors of death in patients with acute myeloid leukemia complicated with bloodstream infection
Abstract: Objective To explore the distribution and drug resistance changes of pathogenic bacteria in adult acute myeloid leukemia (AML) with bloodstream infection, and to analyze risk factors of death of patients. Methods Changes of detection rate of pathogenic bacteria and drug resistance rate of main pathogenic bacteria of 85 patients with AML and bloodstream infection 30 months before confirmed diagnosis (pathogenic bacteria detected from January 2017 to June 2019) and 30 months after diagnosis (from July 2019 to December 2021) were compared. According to the prognosis at 6 months after bloodstream infection, patients were divided into the death group (33 cases) and the survival group (52 cases). Logistic regression analysis was used to analyze risk factors of death in patients with AML complicated with bloodstream infection. Results A total of 98 strains of pathogenic bacteria were detected in 85 patients with AML complicated with bloodstream infection, mainly gram-negative bacteria (65/98, 66.33%), followed by Gram-positive bacteria (29/98, 29.59%) and fungi (4/98, 4.08%). The proportion of fungi (all were candida) detected in the last 30 months was more than that in the first 30 months (P < 0.05). There were no significant differences in proportions of gram-negative bacteria and gram-positive bacteria and drug resistance rates of Escherichia coli and Staphylococcus aureus between the late 30 months and the first 30 months (P > 0.05). Logistic regression analysis showed that the history of antibiotic use within 1 month before confirmed diagnosis and septic shock were independent risk factors for death in patients with AML complicated with bloodstream infection (P <0.05). Conclusion The main pathogens of adults with AML combined with bloodstream infection are gram-negative bacteria. However, candida infection rate has increased in recent years, and patients with antibiotic use before bloodstream infection and complicated with septic shock are prone to poor prognosis.
Key words: leukemia, myeloid, acute; cross infection; bacterial infection; drug resistance, bacteria; risk factors
急性髓系白血病(acute myeloid leukemia,AML)患者為医院感染的好发人群,化疗药物对免疫功能的抑制及中性粒细胞的减少均会增加感染风险,其中血流感染是AML主要的死亡原因之一[1]。研究显示,AML合并血流感染患者存在粒细胞减少、免疫力低下等特点,但有关预后不良的危险因素尚存在争议[2]。AML患者化疗周期长、住院时间长,更易发生耐药菌感染,AML合并血流感染的病原菌耐药性值得临床重点关注。近年研究发现,AML合并血流感染病原菌分布有时间差异,病原菌耐药性也随时间变迁[3]。因此,分析AML合并血流感染的病原菌及其耐药性随时间变化特点,对指导后续临床抗感染治疗有积极意义。本研究就我院近5年成人AML合并血流感染的病原菌分布及耐药性变迁展开分析,并评估患者预后不良的危险因素,为指导临床治疗提供依据。
1 对象与方法
1.1 研究对象 选取2017年1月—2021年12月亳州市人民医院收治的85例合并血流感染的AML患者为研究对象。纳入标准:符合《血液病诊断及疗效标准(第3版)》中AML及《医院感染诊断标准(试行)》中血流感染诊断标准;所有患者参考《血液病诊断及疗效标准(第3版)》在本院接受1个或1个以上疗程的化疗;首次血培养病原菌阳性;年龄50~69岁;实验室检查、体格检查、药敏试验等临床资料完整。排除标准:确诊血流感染前6个月内有外伤或手术史;合并严重心、肝等重要器官功能不全或其他恶性肿瘤。85例AML合并血流感染患者均存在不同程度的发热,其中低热(37.2~38.0 ℃)11例(12.94%),中热(38.1~39.0 ℃)28例(32.94%),高热(>39.0 ℃)46例(54.12%);原发性血流感染39例(45.88%),继发性血流感染46例(54.12%);呼吸系统感染32例,消化系统感染8例,皮肤/口腔感染5例,生殖系统感染1例。本研究所有患者知情同意,且通过本院医学伦理委员会审核(亳医伦审2023第20号)。
1.2 研究方法
1.2.1 临床资料收集 收集性别、年龄、疾病治疗阶段、确诊前住院时间、确诊前1个月内抗生素使用史、是否存在粒细胞缺乏症、粒细胞减少持续时间、是否发生感染性休克等。其中疾病治疗阶段参考《血液病诊断及疗效标准(第3版)》,分为诱导缓解期(治疗初期,1~2个疗程)、巩固治疗期(诱导缓解治疗后,获得骨髓白血病细胞<5%、血象基本恢复正常且无髓外白血病的完全缓解,再行巩固化疗)、难治复发期(复发:完全缓解后外周血重新出现白血病细胞或骨髓原始细胞>5%、或髓外出现白血病细胞浸润;难治:1~2个疗程诱导缓解治疗后未获得完全缓解或复发后经原方案再诱导治疗失败、复发≥2次);外周血中性粒细胞绝对计数<0.5×109/L为粒细胞缺乏症。
1.2.2 病原菌及耐药性检测 病原菌分离、鉴定方法参考《全国临床检验操作规程(第3版)》,真菌培养在显色培养基(法国CHROMagar公司)35 ℃环境下培养48 h,细菌培养在细菌培养基(英国Oxoid公司)35 ℃培养24 h,鉴定及药敏试验使用VITEK 2 COMPACT 60全自动微生物鉴定及药敏系统(法国bioMerieux公司),同一患者分离出同一菌株不重复计入,药敏结果判断参考2016年《常见细菌药物敏感性试验报告规范中国专家共识》。质控菌株:大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603及金黄色葡萄球菌ATCC 25923购自中国食品药品检定研究院。分析血流感染确诊前30个月(2017年1月—2019年6月检出的病原菌)和后30个月(2019年7月—2021年12月)血流感染病原菌检出率和主要病原菌耐药率变迁情况。某一病原菌检出率=某一病原菌株数/病原菌总株数×100%。病原菌耐药率=耐药病原菌株数/病原菌总株数×100%。
1.2.3 血流感染后死亡危险因素分析 根据患者确诊血流感染后6个月生存情况分为生存组(n=52)及死亡组(n=33),评估患者预后死亡的危险因素。
1.3 统计学方法 采用SPSS 22.0软件进行数据分析。计数资料以例或例(%)表示,组间比较采用χ2检验或Fisher精确概率法。危险因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
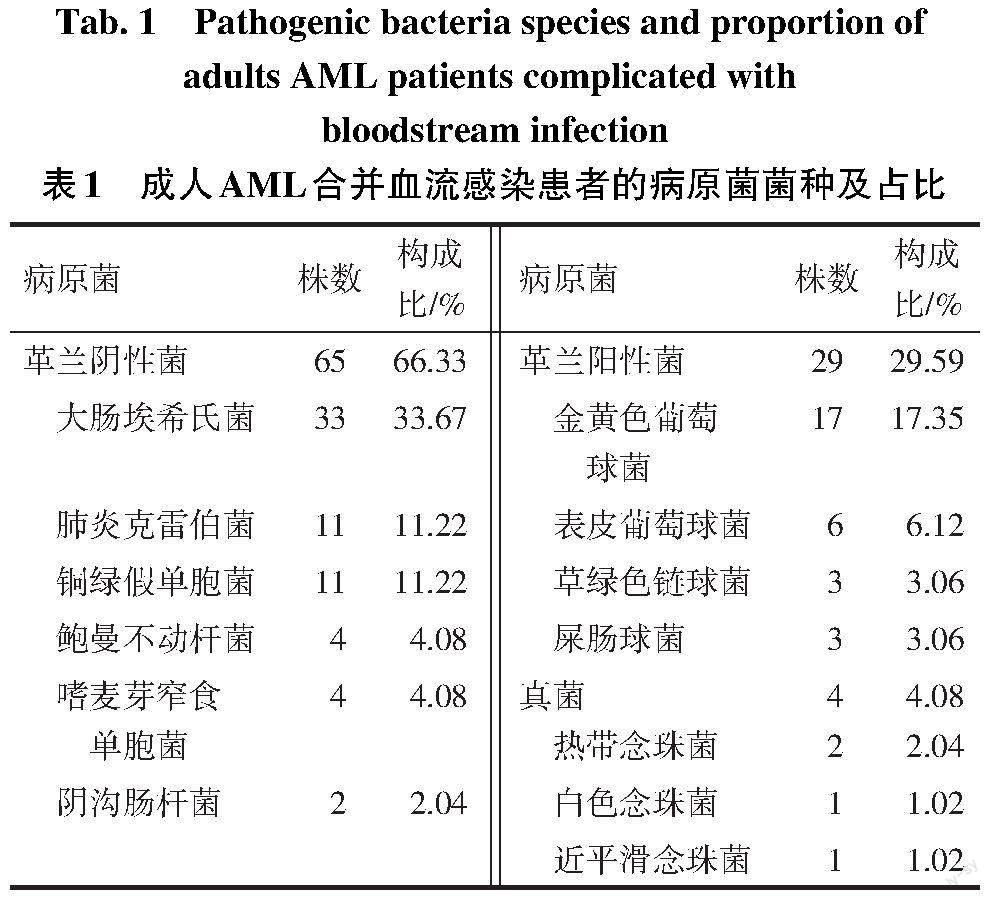
2.1 血流感染病原菌的菌种及占比 85例AML合并血流感染患者共检出98株病原菌,66.33%(65/98)为革兰阴性菌,29.59%(29/98)为革兰阳性菌,4.08%(4/98)为真菌,见表1。
2.2 AML合并血流感染病原菌菌种的变化 后30个月与前30个月检出革兰阴性菌、革兰阳性菌比例差异均无统计学意义(P>0.05)。与前30个月比较,后30个月检出真菌(均为念珠菌)比例增多(P<0.05),见表2。
2.3 AML合并血流感染主要病原菌耐药性变化 后30个月与前30个月大肠埃希菌、金黄色葡萄球菌耐药率比较差异均无统计学意义(P>0.05)。前30个月与后30个月检出的大肠埃希菌对氨苄西林、苯唑西林、哌拉西林及四环素耐药率较高(均>70%),对亚胺培南、美罗培南耐药率较低(均<10%)。前30个月与后30个月检出的金黄色葡萄球菌对氨苄西林、四环素、哌拉西林耐药率较高(均>60%),对头孢哌酮/舒巴坦、亚胺培南、美罗培南、万古霉素、左旋氧氟沙星、环丙沙星耐药率较低(均<10%),见表3、4。
2.4 AML合并血流感染患者预后死亡的危险因素分析 与生存组比较,死亡组确诊前住院时间≥30 d、确诊前1个月内有抗生素使用史、感染性休克比例升高(P<0.05),见表5。以预后(生存=0,死亡=1)为因变量,确诊前住院时间(<30 d=0,≥30 d=1)、确诊前1个月内抗生素使用史(无=0,有=1)及感染性休克(无=0,有=1)为自变量。Logistic回归分析显示,确诊前1个月内抗生素使用史、感染性休克为AML合并血流感染患者死亡的独立危险因素(P<0.05),见表6。
3 讨论
抗菌药物滥用已成为全球严重的公共卫生问题,为此,我国颁布了《抗菌药物临床应用指导原则:2015年版》及《国家抗微生物治疗指南(第2版)》,以加强对抗菌药物的应用管理。化疗可引起AML患者粒细胞减少及免疫功能异常,血流感染风险升高,且血培养检出耐药菌并不罕见[4]。此外,AML合并血流感染的病原菌类型具有区域性差异,欧美地区常以金黄色葡萄球菌等革兰阳性菌为主[5],中国等亚洲地区则以革兰阴性菌为主[6]。徐海琳等[7]等对2016—2021年某院的急性白血病化疗后中性粒细胞缺乏血流感染者的病原菌分析显示,检出的268株病原菌以革兰阴性菌为主,占67.16%。本研究结果亦显示,我院近5年AML合并血流感染患者检出的病原菌以革兰阴性菌为主(66.33%),与上述中国地区报道的结果相近,提示近年AML合并血流感染仍以革兰阴性菌多见。
湛玉晓等[8]对郑州市某院的儿童急性淋巴细胞白血病化疗后血流感染情况调查显示,2018—2020年检出的缓症链球菌及真菌较2015—2017年显著增多,病原菌分布随时间呈规律性变化。本研究对近5年数据分析亦显示,后30个月检出真菌(均为念珠菌)比例较前30个月增多,提示现阶段临床应注意念珠菌血流感染情况。考虑原因为:(1)化疗可引起口腔黏膜损伤,念珠菌作为口腔定植菌,可由口腔黏膜创口入侵血液系统,造成念珠菌血流感染[9]。(2)目前预防性抗菌药物常使用头孢他啶等三代头孢,可引起念珠菌优势生长,增加致病风险[10]。因此,对于AML化疗患者,临床应注重口腔黏膜保护,并对疑似感染病例尽早行血培养,及时发现念珠菌血流感染。高媛媛等[11]研究显示,血液恶性肿瘤患者真菌血流感染虽然发生率不高,但临床表现缺乏特异性,真菌培养阳性率低,早期诊断困难,且病情进展迅速,具有极高的病死率。然而,本研究中死亡组念珠菌血流感染率与生存组间差异无统计学意义,可能是样本量不足所致。此外,本研究结果显示,后30个月与前30个月大肠埃希菌、金黄色葡萄球菌耐药率比较差异均无统计学意义,考虑与自2017年国家颁布《国家抗微生物治疗指南》以来,各级医疗机构加强对抗菌药物合理用药的管理,指导临床科室抗菌药物使用规范,对降低耐药风险有一定作用有关。
本院于2017年由医务部联合院感科、药剂科,严格要求全院抗菌药物规范应用,并定期督查,故细菌耐药率未增加。本研究还发现,大肠埃希菌对亚胺培南、美罗培南耐药率较低。相关研究认为,大肠埃希菌对亚胺培南、美罗培南耐药率较低与大肠埃希菌产生大量超广谱β内酰胺酶,而对碳青霉烯类抗生素敏感有关[12]。金黄色葡萄球菌對头孢哌酮/舒巴坦、亚胺培南、美罗培南、万古霉素、左旋氧氟沙星、环丙沙星耐药率较低,提示上述药物可作为金黄色葡萄球菌感染的首选用药。然而有研究指出,碳青霉烯类耐药革兰阴性菌及耐万古霉素肠球菌感染形式严重,此类耐药菌治疗困难,死亡率高[13-14]。因此,碳青霉烯类抗生素及万古霉素的临床应用仍需规范且谨慎。
陈晓敏等[15]研究认为,住院时间较长者抵抗力差,长期在交叉感染风险较高的病房内,患者呼吸道、破损皮肤等部位难以抵抗病原菌的入侵,并发感染风险高,且有创性操作也易将周围病原菌带入血液循环,造成血流感染,由于其身体素质越差,治疗也越困难。本研究中,死亡组确诊前住院时间≥30 d比例高于存活组,但Logistic回归分析显示,确诊前1个月内抗生素使用史是AML合并血流感染患者死亡的独立危险因素,提示住院时间较长可能影响患者治疗及预后状况,但感染前的抗生素使用史是导致死亡的关键。考虑患者在出现发热等症状但未明确存在感染时,接受抗生素经验用药增加病原菌耐药风险,导致后续抗感染治疗难度较大[16]。本研究还发现,感染性休克是患者死亡的独立危险因素,表明积极控制感染、避免感染性休克的发生是改善患者预后的关键。目前,对于AML感染性休克的治疗及预后仍是临床面临的难题。最新的一项动物实验研究发现,磁热疗法不仅能用于清除实体瘤,还能通过上皮特异性黏附分子与白血病细胞表面靶向结合,在抗致病菌及病毒入侵血液系统方面具有重要作用[17]。该研究也为AML合并血流感染的临床治疗带来新方向。
综上所述,成人AML合并血流感染以大肠埃希菌等革兰阴性菌常见,但近年念珠菌血流感染呈增多趋势,其主要病原菌大肠埃希菌、金黄色葡萄球菌耐药率未随时间出现明显变化,确诊血流感染前1个月内抗生素用药史及感染性休克可能增加患者的死亡风险,临床可据此制定防控措施。
参考文献
[1] LE D T,NGUYEN S V,OKAMOTO M,et al. Molecular characterization of bovine foamy virus and its association with bovine leukemia virus infection in Vietnamese cattle[J]. J Vet Med Sci,2021,83(8):1273-1277. doi:10.1292/jvms.21-0190.
[2] YOSHINO N,KIMURA S I,MATSUOKA A,et al. Clinical features of febrile neutropenia and bloodstream infection in autologous hematopoietic cell transplantation:Comparison to those in intensive chemotherapy for acute myeloid leukemia[J]. J Infect Chemother,2023,29(4):384-390. doi:10.1016/j.jiac.2023.01.004.
[3] 牛晓红,郭华棋,张新玲,等. 急性白血病患者血流感染病原菌及其耐药性六年的变迁[J]. 中国感染控制杂志,2018,17(6):502-506. NIU X H,GUO H Q,ZHANG X L,et al. Change in pathogens and antimicrobial resistance of pathogens causing bloodstream infection in patients with acute leukemia during six years[J]. Chin J Infect Contr,2018,17(6):502-506. doi:10.3969/j.issn.1671-9638.
[4] 李平,黄纯. 急性白血病患者合并血流感染的病原学,耐药现状及预后高危因素分析[J]. 中国病原生物学杂志,2021,16(9):1087-1090. LI P,HUANG C. Etiology,drug resistance,and prognostic risk factors in patients with acute leukemia and a bloodstream infection[J]. J Pathogen Biol,2021,16(9):1087-1090. doi:10.13350/j.cjpb.210920.
[5] MICOZZI A,GENTILE G,SANTILLI S,et al. Reduced mortality from KPC-K.pneumoniae bloodstream infection in high-risk patients with hematological malignancies colonized by KPC-K.pneumoniae[J]. BMC Infect Dis,2021,21(1):e1079. doi:10.1186/s12879-021-06747-8.
[6] 王二华,张畅,唐亦舒,等. 急性白血病患者革兰氏阴性菌血流感染的药敏分析及预后[J]. 中南大学学报(医学版),2020,45(9):1068-1073. WANG E H,ZHANG C,TANG Y S,et al. Antibiotic susceptibility and prognostic analysis of Gram negative bacterial bloodstream infection in patients with acute leukemia[J]. J Cent South Univ(Med Sci),2020,45(9):1068-1073. doi:10.11817/j.issn.1672-7347.2020.200548.
[7] 徐海琳,张智洁,徐资涵,等. 急性白血病化疗后中性粒细胞缺乏患者血流感染的病原菌分布及耐药性特征分析[J]. 中国热带医学,2022,22(11):1009-1014. XU H L,ZHANG Z J,XU Z H,et al. Analysis of pathogenic bacteria distribution and drug resistance characteristics of bloodstream infection in patients with neutrophilic deficiency after chemotherapy in acute leukemia[J]. China Tropical Medicine,2022,22(11):1009-1014. doi:10.13604/j.cnki.46-1064/r.2022.11.02.
[8] 湛玉曉,张俭,樊彩芳,等. 儿童急性淋巴细胞白血病化疗后血流感染的病原体分布与耐药变迁分析[J]. 中国当代儿科杂志,2022,24(2):176-181. ZHAN Y X,ZANG J,FAN C F,et al. Distribution and drug resistance profiles of pathogens causing bloodstream infectionafter chemotherapy in children with acute lymphoblastic leukemia[J]. Chin J Contemp Pediatr,2022,24(2):176-181. doi:10.7499/j.issn.1008-8830.2109023.
[9] VARABYEVA A,LO C P,BRANCACCIO A,et al. Impact of number of lumens in central-venous catheters on central-line bloodstream infection (CLABSI) and venous thromboembolism (VTE) risk in patients with acute leukemia[J]. Infect Control Hosp Epidemiol,2023,44(1):125-127. doi:10.1017/ice.2021.423.
[10] YARETS Y I,SHEVCHENKO N I,EREMIN V F,et al. Local microbiological monitoring as a basis for determining etiological significance of conditional pathogens:data from a burn intensive care unit[J]. Clin Microbio Antimicrob Ch,2021,23(1):100-112. doi:10.36488/cmac.2021.1.100-112.
[11] 高媛媛,陆燕飞,夏文颖,等. 血液恶性肿瘤患者血流感染星状丝孢酵母1例[J]. 临床检验杂志,2021,39(8):638-640. GAO Y Y,LU Y F,XIA W Y,et al. Blood flow infection of Saccharomyces astroformis in patients with hematologic malignancy[J]. Chin J Clin Lab Sci,2021,39(8):638-640. doi:10.13602/j.cnki.jcls.2021.08.20.
[12] 艾效曼,陶凤蓉,赖惠英,等. 比阿培南等10种抗菌药物对常见革兰阴性杆菌体外抗菌活性比较[J]. 中国新药杂志,2020,29(5):541-546. AI X M,TAO F R,LAI H Y,et al. In vitro antimicrobial activity of ten antibiotics including biapenem against common Gram-negative bacilli[J]. Chin J New Drugs,2020,29(5):541-546. doi:10.3969/j.issn.1003-3734.2020.05.011.
[13] 黄洁,徐文,李磊,等. 硫酸多黏菌素B治疗耐碳青霉烯类革兰阴性杆菌重症感染29例[J]. 中国感染与化疗杂志,2021,21(5):541-545. HUANG J,XU W,LI L,et al. Polymyxin B sulfate in the treatment of severe infections caused by carbapenemresistant gram-negative bacilli:report of 29 cases[J]. Chin J Infect Chemother,2021,21(5):541-545. doi:10.16718/j.1009-7708.2021.05.007.
[14] ZUO Y,ZHAO D M,SONG G B,et al. Risk factors, molecular epidemiology, and outcomes of carbapenem-resistant klebsiella pneumoniae infection for hospital-acquired pneumonia:a matched case-control study in eastern China during 2015-2017[J]. Microb Drug Resist,2021,27(2):204-211. doi:10.1089/mdr.2020.0162.
[15] 陳晓敏,唐柳,刘洋,等. 成人急性淋巴细胞白血病患者化疗期间院内感染的病原菌分布和耐药情况、危险因素分析[J]. 山东医药,2020,60(6):58-61. CHEN X M,TANG L,LIU Y,et al. Analysis of pathogenic bacteria distribution,drug resistance and risk factors of nosocomial infection during chemotherapy in adult patients with acute lymphoblastic leukemia[J]. Shandong Med J,2020,60(6):58-61. doi:10.3969/j.issn.1002-266X.2020.06.014.
[16] ZONG Z Y,FENG Y,MCNALLY A. Carbapenem and Colistin resistance in Enterobacter:Determinants and clones[J]. Trends Microbiol,2021,29(6):473-476. doi:10.1016/j.tim.2020.12.009.
[17] AL FARUQUE H,CHOI E S,LEE H R,et al. Targeted removal of leukemia cells from the circulating system by whole-body magnetic hyperthermia in mice[J]. Nanoscale,2020,12(4):2773-2786. doi:10.1039/c9nr06730b.

