北京地区酱香型白酒第四轮次入窖酒醅中微生物及风味物质的变化
黄慧芹,徐友强,2, ,李微微,2,张成楠,2,朱 华,王红安,李秀婷,2
(1.北京工商大学食品营养与人类健康高精尖创新中心,北京 100048;2.北京市食品添加剂工程技术研究中心,北京 100048;3.北京华都酿酒食品有限责任公司,北京 102212)
传统发酵白酒是中国特色蒸馏酒,生产历史悠久[1]。由于自然环境、原料、发酵剂的种类和生产工艺不同,白酒形成了许多风格独特的香型[2]。随着白酒研究的不断深入,人们也认识到不同香型白酒风味的形成与发酵微生物的组成和演替变化是紧密相关的。作为三大基本香型之一,酱香型白酒以优雅独特的酱香味著称[3],发酵过程需要一年时间,期间需要经历7 轮次取酒[4]。普遍认为,第一轮、第二轮的基酒涩味大,这很可能是由于原料高粱中的化学物质单宁和多酚引起的,这些化学物质可以通过蒸馏迁移到基酒中,第三、第四和第五轮的基酒质量较好[5],又称为“大回酒”,而第六轮和第七轮基酒质量再度变差,有苦味和焦糊的味道[6]。综合比较,第四轮次的基酒风味最为突出[7-8],作为酱香型白酒勾调过程中最重要的组成部分,具有较高的研究价值。
微生物的代谢是酱香型白酒酿造过程物料转化的内在动力[9],在整个酿造周期中,微生物种类和丰度处于动态变化之中,影响最终风味化合物的形成。酱香型白酒酿造工艺复杂,条件独特,酿造过程的微生物来源主要包括大曲、酒醅和环境微生物三部分。在堆积发酵的整个过程中,酒醅暴露在开放式环境中,富集了许多环境中的微生物,这些微生物参与到后续入窖发酵过程中,赋予轮次酒独特风味[10]。例如,王琳等[11]对茅台镇酱香型白酒的七个轮次发酵的酿造环境进行细菌菌群分析,在第四轮次中发现特殊菌属Corynebacterium(棒状杆菌属),可利用环境中的碳源发酵产生赖氨酸改善酒的风味;张春林等[12]对第二轮次堆积发酵酒醅进行研究,发现对风味形成影响最大的微生物为Bacillus(芽孢杆菌属)、Emericella(裸胞壳属)、Oceanobacillus(海洋芽孢杆菌属);胡小霞等[13]对堆积和窖池发酵过程的细菌菌群结构进行分析发现,入窖发酵过程中细菌多样性和丰度均低于堆积发酵,即堆积发酵中富集的微生物需要在入窖发酵过程中进一步演替。这些研究表明,分析入窖之后酒醅发酵过程中微生物及风味物质变化具有重要意义,有助于合理调节白酒发酵过程,提高酱香型白酒产品质量。团队前期研究[14]发现第五、六轮次酒醅中的优势细菌属均为Lactobacillus(乳芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Virgibacillus(枝芽孢杆菌属),但入窖发酵过程中丰度并不一致,第六轮次优势真菌属为Issatchenkia(伊萨酵母属)、Thermoascus(嗜热子囊菌属)和Byssochlamys(丝衣菌属),而Thermoascus(嗜热子囊菌属)和Aspergillus(曲霉属)的对应丰度远低于第五轮,并提出第六轮次入窖酒醅中酯合成真菌的减少可能是酯类风味物质浓度下降的原因。团队近期研究[15]通过分析前三轮次入窖酒醅的微生物和风味物质,发现第三轮入窖酒醅中的风味物质浓度有所提高,提出风味物质的变化是第三轮次基酒质量提高的重要原因。然而,总体来讲目前对于酱香型白酒入窖酒醅发酵过程的研究较少,限制了人们对发酵过程的科学认知,特别是对于关键轮次第四轮次入窖酒醅发酵过程中微生物和风味物质的变化尚未见报道。
本文通过高通量测序技术对北京地区酱香型白酒第四轮次入窖发酵过程中酒醅微生物群落结构进行了研究,分析了微生物菌群的演替变化;利用顶空固相微萃取-气相色谱-质谱联用技术对酒醅的挥发性风味成分进行了定性和相对定量分析。通过分析白酒发酵过程中微生物及风味物质的变化,定位核心微生物,探讨微生物与风味物质的相互关联,从中挖掘与风味相关的功能微生物,有助于为后续通过功能微生物理性扰动发酵体系,为提高北京地区酱香型白酒的产品品质提供基础数据依据。
1 材料与方法
1.1 材料与仪器
磷酸缓冲液、Taq DNA 聚合酶试剂盒 北京全式金生物技术有限公司;4-辛醇(色谱级)天津福晨化学试剂有限公司;琼脂糖 南京生兴生物技术有限公司;50×TAE 缓冲液 北京索莱宝科技有限公司;DNA Marker Takara;核酸染料Gengreen 上海赛百盛有限公司;引物 上海捷瑞生物工程股份有限公司;E.Z.N.A.Soil DNA Kit 试剂盒 Omega Bio-Tek公司。
CP153 电子天平 奥豪斯仪器(上海)有限公司;T100-Thermal Cycler PCR 仪 美国Bio-Rad 公司;EPS301 琼脂糖凝胶电泳仪 北京六一仪器厂;YXQ-LS-50SII 立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;Aquaplore3S 超纯水系统美国艾科浦公司;KQ5200DA 超声波清洗仪 上海超声仪器厂;GC 7890-5975 MSD 气相色谱-质谱联用仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 抽样方法 酒醅样品采自北京华都酒厂窖池发酵生产车间2020 年第四轮次12 号南池入窖发酵酒醅,入窖前已提前进行5 d 的薄层堆积发酵。根据前期研究基础[15],入窖酒醅选取入窖0、7、14、21、30 d 为取样时间点,15 点取样,窖池发酵周期为30 d。在每个取样时间点取样时,按酒醅上、中、下三个层面,每个层面选择中间及四周边缘位置采取样品,取样位点参考图1,各层样品混匀后作为一个时间点的取样样品。将采集的样品分为两份:一份用于提取总DNA,另一份储存在-80 ℃用于进行微生物群落结构分析。

图1 酱香型白酒第四轮次入窖酒醅取样位点参考Fig.1 Sampling sites of Sauce-flavored Baijiu in the fourthround of cellar
1.2.2 样品DNA 提取和PCR 扩增 通过E.Z.N.A.Soil DNA Kit 提取试剂盒提取酒醅样品中的微生物宏基因组,提取步骤参照说明书。根据前期研究方法[16]进行基因扩增,细菌扩增16S rRNA 基因所用引物,338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTA CHVGGGTWTCTAAT-3');真菌扩增18S rRNA 基因所用引物,ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'),使用1%琼脂糖凝胶电泳检测目的条带大小。
基因PCR 体系如表1 所示;基因扩增方法如表2 所示。

表1 PCR 反应体系Table 1 PCR reaction system
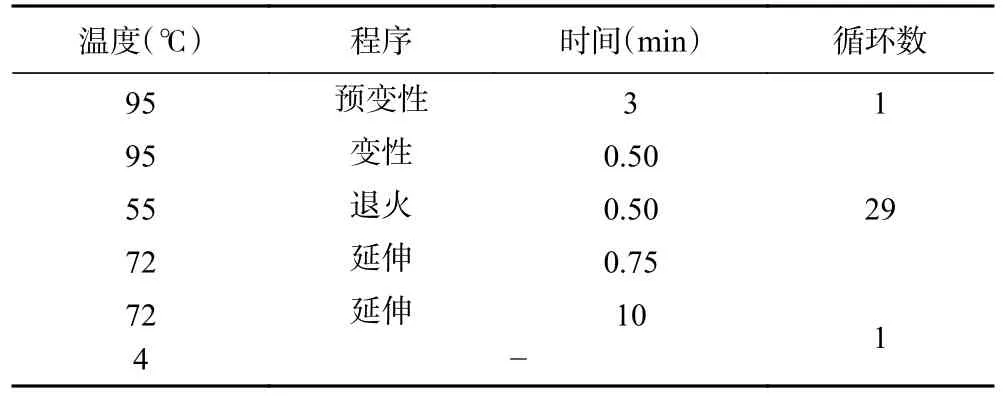
表2 PCR 反应程序Table 2 PCR reaction procedure
1.2.3 Illumina 公司MiSeq 测序 将纯化的扩增产物等分子量汇集在Illumina MiSeq PE300 平台/NovaSeq PE250 平台(Illumina,上海),并根据上海Majorbio生物制药科技有限公司(中国,上海)的标准方案进行配对端测序。原始测序数据已提交到NCBI SRA 数据库,提交编号为SUB8652827。
1.2.4 挥发性化合物的提取与分析 结合宫俐莉等[17]的研究,本研究通过顶空-固相微萃取分析挥发性化合物。样品前处理方法参照李凤兰等[5]的研究进行:准确称取2.00 g 酒醅样品于20 mL 顶空瓶中,向其中加入5 mL 的饱和氯化钠溶液,加入6 μL 4-辛醇(0.5 mg/mL)作为内标物,以90 W 功率超声10 min。顶空-固相微萃取使用TG-5MS 色谱柱(30 m×0.25 mm×0.25 μm,J&W Science,Folsom,CA,USA),通过火焰电离检测器分析风味化合物。气相色谱条件:温度以2 ℃/min 的速率升至100 ℃并保持5 min,然后以2 ℃/min 的速率升至150 ℃并保持2 min,最后以10 ℃/min 速率升至230 ℃并保持5 min。氦气载气的流速为1.5 mL/min。质谱采用电子轰击电离(EI)离子源,离子源温度230 °C,电子能量70 eV,离子扫描范围为35~450 m/z。风味成分的鉴定通过与NIST 11 a.L 数据库(安捷伦科技公司)中的标准质谱图进行比对,使用内标法对风味化合物进行相对定量分析。通过自动积分程序获得各色谱峰的面积,计算样品中各组分峰面积分别与内标物质峰面积之比,定量各风味组分的含量。酒醅中风味物质的定量数据处理主要采用Microsoft Office Excel 2021 应用程序进行数据计算,通过TBtools、R 语言完成相关图形的绘制。
1.3 数据处理
所有测定平行三次进行,结果表示为平均值±标准差。方差分析使用SPSS 26.0 软件(SPSS Inc.,美国伊利诺伊州芝加哥)进行。使用Origin 8.5 软件进行挥发性成分分析和微生物图谱分析。采用Pheatmap 软件包进行相关性分析,使用相关热图进行可视化,分析风味物质与微生物之间的关联性。
2 结果与分析
2.1 第四轮次酿造过程中微生物群落结构多样性
2.1.1 细菌多样性 稀释曲线可以比较不同的测量数据样本的物种丰富度,也可以说明样本的测序数据量是否合理,图2 中稀释性曲线趋于平坦,说明测序的数据量和丰富度是合理的[18]。图2a 展示了酱香型白酒第四轮次入窖酒醅细菌样本的稀释曲线在测序数5000 时骤增,后逐渐趋于平坦,这表明本实验的各细菌样本测序数据量合理,测序深度达到要求,与实际生物信息相符合。利用Shannon 曲线对不同样本的物种多样性进行了比较,如图2b 所示,所有样本中细菌的Shannon 曲线在测序数1000 左右时骤增,后变得平坦,说明测量数据的量可以覆盖样本中绝大多数细菌多样性信息,测序数据量和深度是可靠的。实际测量结果可以代表样本的实际情况。
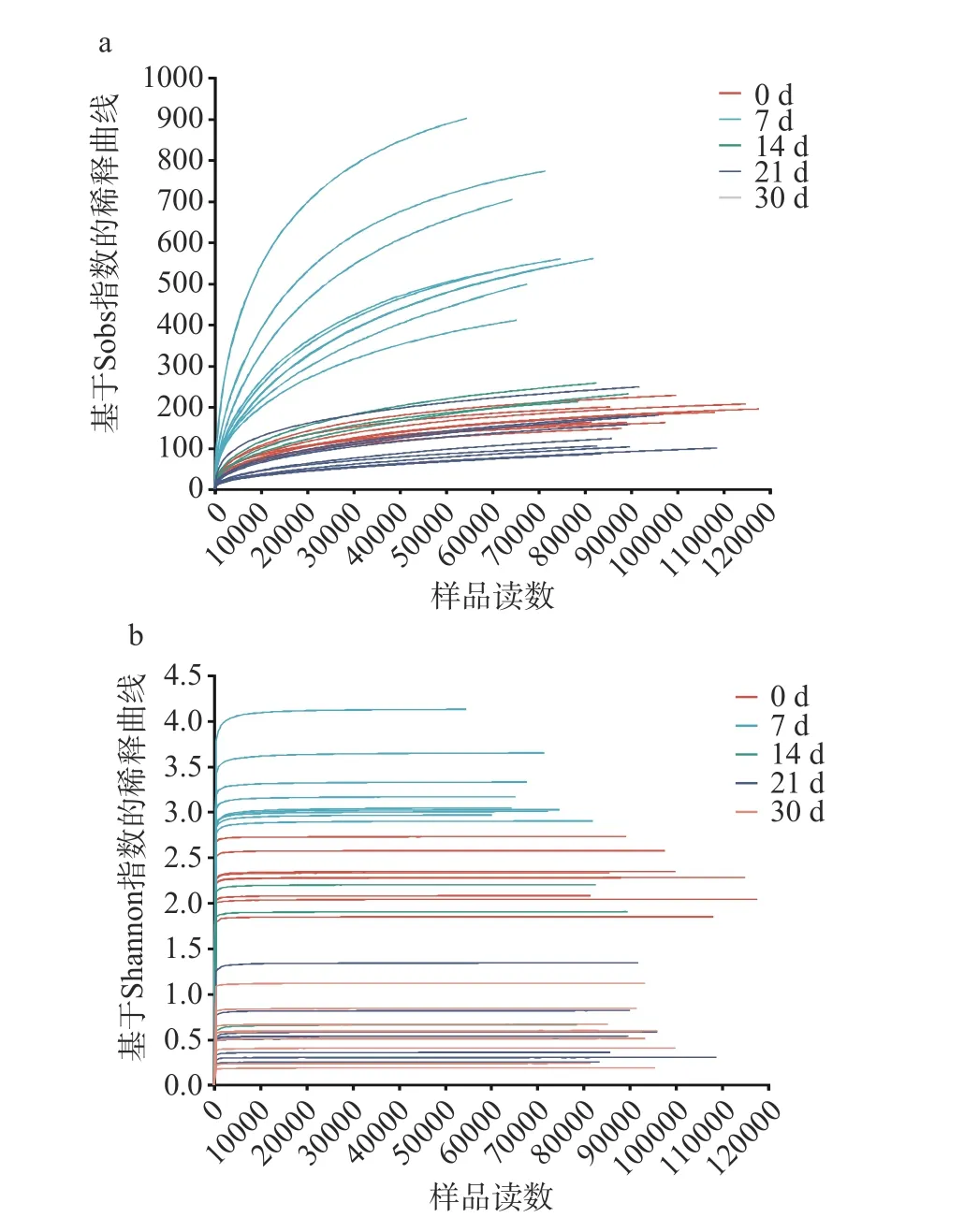
图2 酱香型白酒第四轮次入窖酒醅的细菌样本基于Sobs 指数与Shannon 指数的稀释曲线图Fig.2 Dilution plots of bacterial samples of the fourth round Jiupei of sauce-flavored Baijiu based on the Sobs index and the Shannon index
门水平上,在酱香型白酒第四轮次入窖酒醅中共检出16 个细菌门。图3a 展示了酒醅中相对丰度大于1%的细菌门,有Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)、Actinobacterieta(放线菌门)。在整个发酵期间,Firmicutes(厚壁菌门)一直处于绝对的优势地位,平均相对丰度>85%,该结果与酱香型白酒(山东产区)[19]、清香型白酒[20]、浓香型白酒[21]、芝麻香型白酒[22]研究结论一致。在酱香型、芝麻香型、清香型白酒酿造过程中发现Firmicutes(厚壁菌门)也是主要细菌门,说明Firmicutes 是中国白酒发酵过程中的关键微生物。不同的是,南方产区的酱香型白酒优势细菌门有两种,研究发现贵州产区的酱香型白酒发酵过程中,Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)两个门占主导地位[9]。以上结果表明白酒发酵中后期(14~30 d),细菌门水平群落多样性降低,发酵微生态结构由多菌系演替为单一的Firmicutes(厚壁菌门)为主导的发酵模式,是白酒酒醅发酵细菌门水平演替的普遍模式。目水平上,共检出89 个细菌目,丰度大于1%的有9 个,包括Lactobacillales(乳酸杆菌目)、Bacillales(杆菌目)、Thermoactinomycetales(热放线菌目)、Pseudomonadales(假单胞菌目)、Propionibacteriales(丙酸杆菌目)、Burkholderiales(伯克霍尔德氏菌目)、Staphylococcales(葡萄球菌目)、Acetobacterales(醋酸菌目)、Enterobactrales(肠杆菌目)(如图3b 所示)。在发酵前期(1~14 d),Lactobacillales(乳酸杆菌目)相对丰度较低,Bacillales(杆菌目)则相对丰度较高,其次是Thermoactinomycetales(热放线菌目)。发酵14 d,细菌物种多样性丰富且相对丰度分布比较多样。之后,Lactobacillales(乳酸杆菌目)相对丰度显著增加,说明此时的环境适宜乳酸杆菌的生长,此时窖池处于厌氧环境,厌氧型细菌成为优势种群出现,且一直持续到出窖阶段。属水平上,共检出260 个细菌属,丰度大于1%的有16 个,如图3c 所示,其中平均相对丰度较高的10 个菌属包括Lactobacillus(乳酸杆菌属)、Virgibacillus(枝芽孢杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)、Bacillus(芽孢杆菌属)、Thermoactinomyces(高温放线菌属)、Pseudomtonas(假单胞菌属)、unclassified_f_Bacillacese(未分类芽孢细菌属)、Scopulibacillus(火山渣芽胞杆菌属)、Ralstonia(罗尔斯通菌属)。其中,Lactobacillus(乳酸杆菌属)占细菌数量的3.55%~89.96%,平均相对丰度为67.70%,入窖初期相对含量较低,在入窖第21 d 达到最高值,后期保持在较高水平。Virgibacillus(枝芽孢杆菌属)占细菌数量的2.90%~26.32%,平均相对丰度为14.28%,Kroppenstedtia(克罗彭斯特菌属)占细菌数量的2.32%~25.57%,平均相对丰度为10.70%,两个菌属在入窖初期相对含量较高,相对丰度均在入窖第21 d开始降低。
图3 酱香型白酒第四轮次入窖酒醅中门、目、属水平细菌群落组成Fig.3 Composed of bacterial communities in the middle of the door,order and genus of the fourth round Jiupei of sauce-flavored Baijiu
发酵0 d 时,酒醅中Virgibacillus(枝芽孢杆菌属)相对丰度最高,Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)、Lactobacillus(乳杆菌属)、Bacillus(芽孢杆菌属)和Thermoactinomyces(热放线菌属)依次降低。在发酵第7 d,Lactobacillus(乳杆菌属)在酒醅中的相对丰度明显增大,Virgibacillus(枝芽孢杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)的相对丰度均降低。发酵14 d,丰度小于1%的其余细菌总相对丰度占比增加。与目水平一致的是,发酵前期(0~7 d)以Virgibacillus(枝芽孢杆菌属)和Kroppenstedtia(克罗彭斯特菌属)两个为优势属,14 d 始,Lactobacillus(乳杆菌属)演替为绝对的优势属,这表明细菌在整个发酵阶段以发酵14 d为分界线出现了明显的优势属的交替,在第一、二、五、六轮次的发酵14 d 入窖酒醅中均发生了优势属Lactobacillus的相对丰度明显升高的现象[14-15]。
随着发酵时间的延长,发酵中后期Lactobacillus(乳杆菌属)相对丰度增加,尤其是发酵第14 d 开始相对丰度显著增加,且一直维持到出窖,这期间窖池处于厌氧状态,适应厌氧呼吸的乳杆菌属快速生长,一些好氧或兼性好氧性细菌生长受到抑制,这也是细菌演替变化的表现,在王玉荣等[23]的研究中也发现Lactobacillus为第四轮次出窖酒醅中的绝对优势细菌属。而作为好氧的枝芽孢杆菌属则是呈现明显的减少趋势,与乳杆菌属相比,几乎呈现完全相反的变化趋势。研究将平均相对丰度>1%且至少在50%的样品中丰度超过1%的微生物定义为核心微生物[24-25],本文将酱香型白酒第四轮次入窖酒醅的优势细菌属定位到乳杆菌属和芽孢杆菌属,这两种优势细菌属在多种香型白酒发酵过程均有报道[19-20,22,26]。芽孢杆菌可代谢产生多种水解发酵原料的酶类,包括淀粉酶、糖化酶、蛋白酶等,发酵时产生吡嗪类、有机酸等风味物质,对于白酒风味具有重要影响[27-29]。乳杆菌属在发酵过程中利用糖类产生乳酸,为乳酸乙酯的合成提供前体物质,提高了酒体的醇厚感,其产生的有机酸类也与酒体酸味呈现显著的相关性[26,30]。此外,与南方酱香型白酒发酵中优势细菌属相比[12],Virgibacillus(枝芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Ralstonia(罗尔斯通菌属)是北京地区酱香型白酒发酵中独有的优势细菌属,而这些特有菌属在白酒酿造中的功能及对白酒风味的贡献尚无深入研究。以上结果表明北京地区酱香型白酒发酵优势细菌属除了具有和南方地区酱香型白酒发酵的优势共性细菌属外,还存在着其所特有的优势细菌属(图3c)。
2.1.2 真菌多样性 如图4a 所示为酱香型白酒第四轮次入窖酒醅中所测样品的真菌Sobs 指数稀释曲线,各真菌样本的测序数据量合理,测序深度足够,与实际生物信息相符合。如图4b 所示,所有样品的真菌Shannon 曲线在测序数在1000 左右时均趋向平坦,说明本实验中样本的测序数据量足够大,已经覆盖了样本中绝大多数真菌的多样性信息,结果科学可靠。
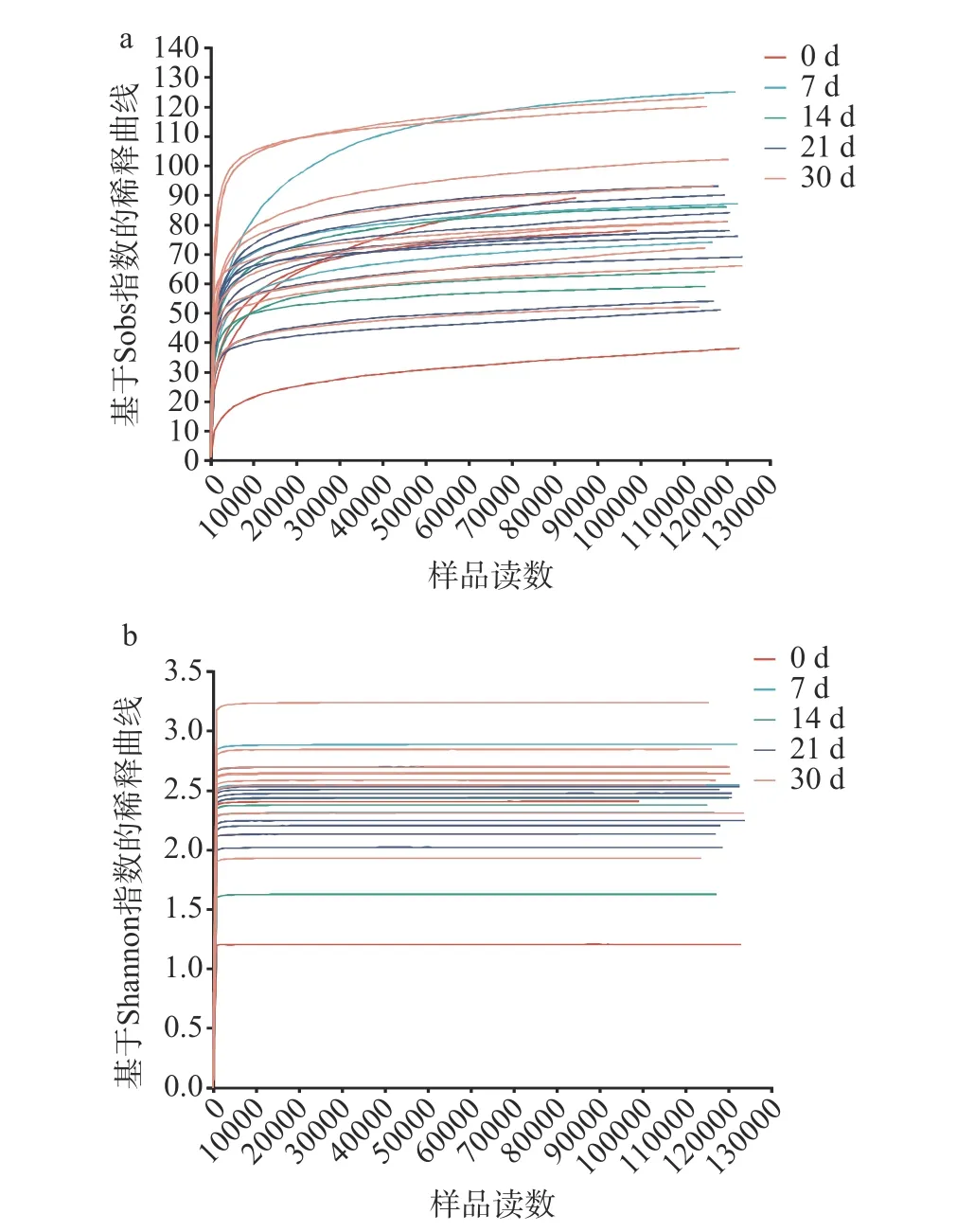
图4 酱香型白酒第四轮次入窖酒醅的真菌样本基于Sobs 指数与Shannon 指数的稀释曲线图Fig.4 Dilution plots of fungal samples of the fourth round Jiupei of sauce-flavored Baijiu based on the Sobs index and the Shannon index
门水平上,在酱香型白酒第四轮次入窖发酵酒醅中共检测到7 个门,其中丰度大于1%的真菌门包含Ascomycota(子囊菌门)、Basidiomycota(担子菌门)(图5a)。其中,Ascomycota(子囊菌门)在酱香型白酒第四轮次入窖发酵过程中相对丰度达95%以上,占绝对主导地位,这与戴亦杰[31]研究结果相同,说明在白酒发酵过程中,真菌门水平群落多样性较低,发酵微生态结构是由Ascomycota 和Basidiomycota 为主导的真菌微生物组合。

图5 酱香型白酒第四轮次入窖酒醅中门、目、属水平真菌群落组成Fig.5 Composed of fungal communities in the middle of the door,order and genus of the fourth round Jiupei of sauce-flavored Baijiu
目水平上,共检出36 个真菌目,丰度大于1%的有7 个,包括Eurotiales(散囊菌目)、Saccharomycetales(酵母菌目)、unclassified_p_Ascomycota(未分类子囊菌目)、Trichosporonalles(毛孢菌)、Microascales(小囊菌目)、Hypocreales(肉座菌目)、Pleosporales(格孢腔菌目)(图5b)。在发酵期间,Eurotiales 相对丰度呈现先增加后稳定的趋势,在第21 d处于最高值。相反的,Saccharomycetales 的相对丰度逐渐减小,同样,在第30 d 达到最小值。在目水平上,Eurotiales 和Saccharomycetales 占据绝对优势。
属水平上共检出169 个真菌属,丰度大于1%的有16 个,其中排名前10 的包括Thermoascus(嗜热子囊菌属)、Aspergillus(曲霉属)、Issatchenkia(伊萨酵母属)、Pichia(毕赤酵母属)、Thermomyces(嗜热真菌属)、Rasamsonia、unclassified_o_Saccharomycetales(未分类酵母菌属)、Monascus(红曲霉属)、Byssochlamys(丝衣霉属)、Penicillium(青霉属)(图5c)。其中,Thermeascus(嗜热子囊菌属)占真菌数量的15.34%~45.46%,平均相对丰度为35.40%,在入窖第14 d 达到最高值。Aspergillus(曲霉属)占真菌数量的3.44%~20.74%,平均相对丰度为14.76%,在入窖第7 d 相对含量开始剧增,在第14 d 达到最高值。Issatchenkia(伊萨酵母属)占真菌数量的2.46%~35.92%,平均相对丰度为14.45%,在发酵前期相对丰度较高,后逐步下降。在整个发酵期间,Thermeascus(嗜热子囊菌属)、Aspergillus(曲霉属)相对丰度呈现逐渐增加的趋势,相反的,Issatchenkia(伊萨酵母属)相对丰度呈现减少的趋势,这与目水平的结果一致,也进一步说明了Thermeascus(嗜热子囊菌属)、Aspergillus(曲霉属)和Issatchenkia(伊萨酵母属)均为优势属。
真菌的代谢活动产生了丰富的酶类物质,如酸性蛋白酶、纤维素酶、糖化酶、液化酶、酯化酶等,这些酶类物质对于粮食中大分子的物质如蛋白质、淀粉、脂质等起到了一定的转化作用[32]。虽然不同香型白酒主要的香味物质不同,但它们共同的特点是大部分都来自于酿造过程中微生物的代谢,真菌群落组成结构分析结果显示,霉菌、酵母菌占比较大,这与后期白酒的酒精含量和香气成分紧密相关。酵母菌和霉菌作为主要的功能菌,酵母菌通过代谢活动产生酒精,霉菌则为发酵前期生成有机酸和酯类物质的主要菌种[33]。在酱香型白酒的生产中,通过吸附萃取和热脱附结合气质联用仪测定白酒中酯类成分,可以发现霉菌不仅代谢产生柠檬酸、葡萄糖酸、草酸等有机酸,还能生成淀粉酶、蛋白酶等酶制剂[34]。综合分析上述结果,酱香型白酒第四轮次入窖发酵酒醅中的核心微生物包括细菌属的Lactobacillus(乳酸杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Virgibacillus(枝芽孢杆菌属),以及真菌属的Thermeascus(嗜热子囊菌属)、Issatchenkia(伊萨酵母属)、Aspergillus(曲霉属)。酱香型白酒第四轮次入窖酒醅中,与细菌多样性相比,真菌的多样性差异较小,其余轮次中酒醅的微生物多样性与第四轮次类似,也表现为真菌多样性低于细菌多样性的特征[14-15]。
2.2 第四轮次酿造过程中风味物质变化
2.2.1 白酒发酵过程酒醅风味物质分析 第四轮次酒醅样品共检出50 种挥发性物质,包含酯类28 种、醇类9 种、脂肪酸5 种、醛类2 种、其他化合物6 种。表3 展示了酒醅中挥发性化合物的相对含量, 其中酯类占比最高,其次是醇类和酸类。在白酒发酵过程中醇类、酯类、酸类化合物的含量随着入窖发酵时间的增加呈现先上升后下降的规律,而总酯相对含量在每一个发酵时间点都较高。
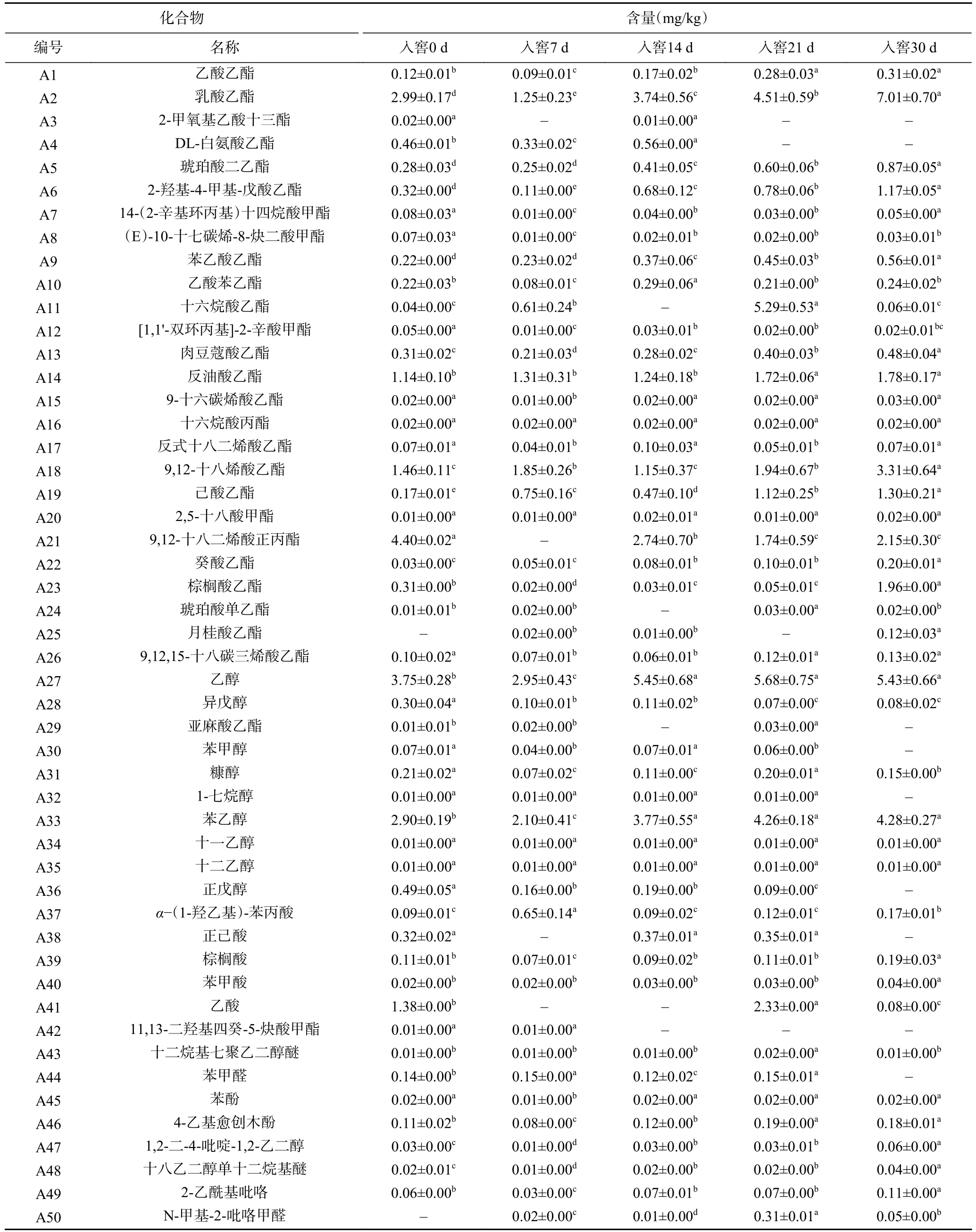
表3 基于气相色谱-质谱分析的样品挥发性化合物含量(mg/kg)Table 3 Volatile compound content of samples based on GC-MS spectrometry (mg/kg)
发酵30 d 时酒醅中挥发性化合物中,酯类物质的种类是所有测出的挥发性成分中最丰富的。我国的白酒与其他蒸馏酒的不同之一就是以酯香为主,尤其是体现在酱香型白酒中[35],大回酒酒质较好就是由于酯类、酸类物质占比高[36]。戴奕杰等[37]的研究显示在酒质较好的“大回酒”中,四大酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)的含量达到了酿造过程中的最高含量。本研究中乳酸乙酯(7.01±0.70 mg/kg)含量最高,其次是(E)-9-十八烯酸乙酯(3.31±0.64 mg/kg)、己酸乙酯(1.30±0.21 mg/kg)、琥珀酸二乙酯(0.87±0.05 mg/kg)、乙酸乙酯(0.31±0.02 mg/kg)等,均高于前三轮次入窖酒醅相应的酯含量[15],为酱香型白酒提供酯香风味。其中,乳酸乙酯含量由0 d 的2.99±0.17 mg/kg 提高到7.01±0.70 mg/kg;己酸乙酯含量由0.17±0.01 mg/kg 提高到1.30±0.21 mg/kg;乙酸乙酯含量由0.12±0.01 mg/kg 提高到0.31±0.02 mg/kg。醇类在21 d 含量最高,其中乙醇含量最高,其次为苯乙醇、糠醇、正戊醇、异戊醇、苯甲醇。其中乙醇含量由 0 d 的 3.75±0.28 mg/kg 增加到 21 d 的5.68±0.75 mg/kg,此后含量基本稳定不变;苯乙醇是除乙醇以外含量最高的醇类物质,含量由 0 d 的 2.90±0.19 mg/kg 增加到 30 d 的 4.28±0.27 mg/kg,在发酵后期(21~30 d)基本保持不变。高级醇在形成酒的味道、提高酒的丰满度和厚重感方面起着重要作用,它不仅本身可以呈香呈味,而且是白酒中甜味剂和助香剂的主要来源[38-39]。21 d 酒醅中酸性物质含量较高,出窖时含量降低,酸性物质中乙酸含量最高,其次为正己酸、α-(1-羟乙基)-苯丙酸、棕榈酸、苯甲酸。与其它香型相比,酱香型白酒中含量最高的酸是乙酸和丙酸[40],尤其是乙酸,在本研究中酒醅乙酸相对含量也较为突出,酸类物质的作用主要是影响白酒的口感和后味,起到呈香、助香、减少刺激和缓冲平衡的作用。在发酵过程中,其他挥发物(如酚类和醛类)的量没有观察到显著差异。
2.2.2 风味化合物与微生物群落的相关性 微生物代谢是白酒中风味化合物的重要来源,如Lactobacillus等产酸微生物使白酒酸味增加,Bacillus、Saccharomyces等相对丰度的提高能够使醛酮类、酯类等香气成分含量增加[41],图6 分析了北方酱味白酒第四轮次发酵过程中不同微生物与风味物质的相关性。

图6 酱香型白酒第四轮次入窖酒醅微生物群落与风味化合物的相关性Fig.6 Correlation between the microbial community and flavor substances in the fourth round Jiupei of sauce-flavored Baijiu
在关键细菌群落中(图6a),Lactobacillus与乳酸乙酯(A2)、琥珀酸二乙酯(A5)、(E)-10-十七碳烯-8-炔二酸甲酯(A8)、苯乙酸乙酯(A9)、月桂酸乙酯(A25)等呈显著正相关(P<0.01),结合已报道的其余轮次入窖发酵情况,发现Lactobacillus在酱香型白酒发酵过程中具有重要的酯类合成作用[14-15,42],是一种重要的功能微生物;Virgibacillus与苯甲酸(A40)、十二烷基七聚乙二醇醚(A43)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈显著正相关(P<0.01),与乳酸乙酯(A2)、琥珀酸二乙酯(A5)和苯乙酸乙酯(A9)呈显著负相关(P<0.01);同样地,Kroppenstedtia与琥珀酸单乙酯(A24)、苯甲醇(A30)、苯乙醇(A33)、十二烷基七聚乙二醇醚(A43)、1,2-二-4-吡啶-1,2-乙二醇(A47)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈显著正相关(P<0.01),这与Virgibacillus正相关的风味化合物相近,而两种菌的负相关性化合物也极为相似,包括乳酸乙酯(A2)、琥珀酸二乙酯(A5)、苯乙酸乙酯(A9)以及月桂酸乙酯(A25),这些显著相关的风味化合物与白酒发酵过程中酒醅细菌群落多样性的演替相对应,即发酵过程中优势属由Virgibacillus、Kroppenstedtia逐渐转变为Lactobacillus。
在关键真菌群落中,Thermoascus与十八乙二醇单十二烷基醚(A48)呈正相关,与DL-亮氨酸乙酯(A4)、癸酸乙酯(A22)、棕榈酸乙酯(A23),苯甲醇(A30)呈负相关(图6b)。Aspergillus曲霉菌与乳酸乙酯(A2)、(E)-9 十八烯酸乙酯(A14)呈显著正相关(P<0.01),与苯甲醇(A30)呈负相关(图6b)。Issatchenkia与DL-亮氨酸乙酯(A4)、4-乙基愈创木酚(A46)呈正相关,与丁酸(A41)呈显著负相关(P<0.01)。Thermoascus与Issatchenkia相关的部分风味化合物呈现出相反的相关性,这对发酵期间优势属Thermeascus相对丰度呈现逐渐增加而Issatchenkia相对丰度逐渐减少的演替过程提供佐证(图5c)。
在之前的研究中发现,对白酒风味具有贡献的关键酯类物质有48 种[2],传统观点中与白酒的风味密切相关的四大乙酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)均包含在内,通过对第四轮次发酵酒醅中微生物与风味物质的关联性分析,发现Monascus、Lactobacillus和Wickerhamomyces分别与乙酸乙酯、乳酸乙酯和己酸乙酯呈显著正相关(P<0.01)。已有研究显示红曲霉通过产酯化酶可提升白酒中乙酸乙酯[43]、己酸乙酯[44]等酯类含量,石馨等[45]已将Wickerhamomyces应用于模拟发酵提升己酸乙酯含量,同样地可以在白酒发酵过程中利用功能微生物菌属Monascus、Lactobacillus等改善其余轮次基酒风味,有助于提高白酒的品质。
3 结论
酱香型白酒采用传统的固态发酵模式,开放式的发酵过程导致环境中多种微生物参与其中,随着入窖发酵的进行,原料消耗、窖池环境变化使每轮入窖都形成感官有差异的轮次酒,不同轮次酒的微生物结构和风味物质组成存在着明显不同,其中以大回酒中第四轮次酒风味最佳。本文以北京地区酱香型白酒第四轮次发酵酒醅为研究对象,分析了发酵过程中核心微生物的结构变化和风味物质的差异。第四轮次发酵酒醅中,优势细菌属为Lactobacillus、Virgibacillus和Kroppenstedtia,优势真菌属为Thermoascus、Issatchenkia和Aspergillus,在整个发酵过程中,优势菌属由Virgibacillus、Kroppenstedtia、Issatchenkia交替为Lactobacillus、Thermoascus、Aspergillus。白酒发酵过程中关键风味化合物醇类、酯类、酸类的含量随着入窖发酵时间的增加呈现先上升后下降的规律,并且酯类相对含量较高,这显著影响酱香型白酒的产品品质。关联性分析显示Monascus、Lactobacillus和Wickerhamomyces分别与白酒中关键风味物质乙酸乙酯、乳酸乙酯和己酸乙酯呈正相关。本研究有助于寻找酱香型白酒发酵过程中潜在的功能微生物、明晰微生物与风味物质的相关性,为不同轮次酱香型白酒微生物区系波动和风味物质关联比较分析提供基础数据,有助于推动提高酱香型白酒品质的研究。

