2 例Aw43 亚型的血清学和分子生物学鉴定分析
朱于莉 韩斌 冯智慧
(青岛市中心血站输血研究所,山东 青岛 266071 )
ABO 血型系统通常可分为A、B、O、AB 这4 种表型,而ABO 亚型是指在这4 种血型之下进一步细分的ABO 血型,这些亚型必须具有遗传基础,并且有明确的血清学特点[1]。其中最突出的血清学特点就是正反定型不符:红细胞上A或(和)B 抗原表达减弱,多数伴有血清中含弱抗原的抗体,从而导致血型鉴定困难甚至误判。 因此准确的鉴定出ABO亚型,对于临床患者输血十分重要。 基因分型技术的快速发展,为亚型的鉴定提供了强有力的支持依据,也不断扩大着亚型的等位基因库[2]。 我们发现了2 例疑难血型,通过分子检测确定为2 例罕见的Aw43 亚型,现报告如下。
1 材料与方法
1.1 研究对象
标本1 为男性,12 岁,泌尿外科患者;标本2 为女性,38岁,妇科患者,均在当地医院检测发现ABO 正反定型不符,随后送至本实验室进一步检测。
1.2 试剂和仪器
抗-A(批号20220102)、 抗-B(批号20220102)及ABO标准红细胞(批号20235301)和抗-H 试剂(批号20210917)(上海市血液生物),抗-A1(批号8000452124)(荷兰Sanquin)、抗-AB(批号842000)(法国DIAGAST),基因组DNA提取试剂盒(美国Invirtrogen),Ex-Taq 试剂盒(TaKaRa,批号KA5801CA),克隆测序使用的LA-Taq 试剂盒(TaKaRa批号KA4601YA)及高效克隆PCR 产物专用载体(pMD18-T vector)(TaKaRa,批号K6801AB);血清学离心机(KA-2200,日本KUBOTA 公司)、Bio-Rad C1000 PCR 扩增仪(美国Bio-Rad)、3100 型测序仪(美国AB)。
1.3 血清学试验
采用标准试管法[3]进行ABO 血型正反定型试验。
1.4 基因检测
1.4.1 DNA 提取
采集2 例研究标本外周血1 mL(EDTA 抗凝血),参照试剂盒说明书操作提取血液标本全基因。
1.4.2 DNA 序列直接分析
对ABO基因启动子、 第1 ~7 外显子和侧翼序列进行PCR 扩增并分析序列,引物序列及PCR 反应条件参见本实验室之前发表的文章[4]。 测序结果采用GEBtle 软件进行序列分析。
1.4.3 克隆测序分析
扩增ABO基因的外显子1、3、4、5、6、7,将扩增产物纯化后克隆入T 载体,并挑取多个阳性菌落进行培养增殖,提取质粒DNA 用于检测标本的单体型。
1.5 蛋白结构分析
采用SIB Expasy 对DNA 序列进行氨基酸翻译并预测蛋白读码框,采用DeepTMHMM 进行跨膜区预测和分析。
2 结果
2.1 血清学试验结果
2 例标本ABO 血型血清学结果十分相似,均表现为正定A 抗原减弱,同时反定存在抗-A,与抗-H 的反应增强,见表1。

表1 2 例标本的ABO 血型血清学结果Table 1 ABO serologic grouping results of 2 cases
2.2 ABO 基因序列分析
将2 个血液标本提取DNA,进行ABO基因增强子序列、1-7 外显子及侧翼序列的直接测序分析,并将结果与A101序列进行比对。 标本1 的增强子为A+G 型,存在1A/G、297A/G、467C/T、526C/G、657C/T、703G/A、796C/A、803G/C、930G/A、1096G/A 杂合;标本2 的增强子也是A+G 型,存在 1A/G、 106G/T、 188G/A、 189C/T、 220C/T、 261delG、297A/G、467C/T、646T/A、 681G/A、771C/T、829G/A 杂合。进一步对2 个标本进行克隆测序,每个标本均可检测到2 种基因型,测序结果见表2。 通过GeneBank 序列比对确认,标本1 基因型为Aw43/B101,标本2 基因型为Aw43/O02。

表2 2 例标本的ABO 基因克隆测序结果Table 2 ABO gene analysis results of 2 cases
2.3 ABO 蛋白结构域分析
Aw43 等位基因第1 位碱基发生A>G 突变,破坏了起始密码子ATG,导致翻译起始位点后移。 对开放阅读框(open reading frame,ORF)进行分析显示后续可能存在13 个翻译起始位点(Met,M),分别位于跨膜区、茎区和催化区(表3)。
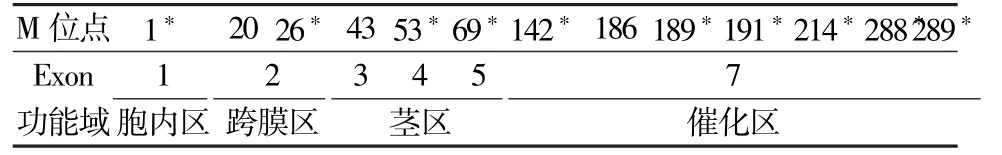
表3 潜在的翻译起始位点及定位Table 3 Potential translation initiator of the ABO gene
若以改变最小的第20 位Met 作为翻译起始位点,则形成的蛋白由原来的354 个氨基酸缩短为335 个。 采用DeepTMHMM 进一步对跨膜区进行预测和分析,结果显示,缺失20 位氨基酸严重影响了跨膜区的结构,形成跨膜区的概率从100%降低至<10%,且蛋白拓扑结构也从alpha 跨膜区(alpha transmembrane,TM)转变为球形的信号肽(signal peptide,SP)(图1)。
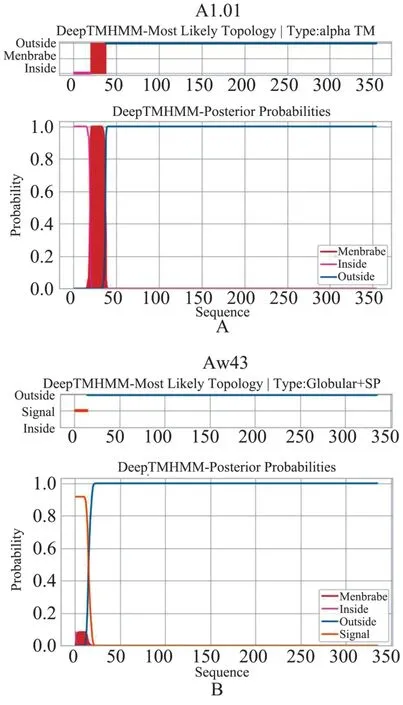
图1 DeepTMHMM 分析编码蛋白跨膜区Figure 1 Transmembrane regions of encoding protein:DeepTMHMM analysis
3 讨论
我们发现的2 例标本的血清学试验结果类似AX亚型,即正定与抗-A 反应减弱,抗-A1阴性,同时血清中存在抗-A。对这2 例标本进行DNA 序列分析,发现2 例的ABO基因中都存在1A>G, 467C>T 突变,经与National Center for Biotechnology Information(NCBI)网站的The Blood Group Antigen Gene Mutation Database 比对确认为Aw43 等位基因型(GeneBank:KU128404)。 同时我们也注意到,在不同数据库中Aw43 的命名存在矛盾:根据International Society of Blood Transfusion(ISBT)网站提供的Names for ABO (ISBT 001) blood group alleles v1.1 171023,Aw43 的突变位点是c.467C>T、 c.721C>T,与NCBI 的不同。 在此我们选择按照NCBI 的等位基因定义,本文所指Aw43 即1A>G, 467C>T,以避免混淆。
Aw43 亚型是2016 年由浙江省血液中心许先国课题组发现并报道的[5],经序列提交GeneBank后命名为Aw43。Aw43 亚型相对较少,经文献检索,目前相关报道仅有2 篇文献,且均为中国人报道,除了首次发现的上述报道外,江苏省血液中心在2021 年报道了1 例[6],这2 例的血清学试验结果与我们此次报道的相似,均为A 抗原减弱甚至无法检测,反定有或未检测到抗-A。 上述数据提示此Aw43 亚型的发生概率极低。
Aw43 亚型的分子特征是ABO基因存在1A>G, 467C>T 突变,其中1A>G 破坏了起始密码子ATG,导致翻译起始位点后移;而467C>T 则导致156 位氨基酸由CCG(脯氨酸,Pro)突变为CTG(亮氨酸,Leu)。 单独467C>T(P156L)突变是等位基因A102(GeneBank:AF134413)的分子特征[7]。 虽然与A101 相比,A102 的基因序列发生了突变,也导致编码氨基酸的序列改变,但此突变并未影响到所编码的α-1,3-N-乙酰半乳糖胺基转移酶(α-1,3-N-Acetylgalactosaminyltransferase,GTA)的活性,红细胞膜上A 抗原表达正常,与A101 类似[8]。 并且目前日本和我国的研究发现,在亚洲黄种人中A102 比A101 更占数量优势[9]。 因此我们认为导致Aw43 亚型A 抗原减弱的原因应该是1A>G。
GTA 是Ⅱ型跨膜蛋白,这些跨膜蛋白定位于高尔基体内,包含1 个位于细胞质内的16 个氨基酸的N 段结构域、1 个21 个氨基酸的单跨膜结构域和1 个扩展的茎区,然后是1 个在高尔基体腔内的C 端催化结构域[10]。 高尔基体的主要功能是将内质网合成的蛋白质进行加工、分拣与运输,然后分门别类地送到细胞特定的部位或分泌到细胞外。这其中最重要的1 项加工就是糖基化:内质网起始合成N-连接的糖链由顺面进入高尔基体后,在各膜囊之间的转运过程中发生了一系列有序的加工和修饰,被多种糖基转移酶依次加上了不同类型的糖分子,形成了结构各异的糖链,最终这些糖链分泌到细胞外或锚定在膜上,发挥各自的功能[11]。1A>G 突变导致GTA 翻译起始位点后移,很可能后移到穿膜区的M26 或柄状茎区的M53 或M69,形成N 端截短的蛋白。 通过我们的预测分析,哪怕是后移到第1 次出现的M20,也会严重影响跨膜区的形成,导致所形成的GTA 蛋白缺失跨膜区,蛋白结构发生改变。
除Aw43 外,其他存在翻译起始位点突变的亚型还有A309(1A>G)[12]、Aw13(2T>C)[13]和Aw16(1A>G, 467C>T, 1061delC)[14]。 这3 种亚型均表现为正定A 抗原减弱,有的会出现混合凝集。 研究人员针对此类突变设计了体外功能试验,比如发现Aw13 亚型的Seltsam 采用流式细胞技术检测转染了突变质粒的Hela 细胞,结果与A101 相比,发现突变后表达A 抗原的细胞数降低了33%,A 抗原的表达量降低了41%[13]。 Yamamoto 等[10]在对不同转录起始位点对A 抗原表达影响的体外研究试验中得出结论:GTA 的跨膜和茎干结构域对于A 抗原的合成是必须的,细胞质内的尾部是可有可无的。 但GTA 的跨膜区除了维持蛋白稳定性外,是如何影响酶活性的? 由跨膜结构域或茎区的替代翻译起始位点触发的N 端截断的GTA 又是如何表达和修饰的? 这些问题目前还没有相关研究。 因此,Yamamoto 等[10]对此提出猜测:GTA 对A 抗原合成的作用也许同β-1,4-N-乙酰氨基半乳糖转移酶(β4GalNAcT)和β-1,3-半乳糖转移酶(β3GalT)的作用类似,在高尔基体中,这2 个酶的N 端结构域(含胞内、跨膜和少量氨基酸茎区)参与相互作用,通过转移步骤将中间体从产物位置引导到受体位置,从而提高了糖脂合成的效率[10,15]。 但这一切目前均处于理论假说阶段,N 端缺失对GTA 功能的影响机制还需要进一步的深入研究。

