计划免疫后出生献血者乙肝无症状慢性感染血清学与分子生物学特征分析
叶贤林 李彤 王若楠 李然 刘衡 曾劲峰
(深圳市血液中心,广东 深圳 518040)
乙型肝炎病毒(hepatitis B virus,HBV)感染是目前全球有待解决的公共卫生问题之一。世界上约5%的人口感染慢性乙型肝炎,近25%的HBV 携带者发展为慢性乙型肝炎,可能导致肝硬化,甚至肝细胞癌[1-2]。在我国,乙肝是3 大传染病之一,每年约有30万患者死于乙肝相关疾病[3]。此外,HBV感染是导致癌症死亡的2 个常见危险因素之一[4]。乙肝疫苗接种是预防乙肝感染最有效方法之一,但由于疫苗3 针保护差异,疫苗接种无反应,抗体滴度下降(保护时间一般在8~12 年),基因型差异及病毒免疫逃逸株出现,使仍有新感染不断出现[5]。我国自1992 年开始对新生儿接种乙肝疫苗,2002年全部免费接种。为了探讨乙肝疫苗对献血人群乙肝感染的影响,我们通过对深圳市献血人群经过HBsAg和核酸NAT筛查后的乙肝感染者,进行两对半、巢式PCR、基因测序等方法检测,调查分析计划免疫后出生献血者的感染情况及基因突变情况,现报告如下。
1 材料与方法
1.1 研究对象
2020年9月—2021年10月深圳市血液中心收集的1992 年1 月1 日后出生并经HBsAg ELISA 和ALT 初筛合格的无偿献血者标本46 632 份(男性31 612 份,女性15 020 份),其中HBsAg ELISA+共99份。
1.2 试剂与仪器
大容量病毒核酸提取试剂(罗氏公司,批号:39452000)。Premix Ex Taq 酶试剂盒(TAKARA 公司,批号:AJ52058A),DL2000 DNA Marker(TAKARA 公司,批号:A1301A);琼脂糖(BIOWEST 公司,批号:WXBB0828V);基因测序外送华大基因科技公司检测。Veriti Dx PCR 仪(ABI 公司),MX3005P实时荧光PCR 仪(Agilent 公司),5840 离心机(Eppendorf 公司),DK-8B 电热恒温水槽(上海精宏实验设备公司),水平电泳仪(上海伯乐公司),UV-254暗箱紫外透射仪(北京鼎国公司)。
1.3 方法
1.3.1 HBV DNA提取
采用2.5 mL 核酸大容量提取方法提取标本血浆的HBV DNA。操作严格按照试剂说明书进行。
1.3.2 乙肝两对半检测
所有HBsAg ELISA+标本送广州金域(广州)科技有限公司采用罗氏化学发光法检测HBsAg、HBsAb、HBeAg、HBeAb和HBcAb。
1.3.3 BCP/PC和S目的基因片段的扩增
以巢式PCR 扩增BCP/PC 和S 片段(长度为263 bp和496 bp),进行2轮扩增,用2%的琼脂糖凝胶进行水平电泳检测扩增产物,阳性标本的第2轮扩增产物外送深圳华大基因公司测序。
1.3.4 标本DNA定量检测
使用实时荧光定量PCR 仪和配套试剂对标本病毒载量进行测定。洗脱液上样量为5 μL,补蒸馏水至25 μL进行测定。
1.3.5 阳性结果判定
以下3种情况满足任意1种即为确证阳性:1)化学发光法:HBsAg 阳性;2)巢式PCR:S 片段或者BCP/PC 片段至少有1 个是阳性;3)实时定量PCR:阳性。
1.3.6 HBV S序列系统进化树分析
选取A-I 基因型HBV 野毒株各3 份,用MEGA7.0 系统进化软件以邻接法Kimura 2-parameter 模式,验证复数1 000,构建HBV S 序列系统进化树。
1.4 统计学分析
采用STATA 14.0 统计分析软件处理数据,分类变量资料采用χ2检验,连续变量资料采用Mann-Whitney U 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HBV感染献血者HBV检测总体情况
HBV感染献血者HBV检测总体结果见表1、表2,乙肝两对半检测结果见表3。
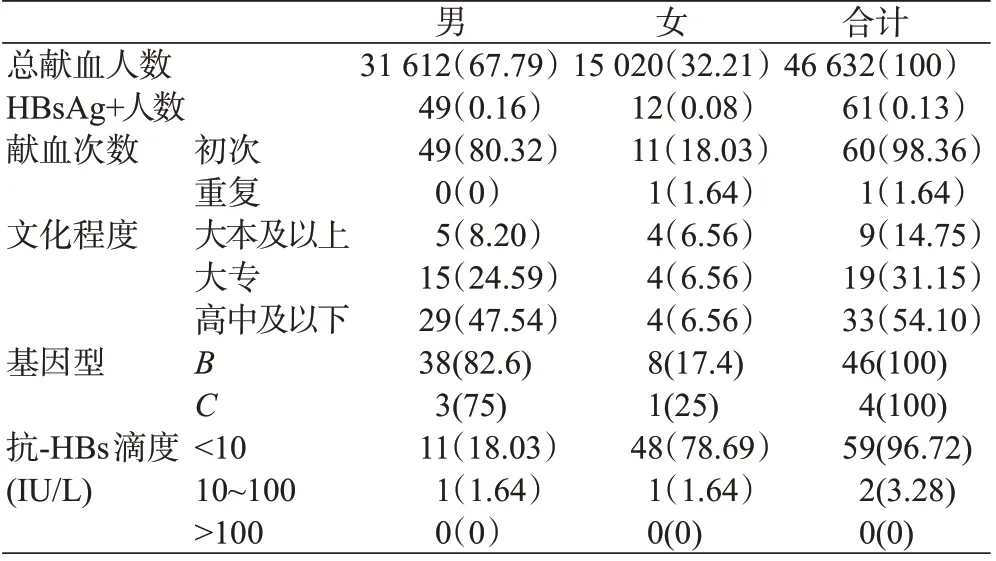
表1 HBV感染献血者检测总体结果(一)(n,%)Table 1 Overall results of blood donors infected with HBV(n,%)(Part1)
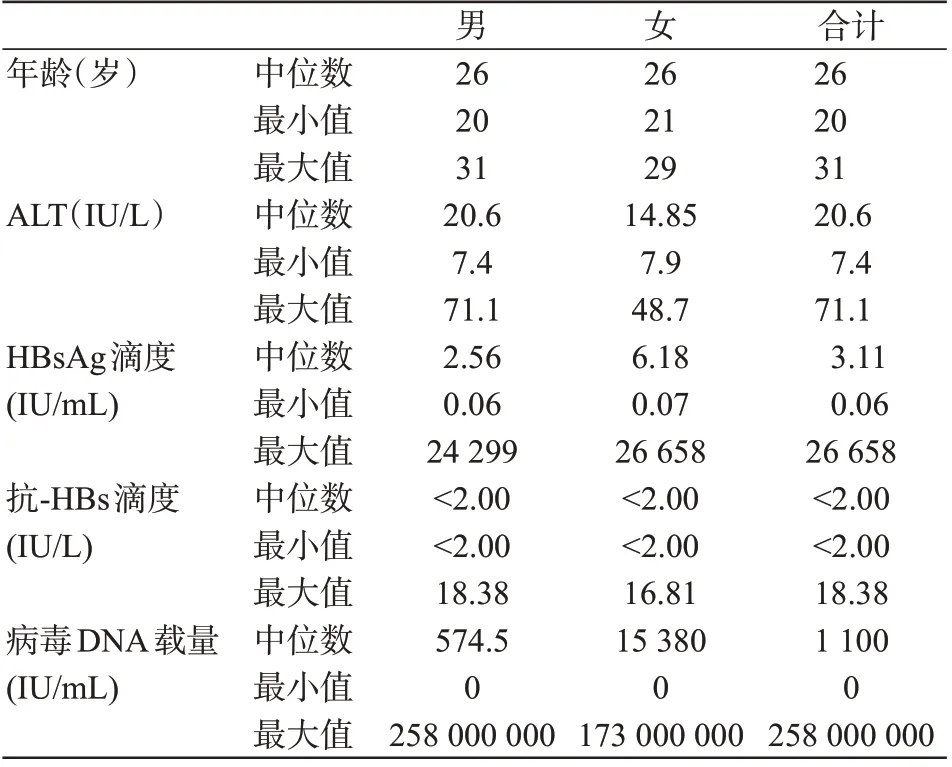
表2 HBV感染献血者检测总体结果(二)Table 2 Overall results of blood donors infected with HBV(Part2)
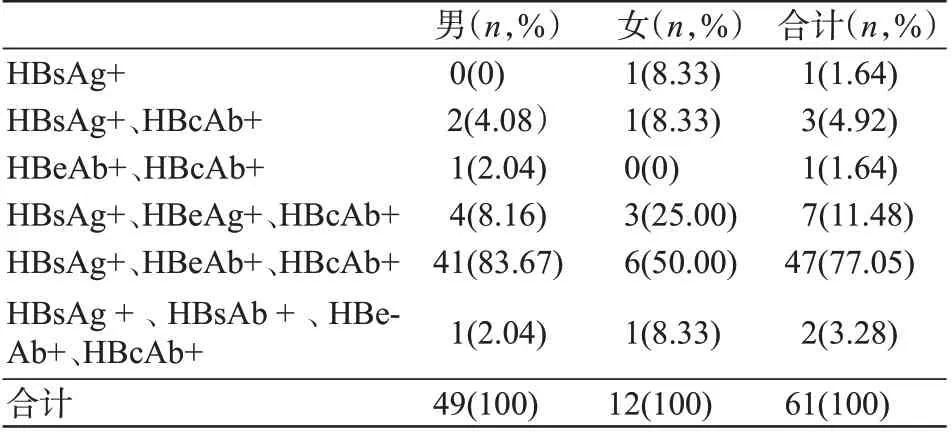
表3 61份确证阳性献血者标本血清学模式分布Table 3 Serological pattern distribution of 61 confirmed positive blood donor samples
2.2 HBV感染献血者HBsAg滴度比较
不同性别HBV感染献血者HBsAg滴度取对数进行比较,P>0.05,见图1。
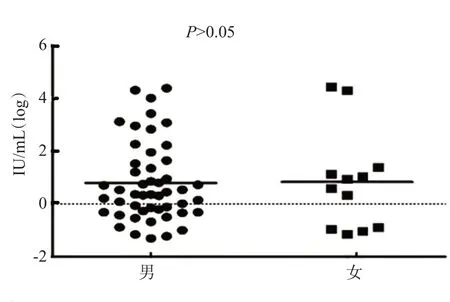
图1 不同性别HBV感染献血者HBsAg滴度比较Figure 1 Comparison of HBsAg titers in blood donors infected with HBV of different genders
2.3 HBV感染献血者HBV基因分型
共50份标本获得S序列,其中B型46份[(92%,46/50),男性38份,女性8份],C型4份[(8%,4/50),男性3 份,女性1 份],不同性别间比较无差异(P>0.05)。系统进化树分析见图2。

图2 HBV感染献血者HBV S基因系统进化树分析Figure 2 Phylogenetic tree analysis of HBV S gene in blood donors infected with HBV
2.4 HBV感染献血者HBV S区突变分析
46 份B 型乙肝感染者病毒株S 区突变频率高的是N40S(8/46,17.39%)、G44E(7/46,15.22%)、T126S/N/I/A(5/46,10.87%)、Q129H/R(6/46,13.04%)、Y161F/S(7/46,15.22%)、V179A(4/46,8.70%),其中免疫逃逸突变有T126S/N/I/A、Q129H/R。发现2 份G145R 免疫逃逸突变,男女各1 份。4 份C型乙肝感染者病毒株S 区突变频率高的是S53L(2/4,50%)、C69T(2/4,50%)、I126S/T(2/4,50%),其中免疫逃逸突变有I126S/T。在主要亲水区(MHR,aa99-aa169)经检测B型有63%(29/46),C型有50%(2/4)发生突变。
3 讨论
HBV 感染是危害人类生命安全的最严重问题之一。HBV 的感染特点为感染率高、感染人数众多、病程长、且缺乏特效药物及难以完全治愈[3]。目前预防HBV 感染最有效的措施就是注射疫苗。1992 年我国出台了《全国乙肝免疫接种实施方案》,将乙肝疫苗纳入计划免疫管理。随着乙肝疫苗在全国范围内的推行,我国的乙肝预防工作取得了初步成效。然而,HBV 在一些如宿主、免疫、病毒以及诱发因素的压力下容易产生突变,这是因为HBV反转录酶缺乏校正功能,其中S 基因发生的突变会影响HBV产生抗体免疫应答,影响疾病进展,这被称之为免疫逃逸相关突变。已有研究表明,HBVS基因区的变异,特别是S基因的a 决定簇和MHR 上的氨基酸变异,将会减少S 蛋白的分泌,同时降低与抗-HBs 的亲和力,从而导致HBsAg 检测失败以及HBV产生免疫逃逸现象[5]。目前,计划免疫后出生的疫苗接种献血者已逐渐占献血主体地位,为提高输血安全,有必要深入研究和监测免疫压力下病毒突变株流行概况,分析其生物学特征。
位于HBV 亲水区(MHR,aa99-aa169)的逃逸突变在全世界范围内被广泛报道,例如阿根廷14.8%[6]、摩洛哥15%[7]、波兰15.4%[8]、伊朗14%~32.8%[9-11]、塞尔维亚22.6%[12]、法国27.8%[13]、韩国44.1%[14]等。MHR 突变能够带来一系列的诊断问题,还会导致隐匿性乙肝(OBI)、疫苗逃逸突变以及乙肝免疫球蛋白治疗无效[15-19]。病毒突变引起HBV 疫苗突破感染的机制包括:1)改变构象结构和/或T细胞表位结构,进而通过免疫系统使突变病毒逃避识别和清除;2)通过疏水情况和推定的糖基化位点的变化来改变HBsAg的抗原性,因而减少或消除对HBsAb的亲和力,导致保护减少[20]和HBsAb反应正常的患者感染不同基因型或亚型的HBV毒株;3)由于突变型在“a”决定区域内或周围,aa替代的积累可能会改变HBsAg的免疫性,产生对HBsAb的无效响应,使得突变病毒逃避清除、有着更长的生存期[21]。本研究发现63%的基因型B和50%基因型C在MHR 区间发生突变,远高于上述几个国家的报道,应引起高度重视和关注。
本研究中HBV 感染献血者HBV基因s126 和s129 上的突变主要为s T126S/N/I/A(5/46,10.87%)和s Q129H/R(6/46,13.04%),这2 种突变均被认为是免疫逃逸突变,仅在基因型为B的突变株上出现[18,22]。B基因型T126S/N/I/A 和C基因型I126S/T 突变型与免疫逃逸有关,其与单克隆抗体(MAbs)的结合将会受到影响[24]。有研究表明sQ129R会减少表面蛋白和病毒颗粒的分泌[24]。这一突变在HBsAg 和HBsAb 共存的慢性乙肝患者中被多次发现[25-27]。因此,在我国sT126S/N/I/A 和sQ129R 是B型突变株中重要的逃逸突变。s145 位置上的突变率约为2.3%,包括sG145R(2/46,4.35%),这种突变主要在C突变型中被发现,而本研究的标本发生在B基因型突变,应引起高度重视。sG145R 首次在1名乙肝患儿体内被发现,该名婴儿已有保护滴度的HBsAb[28],在后来的几十年中,sG145R 成为了被报道最多的疫苗逃逸突变[18,22,27-28]。研究发现,sG145R可以显著地减少病毒颗粒的分泌,还会减弱对乙肝表面抗原的检测[24]。同时,sG145R/A在不同的试剂检测中还会表现出不同程度的HBsAg结合改变[15,29]。另外针对B型和C型突变株的研究发现,sG145R/A与隐匿性乙肝(OBI)有关[18]。更重要的是,sG145R会随着时间的推移变得更加稳定,最终导致水平传播[18,30]。因此,表面基因的sG145R/A突变可能会在未来对“全球疫苗计划”造成威胁。
我国自1992年起实施了全面的乙肝疫苗接种计划,使15 周岁以下人群乙肝HBsAg 阳性率迅速由8%下降到0.8%~1.99%,同时在疫苗接种献血人群中抗-HBc 水平(20.8%)明显低于一般人群(42%~58%)[31-32],计划免疫后出生献血人群总体HBV 检出率(乙肝急慢性感染和OBI)也显著性低于计划免疫前出生献血人群[33]。本研究HBsAg 阳性率为0.13%,远低于同地区总献血人群中的确证比例0.5%[33],表明疫苗接种的确能降低输血感染乙肝风险。疫苗接种是否具有保护性主要是抗-HBs 滴度。本研究发现HBV 感染献血者中只有2 名抗-HBs+,滴度<20 IU/L,HBsAg 滴度<20 IU/mL,表明即使接种了疫苗,由于接种无反应或抗体滴度减弱,也会失去保护性。而男性HBsAg阳性率高于女性(P<0.05),性别差异是由一系列因素引起的,例如:基因、激素,以及细胞因子等[34]。
综上所述,目前高频率的HBV毒株突变,尤其免疫逃逸相关突变无疑对输血安全产生了很大威胁。对此,除大力普及乙肝相关性疾病的健康知识(如传播途径、防护手段),提高大众的防范意识,构建更加安全采供血体系外,还应该加强对病毒基因突变尤其免疫逃逸突变的监测和研究。

