无锡地区HBsAg-/HBV DNA+献血人群HBcrAg 检出特点分析
王嫣 金建怀 许友山 郝庆钦 夏卫
(无锡市中心血站,江苏 无锡 214000)
新型血清标志物乙型肝炎核心相关抗原(hepatitis B core-related antigen,HBcrAg)由前C基因和C基因编码的HBcAg、HBeAg、p22cr 3种蛋白组成,它们共同拥有1 段149 个氨基酸的序列,可被同1抗体检测。松弛环状DNA(rcDNA)感染肝细胞后,首先要被修复成共价闭合环状DNA(covalently closed circular DNA,cccDNA)[1]。HBV cccDNA 是复制的原始模板,它的形成和持续存在是引起HBV 慢性感染和导致慢乙肝患者难以治愈及肝癌发生的关键因素,也是激活隐匿性HBV 感染(occult HBV infection,OBI)的主要原因[2]。临床上肝活组织检查可以准确反映肝组织内HBV cccDNA 的水平,但肝活检是1 种有创检查,且需要进行多次有创检查,多数患者很难接受,故通过肝活组织检查来监测患者HBV cccDNA 水平还存在着较大的困难,目前迫切需要寻找1种操作方便且能反映肝组织内cccDNA水平的血清学替代指标。
HBcrAg 能够反映肝组织cccDNA 的含量和转录活性,是近年来的研究热点[3]。研究表明,在未治疗及经NAs 治疗后的慢乙肝患者中,无论HBeAg阳性或阴性患者,HBcrAg与cccDNA具有显著相关性[4]。我国是乙型病毒性肝炎感染大国,慢性感染人数至少2.57 亿人[5],献血者中潜在的HBsAg-/HBV DNA+感染者排除窗口期感染即为OBI。OBI作为HBV 持续性感染的特殊形式,成为威胁血液制品安全和受血者健康的隐患,随着核酸技术与酶联免疫吸附技术在血液筛查中互补开展应用逐渐被最大限度检出。目前有关新型血清标志物HBcrAg 的研究多为慢性乙肝感染、肝硬化、肝癌患者等。本研究从血液安全角度出发,旨在分析血清中HBcrAg 在献血人群筛检HBsAg-/HBV DNA+感染者的表达情况,为探讨其在OBI感染发病机制中的作用提供新的思路,从而改进血液HBV筛查方法,降低漏检率,提高临床用血安全。
1 对象与方法
1.1 研究对象
对无锡市中心血站2019—2020 年104 917 名无偿献血者进行2遍酶联免疫吸附法及1遍实时荧光定量PCR 核酸初筛,选取了47 名HBsAg-/HBV DNA+献血者进行电话追踪,成功追踪到37名至本站采集血液标本。37 份HBsAg-/HBV DNA+献血者血液标本进行1 遍电化学发光法和PCR 核酸检测筛查出22 名HBsAg-/HBV DNA+献血者标本作为OBI组。选取20名经过2遍酶联免疫吸附法及1遍PCR核酸检测都合格的献血者作为健康对照组,选取20名经无锡市第五人民医院临床诊断为慢性乙型肝炎(chronic hepatitis B,CHB)患者作为CHB组,其中男15名,女5名;年龄25~51岁,所有病例6个月内未使用抗病毒制剂;诊断标准参照《乙型病毒性肝炎诊断标准》(WS299-2008)以及《慢性乙型肝炎防治指南》(2015更新版)[6]。
1.2 试剂与仪器
HBsAg ELISA 检测试剂(英科新创公司,批号:B20201139;上海科华公司,批号:202009231),Cobas TaqScreen MPX test HBV 核酸检测试剂(罗氏诊断公司,批号:G11355)。乙肝两对半:乙型肝炎病毒抗原抗体检测系统(HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc)检测试剂盒(化学发光法)(上海博阳生物科技有限公司,批号:A2001);HBcrAg 检测试剂(厦门仑昌硕公司,批号:202102210033)。LICA500 自动化学发光检测仪(上海博阳公司),Hamilton STAR全自动加样仪、Microlab FAME 全自动酶联免疫分析系统(Hamilton 公司),Cobas S201 全自动核酸检测系统(罗氏诊断公司),RT-6100 酶标分析仪(Rayto 公司);AU480 全自动生化分析仪(贝克曼公司)。
1.3 方法
1.3.1 标本采集
无菌操作采集37 份既往HBsAg-/HBV DNA+献血者的新鲜血清,分成酶免(分离胶)检测和核酸(带分离胶,EDTA-K2抗凝)检测各1 管(5 mL/管)。采血后4 h 内1 800×g,离心20 min,2~8℃保存,并在48 h内完成检测。剩余血清-80℃保存。
1.3.2 血清学检测
对37 份既往HBsAg-/HBV DNA+献血者血清用化学发光法检测HBsAg,若为阴性,则进行下一步核酸检测。
1.3.3 核酸检测
采用Cobas Taqsceen MPX 试剂进行单标本检测,单标本检测有反应性判定为NAT 阳性,即为HBsAg-/HBV DNA+OBI 组;单标本检测无反应性判定为NAT阴性,不纳入本研究范围。
1.3.4 乙肝两对半检测
对纳入研究的OBI 组标本进行化学发光法检测乙肝抗原抗体系统。
1.3.5 丙氨酸氨基转移酶(ALT)检测
对OBI组标本进行ALT检测,检测范围是5~50 U/L。
1.3.6 HBcrAg含量的检测
对本研究的3 组标本都采用双抗体一步夹心法酶联免疫吸附试验(ELISA)检测,实验严格按照试剂盒说明书进行。实验重复3 次。检测范围是(0.25~8)ng/mL。
1.3.7 HBV DNA定量
采用实验室内部自建系统定量(标准曲线法)[7]。
1.4 统计学分析
数据采用SPSS20.0 软件进行统计分析。正态分布的计量资料以±s 表示,两组间比较采用独立样本t检验,多组间比较用单因素方差分析。HBcrAg与乙肝血清学相关指标采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般资料
CHB 组、OBI 组与健康对照组在年龄、性别构成比、ALT 方面均无差异(P>0.05),各组间具有可比性,见表1。

表1 3组研究对象基本信息Table 1 Basic information of 3 groups of research subjects
2.2 OBI组乙肝两对半的检出特征
37份献血者标本经化学发光法检测HBsAg 和核酸筛查,检出22 份HBsAg-/HBV DNA+标本,检出率59.46%(22/37),对这22 例OBI 进行乙肝两对半的检测,HBsAg 检测都为阴性,HBcAb 检出率86.36%(19/22),HBeAb检出率22.73%(5/22)。
2.3 CHB 组、OBI 组与健康对照组的血清中HBcrAg表达水平比较
HBcrAg表达水平在3组间两两比较(单因素方差分析),均有差异(P<0.05),见表2。
表2 3组研究对象HBcrAg表达比较(±s)Table 2 Comparison of the expression of HBcrAg among three groups(x±s)

表2 3组研究对象HBcrAg表达比较(±s)Table 2 Comparison of the expression of HBcrAg among three groups(x±s)
注:F=49.87,P<0.05
CHB组1.14±0.23 HBcrAg(ng/mL)健康对照组0.47±0.09 0BI组0.92±0.13
2.4 OBI 组HBcrAg 与HBeAb、HBcAb、ALT、HBV DNA的相关性
HBcrAg 与HBeAb、HBcAb、ALT、HBV DNA 无相关性(P>0.05),见表3。
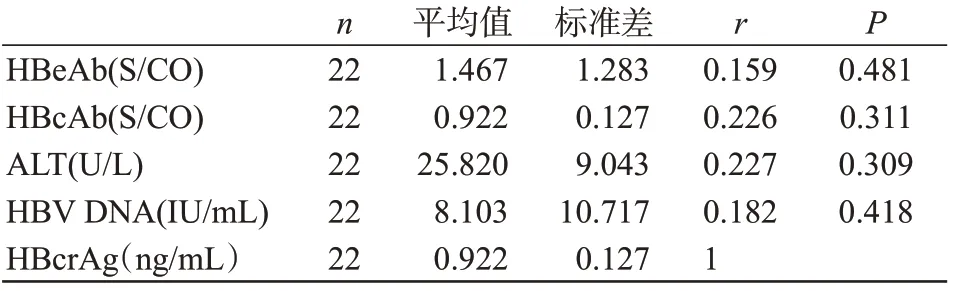
表3 OBI 组HBcrAg 与HBeAb、HBcAb、ALT、HBV DNA的相关性Table 3 Correlation between HBcrAg and HBeAb, HBcAb,ALT,and HBV DNA in the OBI group
3 讨论
血清HBV DNA 水平易受抗病毒药物,特别是核苷(酸)类似物抗HBV 药物的影响,不能很好地反映肝内HBV 的复制情况[8],新型血清标志物HBcrAg不但可避免反复肝脏穿刺取材检测cccDNA的风险与繁琐及被检者的痛苦,而且能反映整合HBV DNA 的转录活性,是反映肝内HBV cccDNA水平的较好替代指标,其准确性优于血清HBV DNA和HBsAg水平[9]。唐红等[10]曾对139例接受肝活组织检查的慢乙肝患者血清中HBcrAg、HBsAg、HBV DNA和肝内cccDNA的水平进行检测,发现血清HBcrAg水平与肝内HBV cccDNA水平呈显著相关(r=0.929,P<0.05),且这一相关性明显优于HBsAg(r=0.742,P<0.05) 和HBV DNA(r=0.854,P<0.05)。由于cccDNA 主要存在于肝细胞核中,当肝细胞受到严重损害时,才释放到血液中,血清中微乎其微,几乎检测不到,因此临床上采取检测肝活组织的cccDNA 的含量才能准确评估患者HBV 的复制程度和制定相应的诊疗方案。本研究中的22例OBI 虽然检测HBV DNA 有反应性,但病毒载量不高,不足以严重损害肝细胞,其释放于血清的cccDNA极低,目前检测技术尚未能检测到其含量,故未做血清HBcrAg 与肝活组织HBV cccDNA 之间的相关性研究。
本研究中的3 组研究对象HBcrAg 水平依次为:CHB 组>OBI 组>健康对照组。推测其原因,是由于HBV cccDNA即使量很少,在慢性乙型肝炎中通常只占肝内HBV DNA 总量的1%以下[11],却可以十分稳定地存在,目前临床广泛使用的核苷(酸)类似物抗HBV药物对其没有直接抑制作用。采供血机构筛查出的HBsAg-/HBV DNA+感染者都是未使用过核苷(酸)类似物的自然人,其潜在的cccDNA完整的保留在肝细胞中,但并不是所有的受血者都会发生HBV感染,宿主的免疫功能、输血量和患者的病毒载量会影响其发生率[12]。临床上78%的接受抗病毒治疗的患者经常无法检测到血清HBV DNA,却可检测到血清HBcrAg[13],其原因是cccDNA的稳定存在,也是导致隐匿性肝炎再激活的主要原因之一。
西方等发达国家HBV 的流行率低,大多采用联合HBsAg 与抗-HBc 或HBV 核酸检测的方法来筛查献血者,输血后肝炎发生率非常低[14]。本研究中OBI 组HBcAb 检出率为86.36%,提示我们可以将HBcAb和HBsAg同时做为筛查献血者的血清指标。另外,HBeAb 是感染者血液中HBV 复制受到抑制而表现出乙肝病毒减少,可以出现在慢性乙肝患者和无症状HBsAg 携带者。我们对22 名HBsAg-/HBV DNA+感染者的HBcrAg 与其HBeAb、HBcAb、ALT、HBV DNA 等血清学检测指标进行相关性分析的结果表明HBcrAg与上述指标之间无相关性。其原因是本研究仅为本中心小样本的追踪性实验,追踪的数量和时间有限,需要在今后研究中扩大样本量并且联合多中心进行针对不同年龄、不同病程的OBI 感染者对其拉长持续追踪的时间和增加次数,动态了解HBsAg-/HBV DNA+人群的HBcrAg 表达水平,才能更充分体现出血清HBcrAg水平在筛查HBsAg-/HBV DNA+人群的优越性,最大限度降低输血HBV残余风险。
虽然试验用的是传统的酶联免疫吸附法检测血清HBcrAg 水平,但这与目前我国血站检测HBsAg 的方法一致,且目前很少有文献报道此方法检测血清HBcrAg 水平与HBsAg-/HBV DNA+献血者的相关性,这是本研究的创新点之一。综上所述,新型血清标志物血清HBcrAg在本研究中对筛查出HBsAg-/HBV DNA+感染者有一定的影响和应用前景,在一定程度上可反映肝细胞中的cccDNA 的存在水平。

