胃癌晚期患者CYP3A5*3基因多态性与阿帕替尼单药治疗不良反应的相关性研究
孟安娜,李 杨(南京医科大学附属南京医院/南京市第一医院药学部,南京 210006)
阿帕替尼是我国自主研制的小分子血管内皮生长因子受体-酪氨酸激酶抑制剂,通过竞争细胞内血管内皮细胞生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的ATP 结合位点,抑制肿瘤组织新生血管的生成,发挥抗肿瘤作用[1]。临床研究发现,阿帕替尼三线治疗晚期胃癌可明显延长患者的中位无进展生存期和中位总生存期[2]。
阿帕替尼在体内代谢广泛,细胞色素P450 3A4(CYP3A4)和细胞色素P450 3A5(CYP3A5)为其主要代谢酶。文献[3]报道中国人已发现的CYP3A4等位基因突变频率为0.5%~3.1%,CYP3A5*3 的基因多态性发生率为71%~76%。目前阿帕替尼所致不良反应与基因多态性的研究主要集中在VEGFR2 多态性方面[4-7],CYP3A5*3基因多态性与阿帕替尼不良反应的关系报道较少[8-9]。鉴于此,本研究拟探索CYP3A5*3基因多态性与胃癌晚期患者阿帕替尼单药治疗所致不良反应的相关性,以期为临床安全使用阿帕替尼提供参考。
1 材料与方法
1.1 研究对象 本研究为回顾性研究,收集2020年1月~2022年6月就诊于南京市第一医院接受阿帕替尼单药治疗的胃癌晚期患者86 例。入组标准:①组织学或病理学确诊为晚期胃癌;②既往未服用过阿帕替尼且本研究中接受阿帕替尼单药治疗。排除标准:①服药前两周内及服药期间使用影响CYP3A 肝药酶活性药物的患者;②其他各项检查指标不符合入组标准的情况,如治疗前存在蛋白尿、高血压等。所有入组患者服用阿帕替尼的剂量均为500mg,每日一次。记录入组患者的一般人口学资料,包括年龄、性别、身高、体重、烟酒史、服药史等。本研究经医院伦理委员会审核通过,所有患者治疗前均签署知情同意书。
1.2 试剂与仪器 血液基因组DNA 提取试剂盒、NDA Marker(天根生化科技有限公司);PCR Buffer,dNTP,DNA MarkerTaqDNA 聚合酶、CYP3A5*3 引物和测序引物(上海生工生物工程公司);9700 型PCR 仪、ABI 3730XL 型测序仪(美国ABI公司)。
1.3 研究方法
1.3.1 样本采集和CYP3A5*3 基因型检测:患者每日口服阿帕替尼500mg,第6 天早晨抽取患者静脉血2ml,置EDTA 抗凝管中,抽提血样基因组DNA,置-80℃冰箱保存待用。CYP3A5*3 的多态性使用PCR-RFLP 法检测。根据CYP3A5*3 基因目标序列及多态性位点,设计合成上游引物:5’-CATGACTTAGTAGACAGATGAC-3’;下游引物:5’-GGTCCAAACAGGGAAGAAATA-3’。使用PCR仪进行扩增,具体为:95℃预变性2 min,95℃变性20s,55℃退火20s,72℃延伸30s,最后72℃延伸10min,共35 个循环。PCR 扩增产物大小293bp,设计测序引物:5’-CTTCAATTTTTCACTG ACCTAATATTC-3’,纯化后使用3730XL 测序仪单向测序,利用Chromas 软件与Genebank 中的序列比对验证患者的基因型。
1.3.2 随访和不良反应评价:查阅纳入研究患者住院期间不良反应的发生情况、严重程度及出院期间每周的电话随访结果。随访内容包括患者每周血细胞检测、尿常规检查、每2 周生化检查及血压等监测结果。根据广东省药学会推荐的方法评价阿帕替尼与不良反应的相关性,同时根据美国国立癌症研究所常见不良反应事件评价标准对不良反应的严重程度进行分级[10-11]。患者住院及随访期间出现的不良反应参照药品说明书进行处置,具体包括暂停服药、对症治疗和/或减量直至永久停用阿帕替尼等。本研究的末次随访时间为2022年11月。
1.4 统计学分析 使用SPSS26.0 统计软件对数据进行分析处理。基因型分布采用Hardy-Weinberg 遗传平衡定律(HWE)检验;不同基因型之间的组间基线特征,不良反应发生率的比较采用χ2检验;检验水准α 取0.05,P<0.05 为差异有统计学意义。
2 结果
2.1 入组患者CYP3A5*3 基因型检测情况 CYP3A5*3位点有A 和G 两种等位基因,纳入研究的86 例患者中,根据PCR-RFLP 和直接测序法确定野生型患者(AA 型)6 例,突变杂合子型患者(AG 型)29例,突变纯合子型患者(GG 型)51 例,突变型占比93.02%。A,G 等位基因的频率分别为23.84%和76.16%,分布符合HWE 遗传平衡(χ2=0.414,P=0.813)。
2.2 CYP3A5*3基因多态性与入组患者基线资料 见表1。入组患者按照性别、年龄和体力评分进行分层,不同基因型患者临床基础资料比较差异均无统计学意义(P>0.05)。
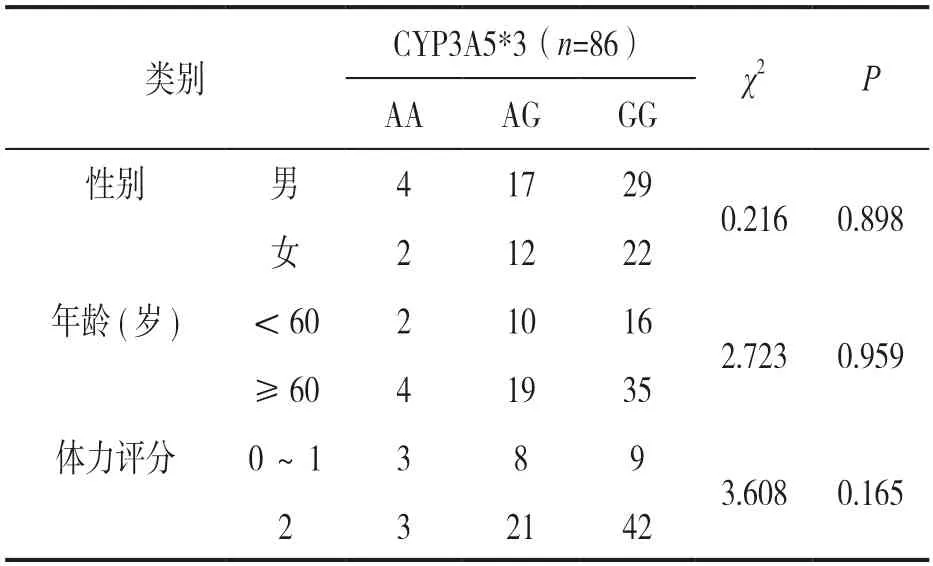
表1 CYP3A5*3基因多态性与患者基线资料分析
2.3 CYP3A5*3基因多态性与阿帕替尼不良反应的关系分析 见表2。86 例入组患者中,对治疗和随访期间出现的不良反应及其严重程度进行记录,使用卡方检验,结果显示GG 基因型患者阿帕替尼所致的高血压和白细胞减少不良反应发生率明显高于AA+AG 基因型,差异具有统计学意义(χ2=6.154,6.947,均P<0.05)。

表2 不同CYP3A5*3基因多态性与阿帕替尼不良反应的比较分析
2.4 CYP3A5*3基因多态性与阿帕替尼所致严重不良反应的关系分析 见表3。纳入研究的患者共计28 人次出现严重不良反应(III~IV 级),包括血液学不良反应9 人次,非血液学不良反应19 人次。统计学未发现CYP3A5*3 基因型与III~IV 级不良反应存在相关性(P>0.05)。
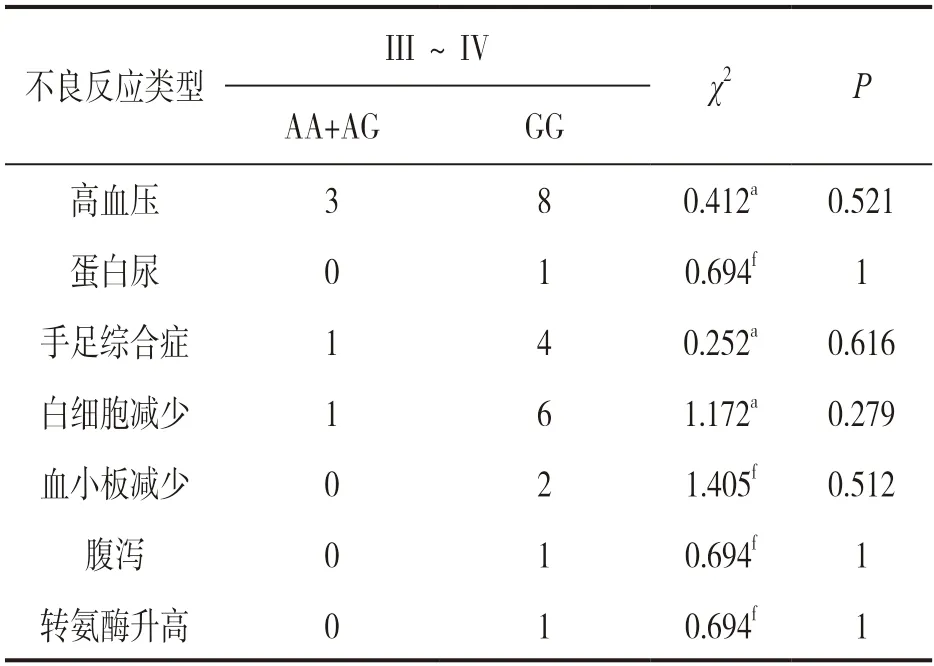
表3 不同CYP3A5*3基因多态性与阿帕替尼严重不良反应的比较分析
2.5 纳入研究患者不良反应的处置和结局 患者治疗期间发生的不良反应根据严重程度参考药品说明书处置。I~II 级不良反应无需停药。III~IV 级不良反应均暂停服药,对于多次出现的III 级或首次出现的IV 级不良反应,后续均下调一个剂量服药。
本研究中,2 例患者出现IV 级白细胞减少,在暂停用药的基础上对症治疗后予减量阿帕替尼至250mg 治疗。2 例患者出现IV 级高血压不良反应,减量后仍反复出现III 级不良反应,最终停药。其余患者在采取暂停服药、对症治疗和/或降低一个服药剂量后不良反应均不同程度缓解。
3 讨论
晚期胃癌整体预后不佳,传统化疗药物进入瓶颈期,免疫治疗单药在整体人群中疗效不佳,靶向药物选择有限。研究显示阿帕替尼三线及以上治疗晚期胃癌,较安慰剂组可以明显延长患者的中位无进展生存期、提高疾病控制率[2]。晚期胃癌的治疗目标为提高患者生活质量、延长生存时间,接受阿帕替尼三线及以上治疗的患者体力评分和/或脏器功能均可能出现一定程度的下降,因此阿帕替尼治疗前进行疗效和/或不良反应的预测具有较大意义。
基因多态性是预测治疗药物疗效和/或不良反应的方法之一。目前预测阿帕替尼疗效和/或不良反应的研究主要集中在VEGFR2 和CYP450 多态性方面。研究发现,阿帕替尼在晚期非小细胞肺癌患者后线治疗中VEGFR2-906T >C 位点CC/TC 基因型患者疗效较差,未发现-906T >C 位点和不良反应的相关性[5]。有研究报道,阿帕替尼治疗肝细胞癌的不良反应中,蛋白尿可以潜在地预测更好的无进展生存期,腹泻是总生存期的潜在预测因子,高血压是无进展生存期和总生存期的潜在预测因子[12]。
CYP3A4 和CYP3A5 是阿帕替尼代谢的主要肝药酶,鉴于CYP3A4 在中国人群中报道突变频率较低,因此本研究未检测患者CYP3A4 的基因多态性[13]。CYP3A5 基因多态性分布有着明显的种族和地域差异。NEYSHABURINEZHAD 等[14]报道,在高加索人中,CYP3A5*3 突变频率为95.5%;黑种人,CYP3A5*3 的突变频率为57.3%。平军娇等[15]人的研究中纳入155 例患者,CYP3A5*3 杂合突变型A/G 占36.8%,纯合突变型G/G 占比51.6%。本研究中,杂合突变型占比33.7%,纯合突变型占比59.3%,与平军娇等[15]人的研究结果基本一致。
研究发现,阿帕替尼常见的不良反应包括高血压、蛋白尿和白细胞减少等[2]。目前关于CYP3A5*3基因多态性与阿帕替尼不良反应的相关研究较少,石瑶瑶[9]的报道未发现CYP3A5*3基因多态性与阿帕替尼所致严重不良反应之间的相关性。本研究发现CYP3A5*3 纯合突变型患者阿帕替尼所致的高血压发生率明显高于野生型和杂合子突变型,未发现阿帕替尼所致的严重不良反应与CYP3A5*3 基因型的相关性,结果与石瑶瑶[9]的研究一致。LI 等[16]的研究报道,阿帕替尼治疗组患者严重不良反应的发生率约69.3%,高于本研究的32.6%,可能与其研究的设计类型及入组患者服用更大剂量的阿帕替尼有关。
范芳等[17]人的研究发现,阿帕替尼III~IV级严重不良反应的发生率随着用药剂量的增加而增加,但血药浓度可能不是疗效和不良反应的预测指标,推测影响阿帕替尼不良反应的因素较多,此外也与该研究入组的阿帕替尼单药治疗患者人数较少有一定关系。鉴于高血压是胃癌患者接受阿帕替尼治疗最常见的不良反应之一,且多项研究发现老年患者血压升高可能导致可逆性的后脑白质脑病综合征[18]和缺血性脑卒中[19],因此,开始治疗前检测患者CYP3A5*3 的基因型对预测高血压不良反应的发生风险尤其对并发有高血压基础疾病的群体具有一定指导意义。对于并发高血压的群体应控制血压低于150mmHg/100mmHg 再启动治疗,从而降低高血压的发生风险。
白细胞减低为阿帕替尼较常见的不良反应,不同研究报道其发生率约22.9%~33.3%[20-21]。本研究发现CYP3A5*3 GG 基因型患者白细胞减少的发生率明显高于AA+AG 型患者。考虑患者通常需服用阿帕替尼直至疾病进展或出现不可耐受的不良反应,因此在用药前进行CYP3A5*3 基因型检测对安全用药具有较大参考价值。此外,蛋白尿亦为阿帕替尼的常见不良反应,治疗期间应密切监测患者的血压、三大常规等指标;加强对患者的用药监护和不良反应宣教;提高患者对不良反应的早期识别。对于治疗期间出现严重不良反应的患者需及时停药,根据后续不良反应的严重情况采取减量、对症治疗直至永久停药等处理措施,保障患者治疗的安全性和有效性。
总之,本研究初步探索了CYP3A5*3基因多态性与胃癌晚期患者阿帕替尼单药治疗所致不良反应的关系,对临床安全、合理使用阿帕替尼具有一定指导意义。本研究亦存在一定局限性,首先样本量为86 例,可能存在抽样误差;其次,未考察不同基因型患者服用阿帕替尼的疗效有无差异;第三,阿帕替尼在体内的代谢过程较为复杂,与患者个体的其他因素可能也有关系,值得今后对多种遗传多态性进行前瞻性的研究加以验证。

