基于生物信息学构建膀胱尿路上皮癌的ceRNA网络以及关键mRNA与免疫功能分析
邵 波,汪 进,万 水,吴开秀,田 申,杜沂宸,陈丹霞,马园园(.安徽中医药大学附属芜湖市中医医院专业学位硕士研究生培养基地,安徽芜湖 2400;2.安徽中医药高等专科学校附属医院/芜湖市中医医院a.泌尿外科;b.皮肤科;c.肛肠科,安徽芜湖 2400;.昆明医科大学海源学院,昆明 65006)
膀胱癌是以间歇性、全程性、无痛性肉眼血尿为特征的泌尿系恶性肿瘤,常伴尿频、尿急、尿痛等下尿路刺激症状。据统计,其病理分型80%以上属膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA),且发病率、死亡率均逐年上升[1],严重威胁着中老年人群的身心健康。BLCA 发病机制复杂,与遗传、基因、生活等因素密切相关,目前其仅能通过症状及影像学对已发生癌性组织学改变者进行初步诊断,而对无组织学改变的癌前状态的高风险患者却无明确检测手段,且对明确诊断者除手术外无其他有效治疗手段。因此,BLCA 诊断物的挖掘、病变过程中关键基因的鉴定以及针对基因的免疫治疗是需要重点解决的问题。近年来基因组学的发展和芯片检测的广泛应用积累了海量的表达谱数据,而生物信息学分析能挖掘出疾病的关键靶点。因此,本研究设计采用生物信息学的方法,筛选BLCA 的关键信使核糖核酸(messenger RNA,mRNA)、微小核糖核酸(micro RNA,miRNA)及长链非编码核糖核酸(long noncoding RNA,LncRNA),并针对mRNA 探究其与免疫功能的相关性,以期寻找可以预测和治疗BLAC 的生物学靶点及免疫治疗方向,为BLAC 进展的调控机制提供理论依据。
1 材料与方法
1.1 资料来源 UCSC Xena 数据库(https://xena.ucsc.edu)下载404 例BLCA 患者及28 例正常人的mRNA 表达数据和临床数据用于mRNA 筛选,GEPIA 数据库(http://gepia.cancer-pku.cn/)的702 例肿瘤患者及103 例正常人的基因表达量数据用于关键mRNA 的验证,miRNA 和LncRNA 表达数据通过TCGA数据库(https://portal.gdc.cancer.gov)下载,免疫数据来源于TIMER 2.0 数据库(http://timer.cistrome.org/)。研究资料来源于公开的科研数据库,无需医学伦理学审查。
1.2 内源竞争性RNA(competing endogenous RNA,ceRNA)网络关键基因筛选
1.2.1 筛选关键mRNA:使用R 软件,设置参数“|logFC|>1”且“fdr <0.05”对正常人和肿瘤患者进行mRNA 表达量的差异分析,筛选关键mRNA,设置参数“KM-Pvalue<0.05”且“Cox-Pvalue<0.05”且“HR >1”对关键mRNA 的高低表达组进行生存差异分析,将GEPIA 数据库数据以相同方式进行生存差异分析验证关键mRNA。
1.2.2 筛选关键miRNA:于ENCORI 数据库中,设置参数“Human”且“programNum ≥2”且“target=关键mRNA”,查找与关键mRNA 相结合的所有miRNA。使用R软件,设置参数“Cor<-0.2”且“Pvalue<0.05”进行关键mRNA 与所有miRNA 的共表达分析以筛选关键miRNA,关键miRNA 高低表达组的生存差异分析参数设置与关键mRNA 一致。
1.2.3 筛选关键LncRNA:于ENCORI 数据库中,设置参数“miRNA=关键miRNA”且“target=all”,筛选出与关键miRNA 具有靶向关系的所有LncRNA。使用R 软件,设置参数“Cor <0”且“logFC >0”且“Pvalue <0.05”进行miRAN 与LncRNA 的共表达分析以筛选关键LncRNA,关键LncRNA 高低表达组的生存差异分析参数设置与关键mRNA 一致。
1.3 ceRNA 网络构建 根据ceRNA 的假设,miRNA 结合mRNA 使其沉默,LncRNA 可以通过竞争性结合miRNA 来影响基因沉默而充当mRNA的协同基因,因此miRNA 与LncRNA 之间存在反比关系,而mRNA 与LncRNA 之间为正相关关系。以此为基础,将筛选出的关键mRNA,miRNA 和LncRNA 用于构建ceRNA 调控网络。
1.4 关键mRNA 与免疫功能分析 通过TIMER 2.0数据库分析关键mRNA 表达量与免疫细胞含量及免疫检查点(CD274,PDCD1,CTLA4)的相关度,R 软件包分析关键mRNA 与上述免疫细胞的免疫细胞标记基因(immunomarker genes,IG)的相关度,P<0.05 为差异具有统计学意义。
2 结果
2.1 关键mRAN 的筛选和分析结果 筛选出BLCA 的保护性基因共5 个,高风险基因共17 个,其中相关度最高的高风险基因为脯氨酸3-羟化酶家族成员4(proline 3-hydroxylase 4,P3H4),该基因在肿瘤患者中呈高表达,表达量越高,生存时间越短,见图1,图2。GEPIA 数据库验证显示,P3H4高低表达组之间的生存率比较差异具有统计学意义(P=1.2e-09 <0.05),与图2 结果一致,表明P3H4可作为高风险基因进行下一步研究。

图1 mRNA 肿瘤患者与正常人表达量差异分析图

图2 mRNA 高低表达组的生存分析图
2.2 关键miRAN 的筛选和分析结果 ENCORI 数据库筛选出与P3H4 相结合的miRNA 共33 个。共表达分析筛选出关键miRNA 为hsa-miR-151a-3p,该基因在肿瘤患者中表达量显著低于正常患者,见图3,图4。高低表达组生存分析提示,hsa-miR-151a-3p 高表达的患者生存时间更长,上述分析差异具有统计学意义(均P<0.05)。

图3 P3H4 与hsa-miR-151a-3p 表达量相关性图

图4 hsa-miR-151a-3p 肿瘤患者与正常人的表达量差异图
2.3 关键LncRAN 的筛选和分析结果 ENCORI 数据库筛选出与关键miRNA 结合的LncRNA 共14 个,共表达分析筛选出关键LncRNA 为MIR100HG,该基因与P3H4 呈正相关,见图5。与hsa-miR-151a-3p 呈负相关,见图6。MIR100HG 高表达时BLCA患者生存率高,见图7。上述分析差异具有统计学意义(均P<0.001)。

图5 MIR100HG 与P3H4 表达量的相关性图
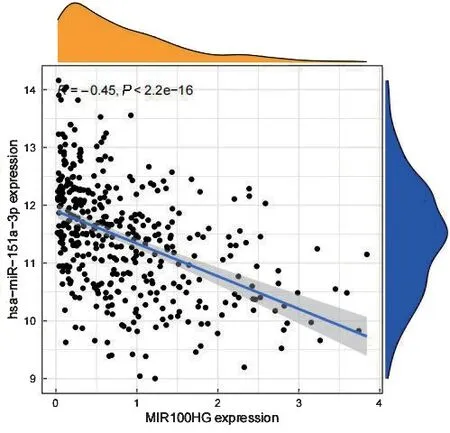
图6 MIR100HG 与hsa-miR-151a-3p表达量的相关性图

图7 MIR100HG 高低表达组生存时间差异图
2.4 ceRNA 网络构建 见图8。根据上述筛选结果及ceRNA 理论的假设,我们构建了一个mRNAmiRNA-LncRNA 的三重调控网络。

图8 ceRNA 调控网络示意图
2.5 mRNA 与免疫功能分析 见表1。相关度分析显示,P3H4 表达量与CD8+T 细胞、肿瘤相关性中性粒细胞(tumor-associated neutrophil,TAN)、肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)和树突状细胞(dendritic cell,DC)含量呈正相关。R 软件筛选出IG 共15 个,其中14 个与P3H4 呈正相关,1 个呈负相关。免疫检查点的分析中,P3H4 与CD274,PDCD1 和CTLA4 均呈正相关,差异具有统计学意义(均P<0.01)。

表1 P3H4 与IG 表达量的相关度
3 讨论
膀胱尿路上皮癌(BLCA)发病机制复杂,与包括基因在内的多种因素密切相关[2]。目前BLCA 的治疗以手术、放化疗为主,但其副作用大、复发率高。近年来,为了寻求更加有效、安全的诊疗方式,越来越多的学者开始从基因入手,力求实现癌前状态检测和免疫调控以达到诊疗目的,而内源竞争性RNA(ceRNA)[3]作为一种调控机制,在肿瘤发生发展和免疫治疗中占有重要地位。通过生物信息学探究BLCA 的ceRNA 网络机制,并分析关键mRNA与免疫功能的关系,为阐明其发病机制、癌前检测及免疫治疗提供一种新的思路。
3.1 ceRNA 调控网络 本研究构建的ceRNA 调控网络为(P3H4)-(hsa-miR-151a-3p)-(MIR100HG)。P3H4属脯氨酰3-羟化酶(prolyl 3-hydroxylase,P3H)家族成员,有研究表明,P3H4 在泌尿系肿瘤中通常呈现高表达,其可促进自身抗原的形成,而泌尿系肿瘤的发生又与自身免疫破坏密切相关[4],从而促进肿瘤的发生发展,这与本次研究相一致,提示了P3H4 成为BLCA 预后标志物的可能。hsamiR-151a-3p 属于新型基因,目前对该基因的研究较少,其表达可能与多种肿瘤密切相关[5],如高表达的miR-151a-3p 在肝癌、胰腺癌、肺癌等中作为致癌基因,而在乳腺癌中,其高表达时通过调控TWIST1 基因以限制肿瘤的发生发展。目前关于其对泌尿系肿瘤影响效果的报道较少,少数实验表明,其通过负调控肿瘤高风险基因从而达到抑制肿瘤发生发展的作用[6]。MIR100H 是11 号染色体上miR-100,let-7a-2 和miR-125b-1 簇的宿主基因,有研究[7]结果显示,MIR100H 基因可通过对HNRNPA2B1基因的下调从而抑制BLCA 的进展、转移。本次研究结果提示,MIR100H 与高风险基因P3H4 的表达虽然存在协同关系,但其对患者生存的影响却背道而驰。综合分析结果推测,MIR100H 对BLCA 的发展可产生双向调节作用,一方面作为ceRNA 网络中的关键LncRNA,促进BLCA 的发生发展,另一方面又通过对HNRNPA2B1 等高风险基因的下调而充当保护性基因的角色,但总体对BLCA 患者的生存有益。
根据本次研究所得,生理情况下,hsa-miR-151a-3p 同时与P3H4 及MIR100HG 相结合以调控基因表达,当BLCA 发生时,hsa-miR-151a-3p 基因下调,降低了对高风险基因P3H4 的结合作用,同时MIR100HG 呈现高表达而进一步结合hsa-miR-151a-3p,使hsa-miR-151a-3p 对P3H4 的结合作用进一步降低,导致了BLCA 的发生发展。由此可得,治疗BLCA 时,可考虑下调P3H4 表达,上调hsamiR-151a-3p,对于MIR100H,在上调其表达的同时需打断其与hsa-miR-151a-3p 的结合过程,由此对BLCA 的治疗可产生更好的效果。
3.2 免疫功能分析 本研究发现,P3H4 表达与TAN,DC,TAMs,CD8+T 细胞等免疫细胞含量及其相应IG 密切相关。
3.2.1 TAN 及其所属IG 对BLCA 的作用分析:当前研究表明,TAN 对肿瘤细胞的调节作用是双向的,一方面分泌活性氧、髓过氧化物酶等细胞毒介质产生细胞毒作用杀伤肿瘤细胞;另一方面,又合成释放弹性蛋白酶[8]、生成的外诱捕网(neutrophil extracellular traps,NETs)[9]等方式促进肿瘤新生血管生成,介导参与肿瘤细胞增殖、侵袭和免疫耐受。本次研究结果中,标记基因ITGAM 与CCR7 呈现高表达,ITGAM[10]与ICAM-1 互作可介导NETs 形成,CCR7[11]可诱导TAN 向淋巴结的迁移,两者均介导BLCA 肿瘤微环境TAN 的促肿瘤效应,而与肿瘤细胞杀伤作用相关的IG 表达量未见上调,由此得出TAN 在BLCA 肿瘤微环境中的作用是促进肿瘤发展、介导免疫耐受。有研究表明,TAN 绝对值低与免疫治疗效果呈正相关,且肿瘤微环境中TAN 含量高,往往提示预后不良[12],这与本研究所得结果一致。
3.2.2 DC 及其所属IG 对BLCA 的作用分析:树突状细胞(dendritic cells,DC)是专职抗原递呈细胞,分为经典树突状细胞(classical dendritic cells,cDC)和浆细胞样树突状细胞(plasmacytoid dendritic cells,pDC),cDC 可激发T 细胞免疫应答并促进T 细胞依赖性抗体生成[13],而肿瘤微环境中的pDC 由于功能失调,表达PD-L1 及端粒酶B直接抑制T 细胞应答,同时TNF-α 和IL-8 分泌增加促进血管生成等方式促进耐受和侵袭[14]。本研究得到高表达的IG 包括HLA-DPB1,HLA-DQB1,HLA-DRA,HLA-DPA1,ITGAX 和NRP1,前四者主要参与cDC 的抗原呈递过程,可增强免疫杀伤效果,发挥抗肿瘤效应。但由于肿瘤微环境中pDC占主要地位,对pDC 发挥重要效应的高表达IG 为ITGAX 和NRP1,而ITGAX 的上调常导致IL-12,IL-23 和TNF-α 等在pDC 的表达而表现促肿瘤效应[15],NRP1 在pDC 中的高表达效应亦是如此[16]。由此可见,DC 细胞在BLCA 肿瘤微环境中主要为pDC,且由于ITGAX 和NRP1 的高表达而具有促进肿瘤发生发展重要效应。
3.2.3 肿瘤相关巨噬细胞(TAMs)及其所属IG 对BLCA 的作用分析:TAMs 是肿瘤免疫治疗的良好效应者。肿瘤微环境中各种因素的影响下,TAMs分化为抗肿瘤巨噬细胞(M1)和促肿瘤巨噬细胞(M2)两种类型。M1 巨噬细胞代表“经典的”活化巨噬细胞,可发挥抗炎、抗肿瘤特性;M2 巨噬细胞则不仅抑制T 细胞攻击肿瘤细胞,而且还可引起肿瘤细胞增殖和免疫逃逸[17]。结合我们在BLCA 肿瘤微环境中发现的可得,包括PTGS2[18],CD163[19],VSIG4[20],MS4A4A[21]在内的四个TAMs相关的IG 呈现高表达,干扰素调节因子5(IRF5)则为低表达。前四者高表达可诱导TAMs 的M2 型极化,IRF5[22]则诱导TAMs 的M1 型极化。M2 型极化基因的高表达、M1 型极化基因的低表达,表明了BLCA 微环境中,TAMs 以M2 型为主,起着重要的促肿瘤效应。
3.2.4 CD8+T 细胞及其所属IG 对BLCA 的作用分析:CD8+T 细胞介导人体特异性细胞免疫,可直接杀伤肿瘤细胞作用,延迟肿瘤的生长以及延长患者的生存期[23]。本研究所得CD8+T 细胞所属IG 包括CD8B 和CD4,两者均属于T 细胞抗原受体(T cell receptor,TCR)的共受体。传统观念认为,幼稚T 细胞分别表达CD8 或CD4 基因而发展为成熟的CD8+T 细胞或CD4+T 细胞,CD8 与CD4 具有排斥性而仅能发展为单阳性T 细胞。但根据我们所得,发现在BLCA 患者肿瘤微环境中,CD8+T 细胞表面同时存在CD8B 和CD4 的高表达,推测CD8+T 细胞由于微环境中抗原刺激,激活了CD4 基因而转化为双阳性T 细胞。有研究[24]表明,双阳性T 细胞在体外实验中对肿瘤细胞较单阳性T 细胞有更强的杀伤能力,但其由单阳性转化为双阳性的机制暂未能阐述。由于双阳性T 细胞目前暂未在肿瘤组织以外的地方发现,故其或许可成为肿瘤诊断的标志物,同时也可称为免疫治疗的新手段。
3.2.5 免疫检查点对BLCA 作用机制:免疫检查点是传递免疫负反馈抑制信号的分子,常常介导细胞的免疫耐受[26]。本次研究得出与P3H4 呈正相关的免疫检查点有CD274,PDCD1,CTLA4。CD274又称程序性死亡配体1,PDCD1 又称为程序性死亡受体1,两者属于配受体关系,二者结合便可向T淋巴细胞传递负向调控信号,导致T 细胞进入休眠状态[27]。CTLA4 分子[28]位于T 淋巴细胞表面,其可与免疫刺激分子CD28 竞争性结合配体B7,降低CD28 作用的同时向T 淋巴细胞传递抑制性免疫信号,导致肿瘤免疫耐受[29]。P3H4 可上调上述免疫检查点的分子表达,提示P3H4 可能具有潜在的肿瘤免疫抑制功能,参与抗肿瘤免疫调节信号通路的负反馈调节,从而促进BLCA 的发生发展,且预后不良。基于免疫检查点特性,上述检查点或可成为BLCA 免疫治疗的靶点。
本文通过构建ceRNA 调控网络阐述了BLCA的发病原理,同时分析了P3H4 与肿瘤微环境免疫机制的关系,为BLCA 的诊断、治疗、预后提供了参考线索。但本次研究仅限于对海量数据的挖掘,虽具现实意义,但缺乏体外实验证据,我们将进一步完善该项研究,以提高本研究的可靠性。

