基于生物信息学分析双硫死亡相关基因PDLIM1 mRNA在多种肿瘤中的表达及临床应用价值
刁 迅,范绮雨,耿良栋,刘继斌,朱卫华(.南通大学附属肿瘤医院,江苏南通 6006;.南通大学附属医院普外科,江苏南通 600)
双硫死亡(disulfidptosis)是新发现的一种因二硫化物应激诱导的细胞死亡的机制,与已知的细胞死亡机制不同,它与肌动蛋白细胞骨架有关[1]。PDZ 和LIM 域蛋白1(PDZ and LIM domain protein 1,PDLIM1)是人PDZ-LIM 蛋白家族的成员之一,又名(CLIM1)或CLP36,是一种细胞骨架蛋白[2]。它可作为衔接分子,介导包括信号转导在内的蛋白质与细胞骨架相互作用[3]。尽管PDLIM1 与肿瘤[4-6]之间的关系得到广泛的关注,但其在免疫微环境和作用机制等方面的作用仍不清楚。因此本研究拟通过生物信息学分析PDLIM1 在表达水平、诊断、预后、免疫浸润、基因富集及药物敏感性等方面的情况。以期找到一种新的肿瘤诊断和预后生物标志物或治疗靶点,作为个性化患者治疗的基础。
1 材料与方法
1.1 数据来源 本研究中肿瘤的PDLIM1 RNAseq数据主要为美国加州大学圣克鲁兹分校(US University of California Sant Cruz,UCSC )XENA(https://xenabrowser.net/datapages/)经Toil 流程统一处理的TPM 格式的RNAseq 数据。部分缺少UCSC 数据的模块将利用癌症基因组图谱(the Cancer Genome Atlas ,TCGA)中数据补充研究内容。数据处理方法:log2(value+1)。所有数据均在线数据库直接获取,不涉及伦理问题。文章中所涉及到的所有肿瘤及其相关缩写:肾上腺皮质癌(adrenocortical carcinoma,ACC),膀胱尿路上皮癌(bladder urothelial carcinoma,BLCA),乳腺浸润癌(breast invasive carcinoma,BRCA),宫颈癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC), 胆管癌(cholangiocarcinoma,CHOL),结肠癌(colon adenocarcinoma,COAD),结直肠癌(colon adenocarcinoma/rectum adenocarcinoma esophageal carcinoma,COADREAD),弥漫性大B 细胞淋巴瘤(lymphoid neoplasm diffuse large b-cell lymphoma,DLBC),食管癌(esophageal carcinoma,ESCA),FFPE 试点二期(FFPE pilot phase II,FPPP),多形性胶质细胞瘤(glioblastoma multiforme,GBM),胶质瘤(glioma,GBMLGG)、头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSC),肾嫌色细胞癌(kidney chromophobe,KICH),混合肾癌(pan-kidney cohort(KICH+KIRC+KIRP),KIPAN),肾透明细胞癌(kidney renal clear cell carcinoma,KIRC),肾乳头状细胞癌(kidney renal papillary cell carcinoma,KIRP),急性髓细胞样白血病(acute myeloid leukemia,LAML),脑低级别胶质瘤(brain lower grade glioma,LGG),肝细胞肝癌(liver hepatocellular carcinoma,LIHC),肺腺癌(lung adenocarcinoma,LUAD),肺鳞癌(lung squamous cell carcinoma,LUSC),间皮瘤(mesothelioma,MESO),卵巢癌(ovarian serous cystadenocarcinoma,OV),胰腺癌(pancreatic adenocarcinoma,PAAD),嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PCPG),前列腺癌(prostate adenocarcinoma,PRAD),直肠腺癌(rectum adenocarcinoma,READ),肉瘤(sarcoma,SARC),胃癌(stomach adenocarcinoma,STAD),黑色素瘤(skin cutaneous melanoma,SKCM),胃和食管癌(stomach and esophageal carcinoma,STES),睾丸癌(testicular germ cell tumors,TGCT),甲状腺癌(thyroid carcinoma,THCA),胸腺癌(thymoma,THYM),子宫内膜癌(uterine corpus endometrial carcinoma,UCEC),子宫肉瘤(uterine carcinosarcoma,UCS),葡萄膜黑色素瘤(uveal melanoma,UVM),骨肉瘤(osteosarcoma,OS),白血病(acute lymphoblastic leukemia,ALL),神经母细胞瘤(neuroblastoma,NB),肾母细胞瘤(high-risk wilms tumor,WT)。
1.2 方法
1.2.1 获取PDLIM1mRNA 的表达情况:利用仙桃学术(https://www.xiantao.love/)中的“[泛癌]分组比较”模块分析PDLIM1 mRNA 在33 种肿瘤中的表达情况。UCSC XENA 数据集中共有18 102 例数据,包括:7 568 例来自GTEx 正常数据、727 例来自TCGA 癌旁数据、9 807 例来自TCGA 肿瘤数据。
使用人类蛋白质图谱(The Human Protein Atlas,HPA)数据库(https://www.proteinatlas.org/)中的“TISSUE”和“PATHOLOG”模块,探究 PDLIM1蛋白在多个肿瘤组织及正常组织中免疫组织化学染色情况(抗体HPA017010)。
1.2.2 探究PDLIM1mRNA 在肿瘤中的诊断能力:利用仙桃学术中的“云诊断ROC”模块绘制受试者工作特征(ROC)曲线探究PDLIM1mRNA 表达在肿瘤中的诊断能力。
1.2.3 探究PDLIM1mRNA 表达与肿瘤患者总生存期的关系:利用Sangerbox 3.0 数据分析平台(http://www.sangerbox.com/) 的单基因“泛癌分析”模块分析在UCSC 数据库中44 种肿瘤中的PDLMI1 与总生存期(overall survival, OS)的关系,参数选择如下:数据来源(TCGA + GTEx),样本量(所有样本(79 630),数据变换[log2(x+1)]。
1.2.4 探究PDLIM1 mRNA 表达与临床分级、分期的相关性:利用TISIDB(an integrated repository portal for tumor-immune system interactions)网站(http://cis.hku.hk/TISIDB/index.php)中的“Clinica”模块对PDLIM1 mRNA 的表达与临床分级和分期的关系进行分析。
1.2.5 探究PDLIM1mRNA 与免疫细胞浸润的相关性:使用Sangerbox 3.0 中的“免疫细胞分析Timer”模块分析PDLIM1mRNA 表达与在38 种肿瘤中与多种免疫细胞之间的相关性,参数选择如下:数据来源(TCGA + GTEx),数据变换[log2(x+1)]。在Kaplan-Meier Plotter(https://kmplot.com/analysis/)的“Immunotherapy”模块中根据PDLIM1mRNA表达水平分组对所有肿瘤病人进行分析,将Sample acquisition:选项设置为Ontreatment 选项,其余保持默认设置。
1.2.6 蛋白质互作网及富集分析:在检索相互作用基因的搜索工具STRING(https://string-db.org/)搜索PDLIM1,筛选置信度得分≥ 0.4 ,获得20 个与PDLIM1 存在互作的蛋白。然后利用Cytoscape(Cytoscape_v3.9.1)软件评分,预测最关键蛋白,并进行基因本体论(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析以确定相关的功能和途径。最后利用基因组癌症分析(Gene Set Cancer Analysis,GSCA)(http://bioinfo.life.hust.edu.cn/GSCA/#/)在癌症治疗反应门户(Cancer Therapeutics Response Portal ,CTRP)数据库中探索PDLIM1 在肿瘤中基因表达与药物敏感性。
1.3 统计学分析 在肿瘤中的表达分析采用的统计方法为Wilcoxon 秩和检验。在与总生存期(overall survival,OS)的分析中使用Logrank test 方法进行分析。与临床参数的相关性分析采用了Logrank test。R 软件包psych(version 2.1.6)的corr.test 函数被用于免疫方面的研究中。P<0.05 为差异具有统计学意义。
2 结果
2.1 PDLIM1mRNA 及蛋白在正常组织及肿瘤组织中的表达分析 通过仙桃在线网站分析PDLIM1mRNA 在33 种肿瘤组织中的表达情况(图1A),发现相对于癌旁组织PDLIM1 mRNA 在大多癌症组织中高表达。在ACC,BRCA,KICH,LAML,LUAD,LUSC,PRAD,SKCM 和UCS中低表达,仅在BLCA,MESO,PCPG,SARC,UCEC 和UVM 中差异无统计学意义(均P>0.05)。
相对于对应的正常组织,PDLIM1 蛋白在子宫颈、肝、卵巢、肾和膀胱的肿瘤组织中表达更高,免疫组织化学染色表现为中等或者高染色。在子宫内膜癌中表达低于对应的正常组织,免疫组织化学染色为未检出(图1B~G),这验证了我们在图1A中的预测。
2.2 PDLIM1 的诊断能力分析 PDLIM1mRNA表达在33 种肿瘤的诊断价值(除CHOL,HNSC,SARC 中的数据来自TCGA,MESO 和OVM数据缺少,其他数据均来自UCSC)。表1所示,PDLIM1 在18 种肿瘤中具有较高的预测能力,尤其是在CHOL,GBM,KIRC,LUAD,OV,PAAD,SKCM 和TGCT 中。
2.3 PDLIM1mRNA 表达与肿瘤患者OS 的关系 本研究旨在分析PDLIM1mRNA 表达水平与44 种肿瘤患者OS 之间的关系。通过对OS 的COX 比例风险模型分析发现PDLIM1mRNA 在7 个肿瘤类型(GBMLGG,LGG,KIPAN,GBM,MESO,UVM和ACC)中高表达预后差,在1 个肿瘤类型(SARC)中低表达预后差(见图2)。

图2 PDLIM1 表达与33 种肿瘤预后的OS 森林图
2.4 PDLIM1mRNA 表达与临床分期、分级的相关性 见图3A~E。PDLIM1mRNA 的表达在5 种肿瘤中与临床分期存在相关性。在HNSC,KIRP 和UCEC 肿瘤中PDLIM1mRNA 的表达和分期呈负相关,在UVM 呈正相关。PDLIM1mRNA 的表达在4种肿瘤中与临床分级存在相关性。在CESC,HNSC和UCEC中PDLIM1mRNA的表达与分级呈负相关,而在LGG 中呈正相关。见图3F~I。
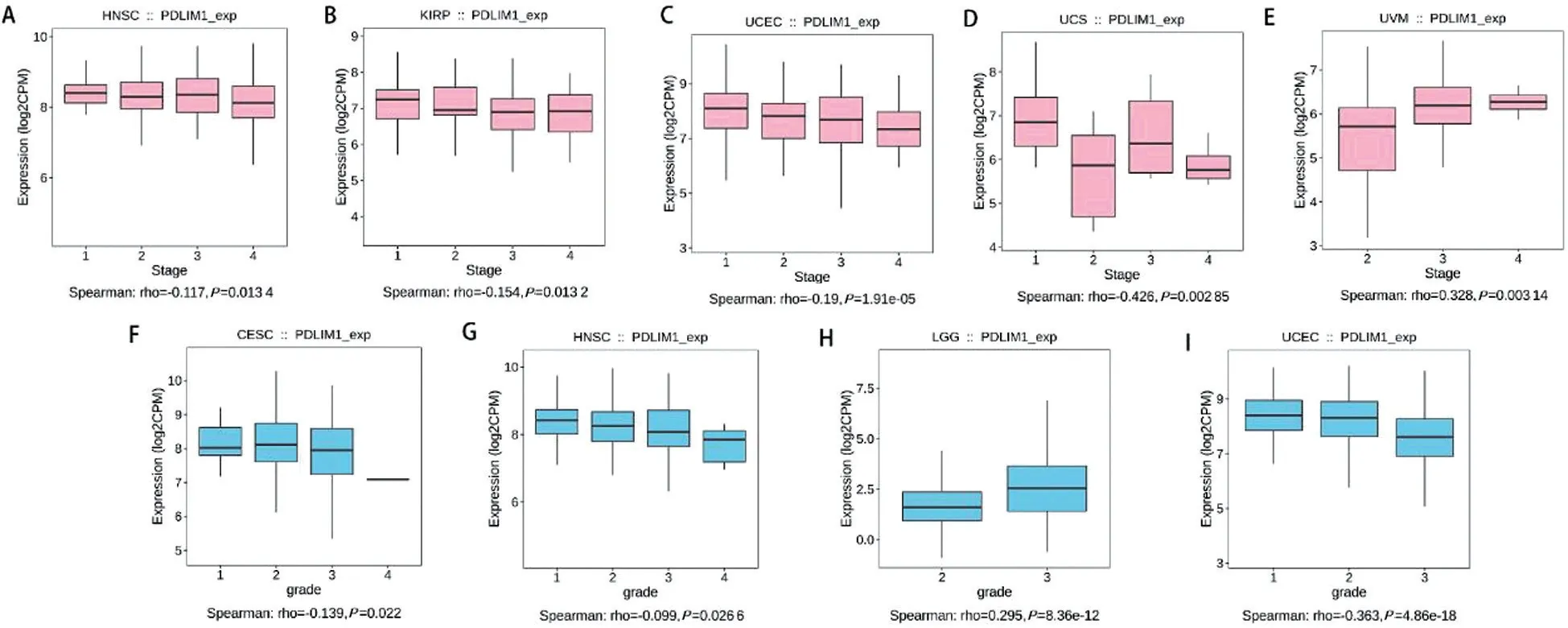
图3 PDLIM1mRNA 与临床分期、分级之间的相关性
2.5 PDLIM1mRNA 表达与肿瘤免疫微环境的相关性 见图4A。研究PDLIM1mRNA 表达与38 种肿瘤类型中9 406 个肿瘤样本的6 类免疫细胞浸润评分(B cell,T cell CD4,T cell CD8,Neutrophil,Macrophage 和DC 浸润评分)。分析发现在36 种肿瘤中PDLIM1mRNA 表达与免疫浸润显著相关。将在获得的免疫治疗的患者以PDLIM1mRNA 表达的中位数分为高低两组,发现PDLIM1mRNA 高表达的患者在经过免疫治疗后具有更好的OS,见图4B。

图4 PDLIM1 mRNA 表达与肿瘤免疫微环境的相关性
2.6 PDLIM1 的相互作用蛋白分析 为进一步阐明PDLIM1 在肿瘤中的生物学功能,利用STRING 共获得20 个与PDLIM1 存在直接相关或间接相互作用的结合蛋白,并构建PPI 网络。使用Cytoscape 计算打分,见图5。发现在构建的PPI 网络中最关键的蛋白是人黏着蛋白(Vinculin,VCL)(Betweenness值最高,为32)。我们将获得的所有蛋白进行了GO 和KEGG 分析发现:GO 和KEGG 富集的通路主要涉及肌动蛋白细胞骨架、细胞黏附、肿瘤相关途径的调节。PDLIM1 和VCL 最敏感药物分别是异甘草素(Isoliquiritigenin)和贝利司他(Belinostat)。

图5 PDLIM1 互作蛋白共同构建PPI 网络
3 讨论
癌症是一个全球范围内公认的公共卫生问题[7]。根据国际癌症研究机构编制的 GLOBOCAN 2020癌症发病率和死亡率估计值提供了全球癌症负担的最新信息,预计2040年全球癌症负担将达到2 840万例,比 2020年增加7%[8]。因此对癌症的预防、诊断和治疗方面的研究引起人们广泛关注。而基于肿瘤的生物信息学分析为肿瘤的诊断和治疗打开了新的思路[9]。挖掘对多种肿瘤有效的生物标志物可以使没有有效靶点的肿瘤得到有效诊断和治疗[10],可以为肿瘤预防和个性化治疗策略提供新颖而深入的见解[11-13]。近日,刘晓光等[14]人揭示了一种代谢相关的细胞死亡形式:双硫死亡。研究发现,在葡萄糖缺乏时,肾癌细胞中溶质载体家族7 成员11(solute carrier family 7 member 11,SLC7A11)蛋白的高表达加速了还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的耗竭,导致二硫化物的积累,诱导双硫应激,这种应激激活了Rac/ WAVE 调节复合物(WRC)-7 亚基肌动蛋白相关蛋白2/3(Arp2/3)信号通路,从而造成细胞骨架的紊乱,最终诱导细胞发生双硫死亡[1,14]。简而言之,细胞骨架蛋白对二硫化物应激的敏感性介导了双硫死亡。而PDLIM1 是一种与肌动蛋白应力纤维相关的细胞骨架蛋白[2],故我们合理推测PDLIM1 可能介导双硫死亡的发生。细胞骨架蛋白在体内以协调的方式起作用,在细胞癌变过程中可通过重新编程,从而参与调节肿瘤的侵袭和转移扩散[15]。故进一步分析PDLIM1在肿瘤中的作用,可能为肿瘤预防、治疗找到新靶点。
本研究首次利用生物信息学系统、全面地分析PDLIM1 在肿瘤中的作用。研究发现PDLIM1mRNA过表达可以促进慢性粒细胞白血病细胞的增殖和抑制细胞凋亡,加速其癌变的进程[16]。在乳腺癌中PDLIM1 可通过与α-辅肌动蛋白1 和α-辅肌动蛋白-4 的相互作用,从而参与细胞运动、肿瘤浸润与迁移。或通过抑制CDC42 的活性,从而参与细胞功能(细胞形态、细胞迁移、内吞)和细胞周期的调节[17]。还可以通过PDZ 结构域与CD271羧基端含有丝氨酸的PDZ 结合基序作用,从而促进CD271 依赖的胶质瘤的浸润。或者通过上皮-间充质转化相关转录因子Slug 调控神经钙粘素和β-连环蛋白表达,进而调节胶质瘤细胞的迁移和侵袭[17]。我们在关于PDLIM1mRNA 表达与肿瘤预后的研究中发现,在包括脑低级别胶质瘤和多形性胶质细胞瘤在内的多种胶质瘤中PDLIM1 的高表达往往肿瘤患者预后较差,这再次验证了我们的分析。令人值得思考的是,在肉瘤中PDLIM1 低表达往往提示预后较差。可能是低PDLIM1 降低E-钙黏素/β-连环蛋白复合体的稳定性,从而促进肿瘤细胞上皮间质转化(Epithelial-mesenchymal transition,EMT),加速肿瘤的进展[18]。这些研究表明PDLIM1 在多种肿瘤中的发生发展中具有良好的诊断和预后价值。
免疫细胞浸润影响肿瘤预后是毋庸置疑的[19]。而免疫疗法的应用显著改善了部分患者的预后[20]。目前常见的免疫疗法靶点包括PD1,PDL1 和CTAL-4 等,它们在高浸润表型患者中都显著上调[21]。我们的研究发现PDLIM1 的表达在以前列腺癌为首的36 种肿瘤中与免疫浸润呈显著相关。有研究发现在卵巢癌患者中,抗PDLIM1 自身抗体应答与PDLIM1 在卵巢癌组织中的高表达呈正相关,可作为CA125 的补充措施,提高卵巢癌检测的能力[4]。同样在胰腺癌中,PDLIM1 也可作为自身抗原诱导体液免疫应答[17]。而在对乳腺癌的研究中发现PDLIM1 的表达水平与CD8+T 细胞和树突状细胞的浸润水平呈正相关[17,22]。并且我们在对PDLIM1的免疫治疗队列分析中,发现PDLIM1 高表达的患者在经过免疫治疗后,往往拥有更长的OS。这表明PDLIM1 高表达的患者更有接受免疫治疗的必要,这为PDLIM1 mRNA 高表达患者的治疗提供了新方向。
为了进一步探索PDLIM1 在肿瘤中的作用,我们利用PDLIM1 构建了PPI 网络。发现PDLIM1 主要通过参与肌动蛋白细胞骨架、细胞黏着和肿瘤等相关途径发挥作用,而肌动蛋白网络的调控是已确定的双硫死亡的机制之一[1,14],这再次验证了我们的推测。我们首次提出PDLIM1 参与调节的网络中黏着斑蛋白(VCL)是最关键蛋白。VCL 是一种与细胞-细胞和细胞-基质连接相关的细胞骨架蛋白,它被认为是参与将 F-肌动蛋白锚定到膜上的几种相互作用蛋白之一,可以通过调节上皮细胞黏附分子(EPCAM)的表达来影响EMT 和肿瘤免疫[23]。然后我们探讨了PDLIM1 在肿瘤中的药物敏感性。发现PDLIM1 最敏感的药物是Isoliquiritigenin。靶向细胞骨架蛋白并不是肿瘤治疗中的新策略,其临床疗效早在50年前就已通过其抗有丝分裂能力得到证实[15]。紫杉醇和长春新碱等微管特异性化疗药物是化疗中常见的细胞骨架特异性毒物,目前仍然是肿瘤治疗的主要药物[15]。但耐药性仍然是一个重要的未解决的临床问题,需要开发有效的新型化合物。研究表明Isoliquiritigenin 已在多种疾病模型中被证实是一种强大的抗氧化剂,可通过激活 Sirtuin 1 和Nrf2 发挥作用[24-26]。且在多种肿瘤中被证实具有潜在的治疗价值。如:Isoliquiritigenin 可通过靶向 p38 MAPK 信号传导阻断自噬来抑制胰腺癌的进展[27];靶向 TGF-β/Smad 信号通路逆转 EMT 抑制转移性子宫内膜癌的进展[28];抑制 AMPK 和 Akt/mTOR 介导的糖酵解和乳酸生成参与结直肠癌的治疗[29]。但Isoliquiritigenin 是如何影响PDLIM1 的还需要我们进一步的探索。
通过以上研究,我们足以有理由推测PDLIM1在肿瘤的发生发展中起重要作用。进一步探讨PDLIM1 在肿瘤中的作用机制,有望为肿瘤治疗找到新的靶点。
同样,本研究还存在一些局限性:①本研究是基于公共数据库的数据进行的生物信息学分析,由于纳入分析的数据不同,预测得到的结果也存在一定偏差。②本研究中的所有预测都需要进一步的实验来验证。
综上所述,PDLIM1 有潜力成为一种新的诊断性的和预后性的肿瘤标记物。并且,因为PDLIM1与免疫浸润相关,可以预测免疫治疗的疗效,故也有潜力成为一个新的分子靶点。

