花椒黑胫病的病原鉴定与杀菌剂筛选
李培琴 阮钊 焦嘉卉 孙孟娇 丁俊园 唐光辉


摘 要:【目的】鉴定陕西凤县花椒产区黑胫病的病原,筛选该病害的有效防治药剂,为花椒黑胫病的有效防控提供指导依据。【方法】采用组织分离法和致病性检验获得花椒黑胫病的病原菌,结合形态学特征和ITSrDNA、COXⅡ、TEF1-α 和β-tubulin 序列分析对病原菌进行鉴定;采用菌落生长速率法测定了15 种杀菌剂对花椒黑胫病菌的室内毒力。【结果】从花椒黑胫病组织中分离纯化到4 株菌落形态不同的菌株,经柯赫氏法则验证,明确菌株Zb-P1 为花椒黑胫病的病原菌;基于Zb-P1 菌落形态和繁殖体显微结构特征观察,发现Zb-P1 菌落呈花瓣状,菌丝无隔膜,无性繁殖时产生典型的柠檬状游动孢子囊,故将Zb-P1 鉴定为疫霉属Phytophthora 菌物;通过对Zb-P1 的ITS、COXⅡ、TEF1-α 和β-tubulin 序列分析,将Zb-P1 鉴定为柑橘褐腐疫霉P. citrophthora。复配化学杀菌剂40% 烯酰·氰霜唑悬浮剂、68.75% 氟菌·霜霉威悬浮剂、2% 霜脲·锰锌可湿性粉剂和78% 烯酰·吡唑酯水分散粒剂对花椒黑胫病的室内毒力较强,其EC50 值分别为0.390 1、0.385 6、0.216 6 和0.182 0 mg·L-1;生物源杀菌剂5% 香芹酚可溶液剂、0.4% 蛇床子素可溶液剂、0.5% 小檗碱水剂和0.3% 苦参碱乳油对花椒黑胫病的室内毒力较差,EC50 均值分别为13.246 7、9.411 7、8.244 3 和8.231 5 mg·L-1。【结论】引起陕西凤县花椒黑胫病的病原菌为柑橘褐腐疫霉P. citrophthora,对花椒黑胫病菌抑菌作用显著的杀菌剂为烯酰·氰霜唑、氟菌·霜霉威、霜脲·锰锌和烯酰·吡唑酯。
关键词:花椒黑胫病;柑橘褐腐疫霉;形态鉴定;分子鉴定;杀菌剂筛选
中图分类号:S763.1 文献标志码:A 文章编号:1003—8981(2023)03—0150—09
花椒Zanthoxylum bungeanum 为芸香科花椒属灌木或落叶小乔木,是我国乡村振兴的重要经济林树种,多栽培于气候湿润的丘陵山地区,如陕西、甘肃、四川等地,陕西省凤县地处我国秦岭腹地,属温带半湿润山地气候,是我国花椒的重要产区之一,其主要栽培种‘凤县大红袍含有丰富的麻味素,个大、肉厚、色艳、味浓,有极高的经济价值,但‘凤县大红袍抗性弱、易感病,常发生干腐病、根腐病、疫霉病及叶锈病等多种病害,这严重制约了陕西凤县花椒产业的发展[1-2]。
近年来,本研究团队在陕西进行花椒病害田间调查时,在凤县花椒试验示范园区发现了一种花椒病害,该病害主要危害‘凤县大红袍花椒,受害花椒树大面积衰弱且坐果率降低,严重制约了该产区花椒产业的发展。该病害常发生在花椒茎基部,发病初期,受害部位表皮变褐,随着病斑的发展与扩展,病斑凹陷,变为黑褐色,腐烂严重,横向纵向不断延展,环绕整个根茎交界部位,导致花椒树的水分和营养运输受阻,最终枝叶萎蔫,全株枯死,该病害与石培贤等[3] 在2011 年报道的由疫霉属Phytophthora 菌物引起的临夏花椒黑胫病症状相似。2013 年,谢宁等[4] 曾对甘肃陇南和陕西凤县的花椒黑胫病(亦称疫霉病)的病原进行了研究,基于形态学和ITS 序列分析,将陕西凤县2 个不同地理区域的花椒黑胫病病原鉴定为多寄主疫霉P. multivora、柑橘褐腐疫霉P. citrophthora 和苎麻疫霉P. boehmeriae,而将甘肃3 个不同地理区域的花椒黑胫病的病原鉴定为多寄主疫霉P. multivora 和柑橘褐腐疫霉P.citrophthora。其后,王洁菲等[5] 也对陕甘两省花椒疫霉病的病原进行了鉴定,基于形态学特征与ITS 和β-tubulin 序列分析,将陕西宝鸡地区4 个不同区域的花椒疫霉病的病原鉴定为苎麻疫霉P.boehmeriae,而将甘肃陇南地区4 个不同区域的花椒疫霉病的病原鉴定为多寄主疫霉P. multivora。
由此可知,不同地理区域的花椒黑胫病的病原菌可能不一样,同一地理区域的花椒黑胫病的病原菌也有可能随着花椒的引种栽培和种质资源的交换而发生改变。2015 年后,尚未见花椒黑胫病相关的研究报道。陕西凤县花椒试验示范园为我国著名的花椒示范园,园区育有多种花椒品种,近几年来,在该示范园区名优品种‘凤县大红袍上黑胫病发生极为严重,目前,由于尚不清楚该示范园区花椒黑胫病的病原,对该病害的有效防控带来了一定的困难。本研究拟通过组织分离法和致病性验证获得凤县花椒试验示范园区花椒黑胫病的病原菌,并结合形态学与ITS、COXⅡ、TEF1-α 和β-tubulin 基因的序列分析,对花椒黑胫病的病原进行系统鉴定,在此基础上,进一步开展杀菌剂对花椒黑胫病菌的室内毒力测定,可为花椒黑胫病的有效防治奠定基础。
1 材料与方法
1.1 供试病样
于2020 年7 月, 在陕西省宝鸡市凤县花椒试验示范基地凤州镇白石铺村(106°31′12″E,33°55′12″N)内选取‘凤县大红袍花椒,其海拔为964 m,观察并记录花椒黑胫病的田间发病症状,后刨根挖出发病但尚未完全死亡的椒树,截取发病的茎基部组织带回实验室。
1.2 供试培养基
配制马铃薯葡萄糖琼脂(Potato dextrose agar, PDA)培养基[6],用于花椒黑胫病菌的分離培养。V8 汁培养基:V8 蔬菜汁(美国产,采用8种不同营养成分的蔬菜作为原料进行混合配比的罐装饮料)200 g,碳酸钙 2 g,琼脂粉16 g,水1 000 mL,121 ℃高压蒸汽灭菌25 min,备用;用于诱导花椒黑胫病菌产生子实体和杀菌剂室内毒力测定。
1.3 供试杀菌剂
供试药剂:5% 香芹酚可溶液剂(SL)(PD20200138),山西德威本草生物科技有限公司;0.4% 蛇床子素可溶液剂(SL)(PD20182169),杨凌馥稷生物科技有限公司;0.3% 苦参碱乳油(EC)(PD20101371),杨凌馥稷生物科技有限公司;0.5% 小檗碱水剂(AS)(PD20151304),山东圣鹏科技股份有限公司;3% 多抗霉素可湿性粉剂(WP)(PD20100187),山东鲁抗生物农药有限责任公司;25% 吡唑醚菌酯悬浮剂(SC)(PD20170997),山东恒利达生物科技有限公司;23.4% 双炔酰菌胺悬浮剂(SC)(PD20142151),先正達南通作物保护有限公司;10% 氰霜唑悬浮剂(SC)(PD20050191),日本石原产业株式会社;50% 氟啶胺悬浮剂(SC)(PD20080180),日本石原产业株式会社;80% 代森锰锌可湿性粉剂(WP)(PD20096679),陕西上格之路生物科学有限公司;40% 烯酰·氰霜唑悬浮剂(SC)(PD20171564), 浙江威尔达化工有限公司;68.75% 氟菌·霜霉威悬浮剂(SC)(PD20120373),拜耳作物科学(中国)有限公司;78% 烯酰·吡唑酯水分散粒剂(WG)(PD20183011),山东百农思达生物科技有限公司;72% 霜脲·锰锌可湿性粉剂(WP)(PD20081950),河北中保绿农作物科技有限公司;47% 春雷·王铜可湿性粉剂(WP)(PD20121558),陕西麦可罗生物科技有限公司。
1.4 花椒黑胫病菌的分离、纯化与保存
采用组织分离法[6]:花椒黑胫病发病组织在自来水下冲洗干净,切取病健交界处大小约为5 mm×5 mm 见方的组织块,用75% 的酒精表面消毒30 ~ 50 s 后,用0.1% 的氯化汞水溶液消毒2 min,用无菌水冲洗4 次,将组织块放置于PDA培养基上在25 ℃黑暗培养。当有菌丝从组织块边缘长出时,用无菌镊子小心夹取菌落边缘的菌丝组织,接种至新的PDA 平板上,在25 ℃进行黑暗培养,纯化2 次以上,直至获得纯培养的菌落,在4 ℃低温条件下进行保存。
1.5 分离物的致病性测定
根据柯赫氏法则检验分离物的致病性,获得花椒黑胫病的病原菌。在培养了14 d 的各分离物菌落上制备菌饼(Φ:5 mm),采用针刺接种法[2]将菌饼接种在花椒植株上。选取2 a 生健康的‘凤县大红袍花椒盆栽苗为接种植株,将茎基部及向上部分的茎干用无菌水擦洗干净,在茎基部和茎中上部分别选取与菌饼大小相当的部位为接种位点,用无菌尖口镊子在接种位点制造7 ~ 10 个针刺微伤口,将菌饼接种在伤口处(菌丝面紧贴伤口处),用湿润的脱脂棉包裹菌饼,并用保鲜膜缠绕,6 个重复处理,以接种PDA 培养基菌饼的枝干作为对照。每个处理5 株盆栽苗,接种后的植株放置于植物培养室培养,培养温度为25 ℃、光周期为L//D=12 h//12 h,分别在接种后的15 和30 d 拍照记录发病症状。从接种15 d 的发病的花椒根茎部的病健交界处进行病原物的再分离培养和致病性测定。
1.6 病原物的鉴定
1.6.1 形态学鉴定
将花椒黑胫病菌接种在V8 培养基平板上,放置于25 ℃的培养箱中进行培养,观察菌落形态特征。采用平板光照培养法诱导花椒黑胫病菌产生子实体[7],在显微镜下观察并拍照记录其菌丝及子实体特征,观察其是否能产生孢子囊、藏卵器、雄器和卵孢子等繁殖结构,并测量其大小,参照Ho[8] 及Kroon 等[9] 的分类方法对花椒黑胫病菌进行形态学鉴定。
1.6.2 分子生物学鉴定
采用核糖体DNA 内部转录间隔区(ribosomalDNA-internal transcribed spacer,rDNA-ITS)、细胞色素氧化酶基因Ⅱ(Cytochrome oxidase Ⅱ,COXⅡ)、翻译延长因子基因(Translationelongation factor 1-α,TEF1-α) 和β-tubulin 微管蛋白基因(β-tubulin)序列分析对花椒黑胫病菌进行分子生物学鉴定。收集花椒黑胫病菌的菌丝体, 采用CTAB 法进行基因组DNA 的提取[10],rDNA-ITS 的PCR 扩增引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′) 和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[11],COXⅡ 基因的PCR 扩增引物为Fm75(3′-CCTTGGCAATTAGGATTTCAAGAT-5′) 和Fm78(3′-ACAAATTTCACTACATTGTCC-5′)[12],TEF1-α 的扩增引物为TEF1(3′-TCACGATCGACATTGCCCTG-5′) 和TEF2(3′-ACGGCTCGAGGATGACCATG-5′)[12],β-tubulin 的扩增引物为TUB2(3′-CGGTAACAACTGGGCCAAGG-5′) 和TUB1(3′-CCTGGTACTGCTGGTACTCAG-5′)[12]。PCR 扩增体系为30 μL,包含引物各1 μL、DNA 模板0.5 μL、2×Es TaqMasterMix 15 μL、ddH2O 12.5 μL。PCR 扩增产物经检测合格后送生工生物工程(上海)股份有限公司进行测序。所得序列经拼接后在NCBI 数据库进行BLAST 分析,并将其提交至NCBI,获取相应的GenBank 登录号。结合参考文献和比对分析结果再从GenBank 中下载相关菌株的ITS、COXⅡ、TEF-1α 和β-tubulin 序列, 以钟器腐霉Pythium vexans 为外群, 采用邻近法(Neighborjoining,NJ) 构建花椒黑胫病菌的ITS-COXⅡ-TEF-1α-β-tubulin 多基因系统发育树[4],分析花椒黑胫病菌的系统发育关系。
1.7 不同杀菌剂对病原物的室内毒力测定
采用菌落生长速率法[13] 测定供试药剂对花椒黑胫病病菌的室内毒力。待花椒黑胫病菌在含药V8 培养基平板上生长8 d 时,采用十字交叉法测量菌落直径(mm),按照以下公式计算抑菌率:抑制率(%)=(R0-R)×100/(R0-5) (1)R0 为对照菌落直径;R 为处理组菌落直径。
以抑制率对应的几率值为因变量(Y),农药各浓度的对数值为自变量(X),建立毒力回归方程,計算各农药对花椒黑胫病菌的有效中浓度(Effective medium concentration, EC50) 及其95%置信限(Fiducial limit,FL)。
2 结果与分析
2.1 花椒黑胫病田间发病症状
花椒黑胫病常发生在花椒根茎交接部位,一至多年生椒树均可发病,感病部位发病初期表皮失绿变褐,轻度腐烂凹陷,并有黑褐色胶汁溢出,发病后期病斑腐烂严重,木质部变黑,植株水分和营养运输受阻,花椒树地上部分枝叶萎蔫,叶片脱落树势衰弱,严重时可导致植株枯死(图1a—b)。
2.2 花椒黑胫病菌的分离与致病性检验
从花椒黑胫病发病组织分离获得4 个菌落形态不同的分离物,分别编号为Zb-P1 ~ P4。经柯赫氏法则验证致病性,发现只有菌株Zb-P1 能成功侵染花椒枝干,并导致接种部位变黑、腐烂(图2)。Zb-P1 接种在花椒根茎交界部位15 d 时,接种部位表皮失绿变褐,木质部变软,枝干腐烂凹陷(图2b);培养至30 d 时,接种部位发病面积不断扩大环绕枝干,沿着接种部位向上、向下均可扩展,表皮腐烂脱落,木质部组织腐烂变黑(图2c)。花椒黑胫病在田间的发病部位大部分都是根茎交界处,本研究为了探讨其是否也能引起花椒茎干中上部位发病,故将Zb-P1 接种在花椒茎干的中上部,发现其也能引起发病部位的变褐、腐烂和组织坏死。在茎干中上部接种15 d 时,植株患处表皮失绿变黑,木质部变软变褐,腐烂凹陷(图2e);将其培养至30 d 时,发现病斑与15 d 时的病斑大小变化不大,病斑从15 d 后基本停止扩展(图2f)。从接种15 d 发病部位的病健交界处进行病原物的分离、培养和纯化,获得与Zb-P1 具有相同形态特征的菌株,将其再接种到健康花椒植株上,引起与花椒黑胫病相同的症状。根据柯赫氏法则,证明Zb-P1 为引起花椒黑胫病的病原菌。
2.3 花椒黑胫病病原菌的形态特征
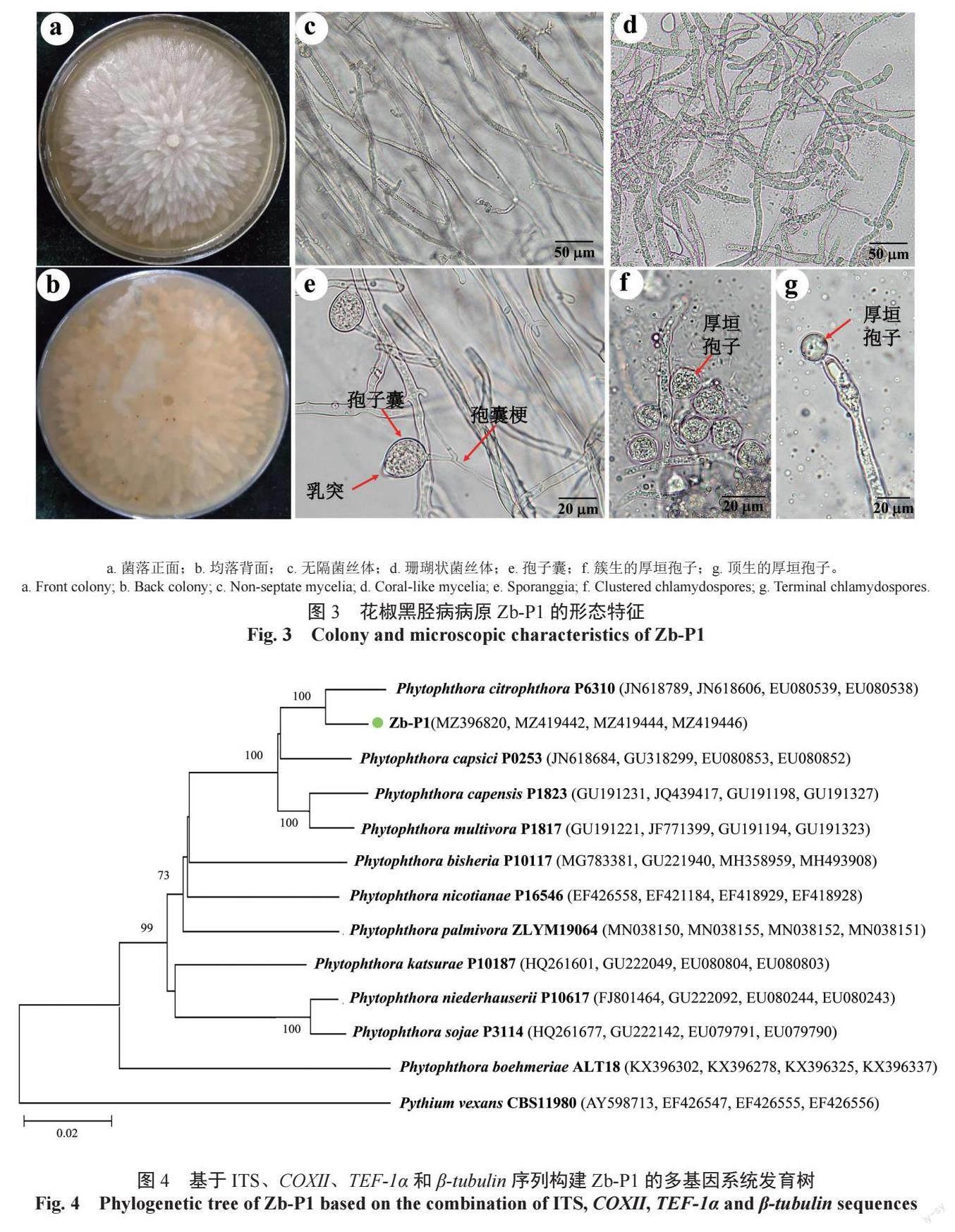
病原物Zb-P1 在V8 培养基上培养,菌落平均生长速率为5.71±0.54 mm/d,菌落正面白色,背面土黄色,呈花瓣辐射状,气生菌丝较少,短绒毛状,致密,菌丝不易挑起(图3a—b)。菌丝无隔,分枝处常缢缩,菌丝宽为3.3 ~ 7.4(5.7±1.2)μm(图3c)。培养14 d 左右,发现Zb-P1 会产生特有的珊瑚状菌丝(图3d),比正常菌丝略宽,其宽度为7.5 ~ 9.8(8.6±1.8)μm。孢子囊柠檬状,椭圆形,显微镜下测量50 个孢子囊大小,其长为20.3 ~ 30.6(30.2±5.7)μm, 宽为15.2 ~ 20.9(19.5±3.2)μm,长宽比为1.34 ~ 1.46(1.55),孢子囊具明显乳突,乳突高度2.1 ~ 6.1(2.8±0.8)μm,孢囊梗呈简单合轴分枝或不分枝(图3e)。厚垣孢子球形,簇生(图3f)或顶生(图3g),显微镜下测量50 个厚垣孢子大小,直径为13.5 ~ 25.6(19.1±2.3)μm。尚未观察到Zb-P1 在V8 固体培养基上产生藏卵器、雄器和卵孢子。综合菌落形态与无性繁殖器官等特征,参照谢宁等[4]、王洁菲等[5] 和仇芳等[14] 对疫霉菌的描述,将花椒黑胫病的病原菌Zb-P1 鉴定为疫霉属Phytophthora菌物。
2.4 花椒黑胫病病原菌的分子鉴定结果
利用ITS、COXⅡ、TEF-1α 和β-tubulin 引物分别对菌株Zb-P1 的ITS、COXⅡ、TEF-1α 和β-tubulin基因进行扩增,经测序分析,确定片段全长分别为839、624、1 061 和1 035 bp。将Zb-P1 的ITS、COXⅡ、TEF-1α 和β-tubulin 序列提交到GenBank,获得其相应的GenBank 登录号,分别为MZ396820、MZ419442、MZ419444 和MZ419446。将Zb-P1 的ITS、COXⅡ、TEF-1α 和β-tubulin 序列在NCBI 中进行BLAST 同源性分析,发现其与柑橘褐腐疫霉Phytophthora citrophthora的同源性均在99%以上。采用多基因联合系统发育分析,构建ITS-COXⅡ- TEF1-α-β-tubulin 串联数据集,拼接后,串联序列的碱基个数为2 986 bp,同质性检验P=0.01,说明ITS、COXⅡ、TEF-1α 和β-tubulin 可进行串联分析。使用MEGA10.2.6 软件,计算串联数据集的平均遗传距离,该值为0.089,说明可采用邻接法(Neighbor-joining,NJ)法建立系统发育树。采用NJ法,构建Zb-P1 的多基因系统发育树(图4),结果表明,花椒黑胫病菌Zb-P1 与柑橘褐腐疫霉P. citrophthora 聚在为一支,支持率达100%。根据上述花椒黑胫病菌的形态学特征及多基因联合分子鉴定结果,将花椒黑胫病菌鉴定为柑橘褐腐疫霉P. citrophthora。
2.5 室内毒力测定结果
15 种杀菌剂对花椒黑胫病菌的菌落生长均表现出不同程度的抑制效果(表1),其中,以氰霜唑、氟啶胺、烯酰·氰霜唑、氟菌·霜霉威、霜脲·锰锌和烯酰·吡唑酯的抑菌效果较强,其相应的EC50 均值分别为1.366 7、0.609 5、0.390 1、0.385 6、0.216 6 和0.182 0 mg·L-1;多抗霉素、吡唑醚菌酯、双炔酰菌胺和春雷·王铜抑菌作用次之,EC50 均值分别为4.274 4、3.792 4、2.360 7 和1.930 9 mg·L-1;而植物源杀菌剂香芹酚、蛇床子素、小檗碱和苦参碱抑菌效果相对较差,EC50 均值分别为13.246 7、9.411 7、8.244 3 和8.231 5 mg·L-1。
3 结论与讨论
3.1 结 论
本研究结合形态学和分子生物学的方法将引起陕西凤县花椒黑胫病的病原菌Zb-P1 鉴定为柑橘褐腐疫霉P. citrophthora,对花椒黑胫病菌Zb-P1具有显著抑菌作用的杀菌剂为40% 烯酰·氰霜唑悬浮剂、68.75% 氟菌·霜霉威悬浮剂、2% 霜脲·锰锌可湿性粉剂和78% 烯酰·吡唑酯水分散粒剂,相对应的EC50 值分别为0.390 1、0.385 6、0.216 6和0.182 0 mg·L-1,而生物源杀菌剂5% 香芹酚可溶液剂、0.4% 蛇床子素可溶液剂、0.5% 小檗碱水剂和0.3% 苦参碱乳油对花椒黑胫病的室内毒力较差,EC50 均值高达13.246 7、9.411 7、8.244 3和8.231 5 mg·L-1。
3.2 讨 论
疫霉属于卵菌,是引起作物病害的重要病原菌之一,目前在世界范围内已发现超过100 种高侵染性致病疫霉病原[15],最为著名的是致病疫霉菌P. infestans 引起的马铃薯晚疫病及大豆疫霉菌P. sojae 引起的大豆疫霉病。传统形态学根据菌丝、孢子囊、藏卵器、雄器、卵孢子或培养性状的形态差异特征鉴定疫霉属卵菌,但由于这些特征不易区分,界限模糊,给该属菌物种的鉴定带来一定的困难,基于形态学特征,采用多基因序列分析可对疫霉属菌物在种水平上进行准确的鉴定[16-17]。本研究基于花椒黑胫病病原菌的菌落、菌丝、孢子囊及厚垣孢子等形态特征,联合分析其ITS、COXⅡ、TEF-1α 和β-tubulin 这4 个分子序列的特征并构建系统发育分析,将陕西凤县花椒试验示范园区的花椒黑胫病病原鉴定为柑橘褐腐疫霉P. citrophthora。多基因联合系统发育分析能提供丰富的位点基因,通过联合不同基因的数据集,鉴定结果准确性更高,如Luongo 等[12] 采用ITS、TEF-1α、COXⅡ 基因和β-tubulin 基因4 种序列进行同源分析将意大利合欢黑胫病病原鉴定为Phytophthora tropicalis;Maizatul-Suriza 等[18] 同时采用ITS、TEF-1α、COXⅡ、β-tubulin、PpHPAV 基因序列和扩增长度片段多态性对分离自哥伦比亚和马来西亚两个地区的油棕芽腐病菌P. palmivora进行了比对分析,构建系统发育树,研究其遗传多样性及变异情况。利用多基因序列联合分析,能更好地区分疫霉属内的部分近缘种,是对疫霉属内类群鉴定的有效方法。
疫霉在陕西地区花椒上造成的病害曾有报道, 谢宁等[4] 曾在2013 年报道了陕甘地区的花椒疫霉病害,基于形态特征和ITS 序列分析将凤县双十铺镇的疫霉菌株Pfs1 鉴定为苎麻疫霉P. boehmeriae、菌株Pfs2 鉴定为多寄主疫霉P. multivora、将凤县平木铺的疫霉菌株Pfp 鉴定为柑橘褐腐疫霉P. citrophthora;而王洁菲等[5] 于2015 年基于病原物形态特征、ITS 和β-tubulin 序列分析,将凤县双十铺镇的花椒疫霉病菌株Pfs3、Pfs4 和Pfs5 鉴定为苎麻疫霉P. boehmeriae。由此可知,尽管是同一地理区域的同种病害,其病原物有可能不一样。本研究基于形态学特征和ITS、COXⅡ、TEF-1α 和β-tubulin 这4 个分子序列分析,发现凤县花椒试验示范园区的黑胫病是由柑橘褐腐疫霉P. citrophthora 引起的,与谢宁等报道的凤县平木铺的疫霉菌株Pfp 鉴定结果一致,而与王洁菲等报道的结果有所差异。本研究发现花椒黑胫病菌Zb-P1 的菌丝能特化形成珊瑚状菌丝体,这与仇芳等[14] 基于形态学特征在鉴定油梨根腐病病原菌发现的现象一致;此外,本研究未发现花椒黑胫病菌Zb-P1 在固体培养基上形成卵孢子,与谢宁等[4] 对花椒疫霉病菌菌株Pfp 的鉴定结果一致,由此说明花椒黑胫病菌Zb-P1 的有性生殖为异宗配合。凤县花椒试验示范园为我国花椒标准示范基地,黑胫病的发生严重影响了园区花椒的种植,给示范园区花椒的管理带来了一定的困难。本研究综合形态学特征分析和分子生物学技术,鉴定了凤县花椒试验示范园区的黑胫病的病原物,能为园区花椒黑胫病的有效防控奠定基础。然而,本研究中花椒黑胫病的采样区域仅限于陕西凤县花椒产区,我国花椒种植面积广泛,在其他花椒产区是否也有黑胫病的发生及其病原物是什么也值得后期深入研究。
黑胫病在烟草上报道得较多,也称“黑杆疯”,是由烟草疫霉P. nicotianae 引起的一种广泛分布、严重危害烟草的土传病害[19]。花椒黑胫病的发病部位及症状与烟草黑胫病相似,均以根茎部发病为主,向茎髓部蔓延扩展,病株根茎交接处变黑且坏死,叶片自下而上依次变黄、脱落,发病严重时整株枯死。由疫霉属卵菌引起的林木病害发病情况复杂,其病原物可能會在土壤及其凋落物中富集,因此,这类病害初侵染菌源量的多少与土壤环境因子密切相关,如根际土壤微生物的群落结构、土壤理化性质、土壤营养成分等,而这些因素又会受到寄主的林龄和品种等各种因素的影响[20-21],因此,在构建花椒园区时应该将这些因素考虑在内。近年来,由于花椒黑胫病发病快、分布广、防治难等特点,已经成为我国花椒产区最严重的病害之一。本研究在致病性测定时发现病原菌在茎基部和茎中上部均能侵染发病,然而,茎中上部的病斑由于保湿措施的去除导致病斑扩展停止,而茎基部病斑仍在扩展。花椒茎基部邻近土壤,土壤中的水分能为其创造高湿条件,故当去除保湿措施后,茎基部的病斑仍可继续发展,推断高湿环境有利于该病害的发展。这也能解释在田间花椒黑胫病主要发生在根茎交接部位这一现象,同时,也说明了花椒黑胫病的发病部位不仅仅局限于茎基部,只要条件合适,也能危害茎干中上部分。卵菌病害由于土壤带菌隐蔽性极易与其他病害混发,导致实际生产中防治困难,开展卵菌病原的室内杀菌剂筛选能为其有效防治提供指导依据[22]。疫霉属菌物是一类重要的植物病原物,本研究测定了卵菌专用杀菌剂、植物源杀菌剂和常见广谱杀菌剂对花椒黑胫病菌的室内毒力,发现供试的7 种卵菌专用杀菌剂对花椒黑胫病菌的抑菌效果显著,其中以复配杀菌剂烯酰·吡唑酯抑菌效果最强。烯酰·吡唑酯是唑醚菌酯和烯酰吗啉的混配制剂,其中烯酰吗啉是针对病原卵菌的专一性杀菌剂,抗性风险小,作用于卵菌生活史的各个阶段,在植株体内有分层转移活性和局部内吸活性,是卵菌植物病害的有效防控药剂[23];而植物源农药对花椒黑胫病病原抑菌效果均不佳;广谱性杀菌剂中以保护性杀菌剂春雷·王铜的抑菌作用较强,其余3 种广谱性杀菌剂的抑菌效果一般。本研究针对花椒黑胫病菌开展的室内杀菌剂筛选试验,虽然能为该病害的田间防治药剂选择提供一定的指导依据,然而,田间植物病害发生复杂,环境条件对杀菌剂的功效也会有影响,后期有必要深入开展烯酰·吡唑酯对花椒黑胫病的田间防效试验,从而为陕西地区花椒黑胫病的有效防控提供重要指导依据。
參考文献:
[1] 曹支敏, 明玉玲, 陈丹, 等. 花椒干腐病的寄主抗病性与病原菌致病性分化[J]. 西北林学院学报,2010,25(6):115-118.
CAO Z M, MING Y L, CHEN D, et al. Resistance of pricklyash to stem rot and pathogenicity differentiation ofFusariumsambucinum[J]. Journal of Northwest Forestry University,2010,25(6):115-118.
[2] LI P Q, RUAN Z, FEI Z X, et al. Integrated transcriptome andmetabolome analysis revealed that flavonoid biosynthesis maydominate the resistance ofZanthoxylum bungeanum against stem canker[J]. Journal of Agricultural and Food Chemistry,2021,69(22):6360-6378.
[3] 石培贤, 王莹玲, 叶鲲, 等. 刺椒黑胫病预防技术调查研究[J].中国农学通报,2011,27(6):21-25.
SHI P X, YE Y L, YE K, et al.Zanthoxylum bungeanum ‘Linxiacijiao black shank prevention technology research[J]. ChineseAgricultural Science Bulletin,2011,27(6):21-25.
[4] 谢宁, 曹支敏, 梁琼超, 等. 花椒疫霉病菌种的鉴定[J]. 西北林学院学报,2013,28(2):125-130.
XIE N, CAO Z M, LIANG C Q, et al. Identification ofPhytophthora species parasiting on pricklyash[J]. Journal ofNorthwest Forestry University,2013,28(2):125-130.
[5] 王洁菲, 曹支敏, 白露超, 等. 陕甘两省花椒疫霉病病原鉴定及其拮抗菌筛选[J]. 北方园艺,2015(5):113-119.
WANG J F, CAO Z M, BAI L C, et al. Identification ofPhytophthora species causing pricklyash blight from Shaanxi andGansu provinces and screening of antagonisticActinomycetes[J].Northern Horticulture,2015(5):113-119.
[6] 阮钊, 丁俊园, 唐光辉, 等. 花椒根腐病的病原鉴定与防治药剂筛选[J]. 植物病理学报,2022,52(4):630-637.
RUAN Z, DING J Y, TANG G H, et al. Pathogen identificationof root rot ofZanthoxylum bungeanum and screening offungicides[J]. Acta Phytopathologica Sinica,2022,16(3):8-10.
[7] RISTAINO J B. A lucid key to the common species ofPhytophthora[J]. Plant Disase,2012,96(6):897-903.
[8] HO H H. Synoptic keys to the species ofPhytophthora[J].Mycologia,1981,73(4):705-714.
[9] KROON L P N M, BROUWER H, DE COCK A W A M, et al.The genusPhytophthora anno 2012[J]. Phytopathology,2012,102(4):348-364.
[10] 潘力, 崔翠, 王斌. 一种用于PCR 扩增的丝状真菌DNA 快速提取方法[J]. 微生物学通报,2010,37(3):450-453.
PAN L, CUI C, WANG B. Rapid extraction of filamentous fungalDNA for PCR amplification[J]. Microbiology China,2010,37(3):450-453.
[11] 陈悦, 王欣悦, 胡建忠, 等. 甘肃省沙棘枝枯病病原菌的分离鉴定及其生物学特性[J]. 经济林研究,2022,40(2):191-200,268.
CHEN Y, WANG X Y, HU J Z, et al. Identification and biologicalcharacteristics of the pathogen of sea buckthorn stem wilt inGansu province[J]. Non-wood Forest Research,2022,40(2):191-200,268.
[12] LUONGO L, VITALE S, GALLI M, et al. Morphological andmolecular identification ofPhytophthora tropicalis as causalagent of crown and root rot onAlbizia julibrissin[J]. Journal ofPhytopathology,2016,164(11-12):959-966.
[13] 徐金柱, 秦长生, 杨华, 等. 无瓣海桑灰霉病病原的分离及药剂筛选[J]. 中南林业科技大学学报,2013,33(10):15-18.
XU J Z, QIN C S, YANG H, et al. IsolatingBotrytis cinereafromSonneratia apetala and screening fungicides for controllingpathogen[J]. Journal of Central South University of Forestry &Technology,2013,33(10):15-18.
[14] 仇芳, 徐刚, 谢昌平, 等. 油梨根腐病病原菌的鉴定、生物学特性及室内药剂筛选[J]. 热带作物学报,2021,42(5):1424-1432.
CHOU F, XU G, XIE C P, et al. Identification, biologicalcharacteristics and screening of fungicides of the pathogen causingroot rot on avocado (Persea americana)[J]. Chinese Journal ofTropical Crops,2021,42(5):1424-1432.
[15] JUNG T, P?REZ-SIERRA A, DUR?N A , et al. Canker anddecline diseases caused by soil- and airbornePhytophthoraspecies in forests and woodlands[J]. Persoonia,2018,40(39):182-220.
[16] 韩长志. 樟疫霉(Phytophthora cinnamomi) 的研究进展[J]. 南京林业大学学报( 自然科学版),2012,36(4):140-144.
HAN C Z. Research progress onPhytophthora cinnamomi[J].Journal of Nanjing Forestry University (Natural ScienceEdition),2012,36(4):140-144.
[17] 邹芬, 何烈干, 石和芹, 等. 江西番茄烂果病病原菌鉴定[J].植物病理学报,2021,51(4):650-653.
ZOU F, HE L G, SHI H Q, et al. Identification of the causal agentcausing tomato fruit rot in Jiangxi[J]. Acta PhytopathologicaSinica,2021,51(4):650-653.
[18] MAIZATUL-SURIZA M, DICKINSON M, IDRIS A S.Molecular characterization ofPhytophthora palmivoraresponsible for bud rot disease of oil palm in Colombia[J]. WorldJournal of Microbiology & Biotechnology,2019,35(3):44.
[19] 田所会, 刘涛, 刘俊, 等. 烟草黑胫病的病原鉴定及诱抗剂处理效果[J]. 中国植保导刊,2022,42(10):20-24,66.
TIAN S H, LIU T, LIU J, et al. Pathogen identification of tobaccoblack shank and determination of indoor control effect of plantresistance inducers[J]. China Plant Protection,2022,42(10):20-24,66.
[20] 鲍佳书, 汤玉洁, 刘俊萍, 等. 不同品种薄壳山核桃林地土壤微生物多样性及群落组成[J]. 中南林业科技大学学报,2022,42(9):24-36.
BAO J S, TANG Y J, LIU J P, et al. Study on soil microbial diversityand community composition of different pecan plantations[J].Journal of Central South University of Forestry & Technology,2022,42(9):24-36.
[21] 沈杨阳, 白彦峰, 靳云铎, 等. 凋落物添加对不同龄级杉木林土壤养分与微生物特性的影响[J]. 中南林业科技大学学报,2022,42(3): 114-125.
SHEN Y Y, BAI Y F, JIN Y D, et al. Effects of litter additionson the soil nutrients and microbial properties inCunninghamialanceolata plantations of different stand ages[J]. Journal ofCentral South University of Forestry & Technology,2022,42(3):114-125.
[22] HAO W, GRAY M A, F?RSTER H, et al. Evaluation of newOomycota fungicides for management ofPhytophthora root rotofCitrus in California[J]. Plant Disease,2019,103(4):619-628.
[23] 黃青春, 叶钟音. 烯酰吗啉(DMM) 的特性及其作用机制[J].农药科学与管理,2000,21(5):28-31.
HUANG Q Q, YE Z Y. Character and mode of action ofdimethomorph[J]. Pesticide Science and Administration,2000,21(5):28-31.
[ 本文编校:李义华]

