杏仁中苦杏仁苷合成关键基因PaCYP79启动子互作蛋白的筛选
张美玲 张俊环 殷丽丽 杨丽 姜凤超 于文剑 王玉柱 孙浩元

摘 要:【目的】苦杏仁苷是形成杏仁苦味的主要物质,细胞色素P450 基因CYP79 是苦杏仁苷合成路径上的重要基因,研究调控CYP79 基因表达的转录因子对进一步阐明杏仁中苦杏仁苷合成与调控机制具有重要意义。【方法】以‘串枝红‘骆驼黄杏仁不同发育时期的种皮和子叶为试验材料,构建杏仁cDNA 文库。对杏中PaCYP79 启动子上顺式作用元件进行预测,并利用重组的诱饵载体pAbAi-PaCYP79p 对杏仁cDNA 酵母文库进行筛选,结合酵母单杂交实验,鉴定PaCYP79 启动子可能的上游调控因子。【结果】对PaCYP79 启动子顺式作用元件分析表明,PaCYP79 启动子序列中含有多个植物的组成型核心启动子顺式作用元件,还含有ABA、赤霉素、茉莉酸等多种植物激素和环境胁迫的响应元件,参与分生组织发育及种子特异调控等顺式作用元件。成功构建杏仁cDNA 酵母文库,库容为1.2×107 CFU,平均插入片段大于1 000 bp,文库的重组率为100%。酵母文库筛选结果经测序和Blast 同源性分析,获得10 个互作蛋白,其中包括淀粉样蛋白聚集和蛋白毒性的正调控相关的蛋白(small EDRK-rich factor 2),与种子发育和随后的萌发调控相关的蛋白(seed biotin-containing proteinSBP65),参与控制纤维素微原纤维定向沉积调控的类动力蛋白(kinesin-like protein KIN-4C),60S 核糖体蛋白L19-2(PREDICTED: 60S ribosomal protein L19-2),聚腺苷结合蛋白2 亚型X1(polyadenylate-binding protein2 isoform X1),以及5 個未知功能的蛋白。酵母单杂交进一步证实这10 个蛋白能与PaCYP79 基因启动子结合。【结论】本研究成功构建了高质量的杏仁cDNA 酵母文库,并利用酵母单杂交技术在酵母文库中筛选并验证了10 个与PaCYP79 启动子互作的蛋白。这些互作蛋白的筛选为深入研究杏仁中苦杏仁苷的合成与调控奠定了基础。
关键词:杏仁;酵母cDNA 文库;酵母单杂交;互作蛋白;PaCYP79 启动子
中图分类号:S662.2 文献标志码:A 文章编号:1003—8981(2023)03—0057—13
杏Prunus armeniaca L. 是原产于中国的重要果树树种[1]。其种子—杏仁有甜、苦之分,甜杏仁富含蛋白质(其含量为23% ~ 27%)、不饱和脂肪酸、维生素和矿物质,可加工成杏仁油、杏仁露等多种食品[2-4]。苦杏仁则是我国传统的中药材,具有镇咳、平喘、抗炎、镇痛等功效,被广泛应用于止咳润肺,散寒宣肺等功效中成药的研制[5]。甜/ 苦杏仁中苦杏仁苷含量差异显著,其含量变异幅度0.002 ~ 3.778 mg/g[6]。苦杏仁苷是一种生氰糖苷,主要存在于扁桃、桃、杏、李、樱桃等蔷薇科植物中,是形成种子苦味的主要物质。苦杏仁苷还是维生素B17 的主要功效成分,因其具有祛痰和治疗癌症的功效而被广泛应用于医药行业[7]。
关于苦杏仁苷的研究目前主要集中在对其提取纯化效率、分析检测技术的研发和提升、苦杏仁苷安全控制及生物活性等[8-10]。而关于杏仁中苦杏仁苷合成路径蛋白质互作机制及调控因子筛选的深入研究仍然较少见,仅在扁桃、梅等物种中苦杏仁苷合成相关基因的挖掘及功能鉴定取得了一些进展。在扁桃中,前体苯丙氨酸首先在2个细胞色素P450 单加氧酶CYP79 和CYP71 的催化下,合成扁桃腈(Mandelonitrile),之后在二磷酸尿苷葡萄糖苷转移酶GT1(UDP-glucuronidetransferases,GT) 的作用下生成洋李苷, 再经GT2 催化形成苦杏仁苷;同时,苦杏仁苷在苦杏仁苷水解酶(Amygdalin hydrolases,AH)和李苷水解酶(Prunasin hydrolases,PH)的催化下可进行分解转化[11-12]。扁桃腈裂解酶(Mandelonitrilelyase,MDL)可间接地竞争性催化洋李苷底物扁桃腈,从而影响苦杏仁苷的合成 [13]。苦杏仁苷在种皮中合成。位于起始位置2 个细胞色素P450 基因PdCYP79 和PdCYP71 在甜仁种皮呈现低表达[14],是扁桃中苦杏仁苷合成的重要限速酶。李苷水解酶(PH)参与了苦杏仁苷及洋李苷的降解代谢,且PH 蛋白可在种仁不同发育时期的质外体和共质体之间产生移动[15-17]。CYP79 作为苦杏仁苷合成的起始限速酶,已经在多个物种中克隆。Yamaguchi 等[18] 鉴定了梅(Prunus mume) 中的苦杏仁苷合成代谢起始步骤的细胞色素P450 酶CYP79s 和CYP71s,利用RNA 测序数据,克隆获得了编码CYP79s 和CYP71s 的全长cDNA 序列。对梅的不同组织中CYP79s 和CYP71s 的表达和酶活检测显示,CYP79D16 和CYP71AN24 在幼苗中呈现高表达,并在调控生氰糖苷的合成中起关键调控作用[18]。
杏仁资源的深加工和综合利用及杏仁的遗传改良一直备受重视[5, 19]。杏仁不仅具有丰富的营养应用于食品加工,还因其含有重要活性物质苦杏仁苷(Amygdalin)被广泛应用于医药行业[5]。调控苦杏仁苷含量一直是杏遗传改良研究的重要目标和方向之一,一方面,作为食品利用,要求尽量降低甚至清除杏仁中的苦杏仁苷,以消除杏仁的苦味和致毒性(苦杏仁苷是决定杏仁苦味性状形成的关键物质并具有一定的毒性)并免除加工过程中的脱苦程序;另一方面,作为药用原材料,则需要尽量提高苦杏仁苷的含量[20]。自1978年Kostina[21] 研究发现杏仁的苦味是受一对等位基因控制的质量性状以来,国内外在杏仁苦味性状的遗传规律、基因型鉴定、苦杏仁苷含量在品种资源中的变异等方面取得了一定进展。陈学森等[22]、Negri 等[23] 利用杏杂种一代群体分析了杏仁苦味性状的遗传规律。Cervellati 等[24] 对杏仁苦杏仁苷进行了qNMR 检测分析及QTL 定位。Liu等[25] 利用SSR 及ISSR 分子标记对甜仁杏进行了遗传多样性分析。黄雪等[6]、Karsavuran 等[26] 分别调查了国内、国外不同杏品种资源的苦杏仁苷的含量。然而,长久以来人们对于杏仁中苦杏仁苷的合成和调控机制知之甚少,极大地制约了此方面的杏育种进程和生产应用。
酵母单杂交技术是分析蛋白与基因之间互作的一种有效实验手段,现在已被广泛应用于蛋白质组学、细胞信号转导和功能基因组学等领域[27]。利用特异诱饵基因筛选种仁发育时期的酵母cDNA文库中互作的转录因子,将为我们研究苦杏仁苷合成路径、建立蛋白互作调控网络提供更多有益信息[28]。本研究首先构建杏仁不同发育时期的种皮和种仁的酵母cDNA 文库。利用杏基因组数据克隆获得杏仁中苦杏仁苷合成关键基因PaCYP79的启动子,并构建诱饵载体,结合酵母单杂交技术筛选PaCYP79 的上游调控因子,以期为阐明PaCYP79 调控机制、揭示杏仁苦味形成的分子机制提供借鉴。
1 材料与方法
1.1 材料、载体与试剂
试验材料‘串枝红(苦仁品种)和‘骆驼黄(甜仁品种)不同发育时期的样品取自北京市农林科学院林业果树研究所杏资源圃。根据杏仁发育形态分为4 个时期:Ⅰ - 胚乳发育期(种皮内的胚乳为液态,未形成子叶),Ⅱ - 子叶发育初期(种皮内大部分为液体形态的胚乳,在种仁的尖端形成少部分固态的子叶),Ⅲ - 子叶发育完成期(种皮内无液态的胚乳,已完全形成子叶,但种皮还未纤维化,仍为白色且较厚),Ⅳ - 杏仁发育成熟期(种皮颜色变深并纤维化成薄薄的一层,种仁达到成熟阶段)。在种仁发育阶段,采集‘串枝红‘骆驼黄Ⅰ、Ⅱ时期的种皮、Ⅲ时期的种皮和子叶、Ⅳ时期的子叶,共计10 个样品,每个样品3 次重复,切成小块,立即放入液氮中速冻,存于-80 ℃冰箱,用于后续RNA 提取及酵母文库构建。在新叶生长期,采集幼嫩叶片用于后续DNA 提取及基因启动子克隆。
試验中涉及的RNA 提取(Trizol)、纯化(Oligotex mRNA Midi Kit)、cDNA 反转录、质粒提取等所需的各类试剂购自Invitrogen 和Qiagen 公司。酵母文库构建中所用载体pAbAi及pGADT7、酵母菌株Y187、酵母单杂交菌株Y1HGold由上海欧易生物医学科技有限公司提供。载体构建所需要的引物合成和测序由生工生物公司和华大基因完成。用于酵母自激活抑制的金担子素A、酵母培养所需的各类培养基购自Clontech公司,各种工具酶、Marker 购自TaKaRa 公司。其他常规试剂耗材购自北京欣汇天东方科技有限公司。
1.2 方 法
1.2.1 杏仁总RNA 的提取与mRNA 的分离纯化
采用Trizol 法提取‘串枝红‘骆驼黄杏仁不同发育时期种皮及子叶的RNA,经Qiagen 的纯化试剂盒分离纯化mRNA,利用电泳观察特征条带后,将10 个样品等比例混合形成混样,利用NanoDrop 微量分光光度计检测混合纯化产物的OD 值和RIN 值。
1.2.2 杏仁核体系酵母cDNA 文库的构建
采用Gateway 位点特异性重组技术, 参照Cloneminer cDNA library construction kit 试剂盒说明书进行杏仁核体系酵母cDNA 文库构建。将分离纯化得到mRNA,再经反转录为双链cDNA(dscDNA),经连接重组反应后,获得4 mL 初级文库菌液。提取初级文库质粒,稀释浓度到300 ng/μL后再经重组反应获得次级文库。筛库时,活化扩繁酵母次级文库,并提取质粒转化到酵母感受态细胞Y187 中进行后续试验。
1.2.3 酵母初级、次级文库的质量鉴定
参照赵彩良等[29] 的方法对构建的酵母初级文库和次级文库进行质量鉴定。将酵母初级文库、次级文库菌液各10 μL 稀释100 倍后,取其中50 μL 涂布在含卡那霉素(浓度:50 μg·mL-1)的LB 固体培养基上,对平板上长出的单克隆进行计数,计算库容量和总库容。计算公式为:库容量= 单克隆数/ 涂布体积× 稀释倍数= 单克隆数/50 μL×100×1 000(CFU·mL-1),4 mL 文库菌液的总库容= 库容量× 总体积= 库容量×4(CFU)。同时,对初级文库和次级文库随机挑取24 个单克隆, 利用通用引物M13,pGADT7分别进行扩增,PCR 产物经1% 琼脂糖凝胶电泳后鉴定文库质量。初级文库鉴定引物(M13通用引物,F:GTAAAACGACGGCCAG,R:CAGGAAACAGCTATGAC),次级文库鉴定引物(pGADT7-DEST 载体引物,F:TAATACGACTCACTATAGGGCGAGCGCCGCCATG,R:GTGAACTTGCGGGGTTTTTCAGTATCTACGATT)。
1.2.4PaCYP79 启动子的克隆与诱饵载体pAbAi-PaCYP79p 的构建
PaCYP79 启动子序列选取杏基因组中PaCYP79(NCBI 中PaCYP79 基因登录号:OL321787) 基因起始密码子上游1 674 bp。根据所提取的序列设计PaCYP79 启动子的扩增引物(CYP79-Pro-F:ACAATGATCAGTGCAAGATTTG;CYP79-Pro-R:GACTGCACGAGTAGAAAA)。提取杏基因组DNA,克隆得到PaCYP79基因的启动子并测序。利用启动子分析在线软件PlantCARE(网址:http://bioinformatics.psb. ugent.be/webtools/plantcare/html/)预测该启动子序列上的顺式作用元件。
采用双酶切的方法构建诱饵载体pAbAi-PaCYP79p。诱饵序列(PaCYP79 启动子)两端加入酶切位点Sal I 和Xho I。用Sal I 和Xho I 双酶切pAbAi 质粒,得到纯化的线性化pAbAi 片段后与加了酶切位点的PaCYP79 启动子片段进行连接反应,经氨苄青霉素(浓度:100 μg·mL-1)的抗性筛选,获得阳性单克隆。经Sal I 和Xho I双酶切和测序验证(测序引物F:GTTCCTTATATGTAGCTTTCGACAT),获得构建好的诱饵载体pAbAi-PaCYP79p。
1.2.5 诱饵载体pAbAi-PaCYP79p 转化Y1HGold酵母菌株
采用LiAC/PEG 法将诱饵载体pAbAi-PaCYP79p 转化到酵母Y1HGold 菌株中(方法参照Clontech 产品说明书)。用Bst BI 酶对诱饵质粒pAbAi-PaCYP79p 进行单酶切,并纯化酶切产物。取1 μg 线性化诱饵质粒pAbAi-PaCYP79p 转化至酵母感受态Y1HGold 中,并在SD/-Ura 缺陷培养基上培养2 ~ 3 d 后进行筛选,利用PCR 鉴定转化成功的阳性单克隆。
1.2.6 金担子素(Aureobasidin A, AbA) 抗性筛选
参照余婧等[30] 的方法,对实验中需要的ABA抗性进行筛选和确定。将500 μL 转化成功的含有pAbAi-PaCYP79p 的阳性Y1HGold 菌液,稀释至浓度达到OD600=0.002 时,涂布到含有不同浓度梯度的AbA的SD/-Ura 平板上,AbA浓度分别为0,100,150,200,300,500,700,900 ng/mL。观察不同平板上单克隆的生长状况,如果在某个浓度下阳性克隆的自激活可得到抑制,无法正常生长,则可以确定该AbA 浓度及以上可以用于后续筛选试验。
1.2.7 杏仁cDNA 酵母文库的筛选
参照Clontech 公司的MatchmakerTM LibraryConstruction&Screening Kit 试剂盒说明书,对杏仁cDNA 酵母文库进行筛选。取10 μg 酵母文库质粒,转化到1.2.5 含有诱饵载体pAbAi-PaCYP79p的Y1HGold 酵母菌液中,按照10、102、103 倍稀释后,涂布于SD/-Leu 缺陷培养基上进行筛选,统计平板上单克隆数,计算酵母文库筛选总克隆数CFU=[ 平板上单克隆数]×[ 稀释倍数]×[ 重悬体积(6 mL)],酵母文库转化效率CFU/μg=文库总克隆数/ 酵母文库质量(10 μg)。剩余菌液涂布于SD/-Leu/AbA(AbA 添加量为1.2.6 中筛选的浓度) 平板, 待SD/-Leu/AbA 平板长出单克隆后,初筛完成。将初筛板上长出的阳性克隆再次转移到SD/-Leu/AbA 平板上, 进行二次筛选。挑取单菌落进行PCR 鉴定(T7 通用引物,F:TAATACGACTCACTATAGGGC 和R:GTAGATGGTGCACGATGCACAG), 测序获得将阳性克隆的序列,通过uniprot(网址:https://www.uniprot.org/)和NCBI 数据库(网址:https://www.ncbi.nlm.nih.gov/)獲取该序列的注释信息和蛋白功能预测。
1.2.8 筛选阳性克隆与诱饵载体单杂交验证
将1.2.7 中获得的阳性克隆的酵母质粒DNA与诱饵载体pAbAi-PaCYP79p 共转Y1HGold 酵母感受态细胞,涂布在SD/-Leu/AbA 筛选培养基上进行酵母单杂交验证(抗性筛选板的AbA 添加量不低于1.2.6 筛选的ABA 浓度),观察酵母生长情况,参照刘振宁等[31] 的方法验证诱饵质粒与蛋白的互作。
2 结果与分析
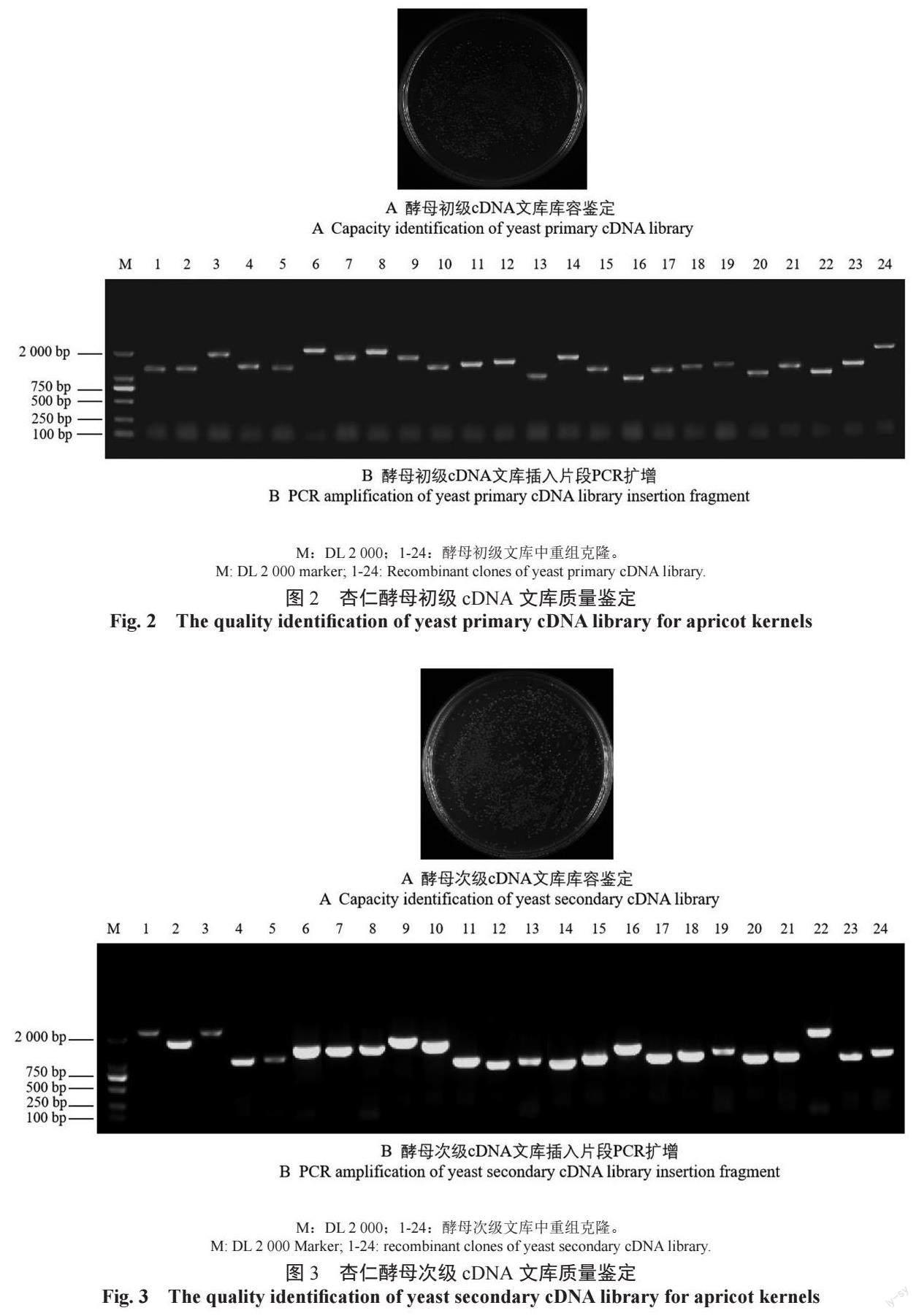
2.1 杏仁酵母初级cDNA 文库构建
RNA 的完整度与稳定性是构建cDNA 文库的关键。提取杏仁不同发育时期的RNA,取2 μL 进行电泳检测,结果(图1A)具有RNA 的两条特征条带。将所有10 个样品等比例混合后检测总RNA 的OD260 nm/OD280 nm 值为2.11,RIN 值(RNA integrity number)为9.0。将总RNA 进行分离纯化和反转录分别获得mRNA(图1B)和双链cDNA(图1C),电泳结果均呈现弥散条带,且ds cDNA 主要片段大于1 000 bp。以上结果表明,所提取的总RNA和反转录获得的cDNA质量良好,可用于后续酵母文库构建。
2.2 杏仁酵母初级cDNA 文库质量评估
统计初级文库涂布在平板上长出的单克隆数为1 300 个(图2A),初级文库库容量= 平板上的克隆数/50 μL×100×1 000 μL=1 300/50 μL×100×1 000 μL=2.6×106 CFU/mL,4 mL 总库容=2.6×106×4=1.04×107 CFU,大于106(标准文库的质量)。对随机挑取的24 个单克隆进行PCR 检测,结果表明,文库重组率达100%,插入的片段也都为大于1 000 bp 的有效片段(图2B)。
2.3 杏仁酵母核体系次级文库的构建及质量评估
统计次级文库涂布在平板上长出的单克隆数为1 500 个(图3A),次级文库库容量= 平板上的克隆数/50 μL×100×1 000 μL=1 500/50 μL×100×1 000 μL=3.0×106 CFU/mL。总库容=3.0×106×4=1.2×107 CFU。从次级文库中随机挑取的24 个单克隆进行PCR 检测,均获得了清晰条带,次级文库重组率达100%,插入的片段范围800 ~2 000 bp 有效片段所占比例较大(图3B)。由此可见,本研究构建的杏仁cDNA 文库质量较高,可用于酵母文库的筛选,为进一步开展杏仁中苦杏仁苷合成关键基因的挖掘及杏仁甜苦分子调控机制的深入研究奠定了基础。
2.4PaCYP79 基因启动子的克隆及序列分析
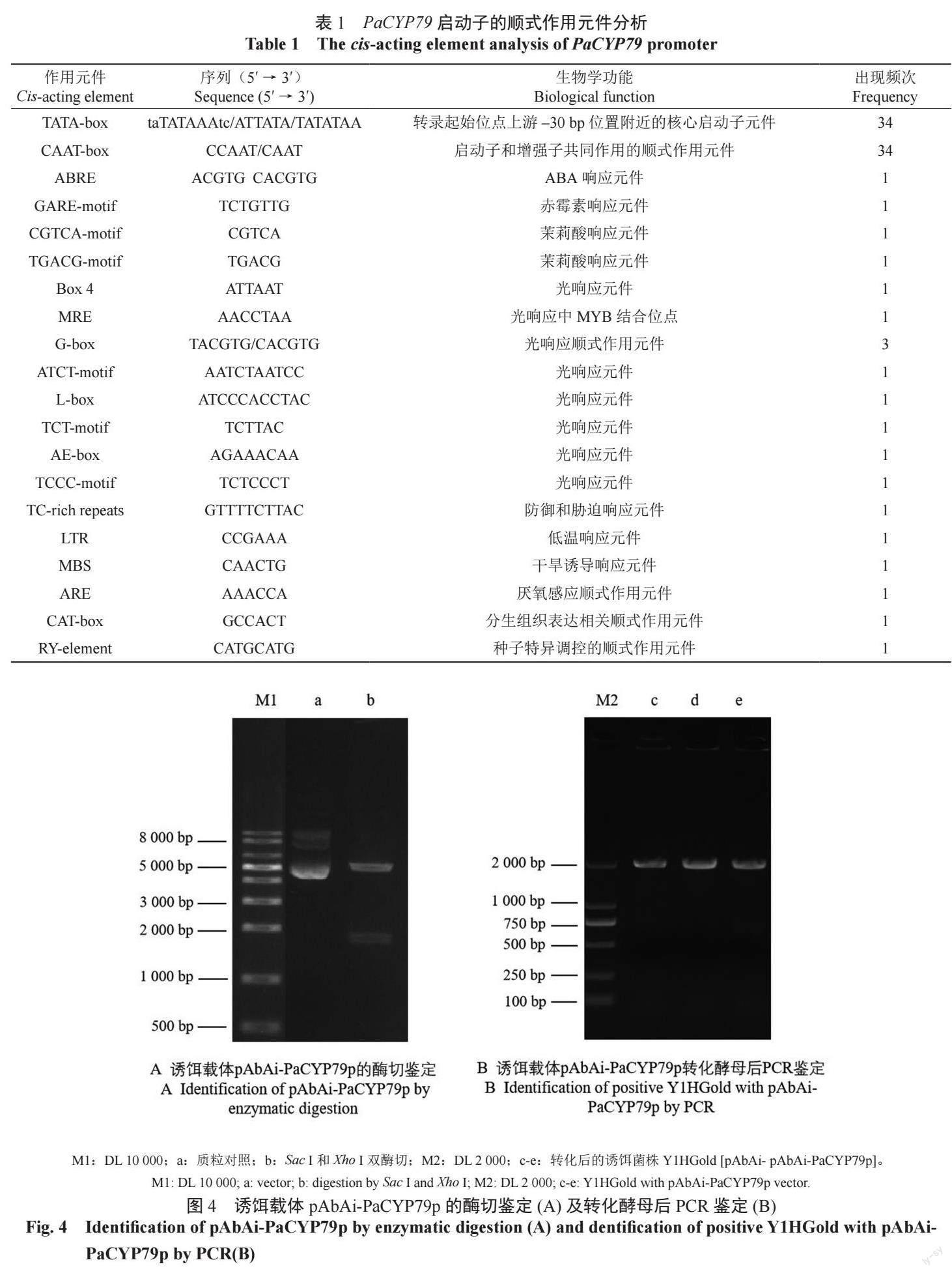
启动子分析表明,PaCYP79 启动子序列中含有多个植物的组成型核心启动子顺式作用元件,如TATA-box 和CAAT-box;还含有ABA、赤霉素、茉莉酸等多种植物激素的响应元件, 如ABRE、GARE-motif、CGTCA-motif、TGACG-motif; 光响应元件Box 4、MRE、G-box、ATCT-motif、L-box、TCT-motif、AE-box、TCCC-motif;响应环境胁迫的元件TC-rich repeats、LTR、MBS、ARE;参与分生组织发育的CAT-box 及种子特异调控的RYelement等顺式作用元件(表1)。
2.5 诱饵载体的构建、转化酵母及鉴定
将PaCYP79 基因启动子的序列(1686 bp)连接到诱饵载体pAbAi 上,利用Sac I 和Xho I 双酶切验证诱饵载体pAbAi-PaCYP79p 构建成功,目的片段为1.7 kb(图4A)。用BstBI 单酶切诱饵载体,转化Y1HGold 酵母感受态细胞,涂平板培养3 天后,挑取生长健康的单菌落,经PCR 扩增目的片段,预期阳性克隆目的条带大小应为397+1686 bp。琼脂糖凝胶电泳结果显示(图4B),诱饵载体pAbAi-PaCYP79p 转化酵母Y1HGold 菌株后的阳性克隆目的条带大小约为2 000 bp,与预期片段大小相近,进一步测序验证,确定诱饵载体pAbAi-PaCYP79p 成功转入到酵母菌株中。
2.6 抑制诱饵酵母自激活的AbA 浓度筛选
AbA 抗性测定结果显示, 诱饵酵母菌株Y1HGold 在含有0、100、150、200 ng·mL-1AbA的SD/-Ura 平板上生长良好(图5),而在含有浓度为300 ng·mL-1AbA 及以上的SD/-Ura 平板上停止生长(图6),说明AbA 浓度在300 ng·mL-1以上即可用于酵母单杂交筛选,本实验中选取300 ng·mL-1 用于后续的酵母单杂交筛选实验。
2.7PaCYP79 启动子片段与杏仁cDNA 文库的酵母单杂交筛选及互作验证
将构建好的杏仁cDNA 酵母文库质粒转化诱饵菌株Y1HGlod [pAbAi-PaCYP79p] 稀释1 000 倍后的菌液涂布在SD/-Leu 平板上,统计单克隆数量为35,筛选克隆总数=35/100 μL×1 000×6 mL=2.1×106 CFU,文库转化效率CFU/μg= 文库总克隆数/ 酵母文库质量(10 μg)=2.1×105 CFU/μg。表明杏仁cDNA 酵母文库的转化效率符合文库筛选要求(大于1×105 CFU/μg)。
酵母转化产物在含300 ng·mL-1 AbA 的SD/-Leu的培养基上培养3 ~ 5 d,初筛获得43 个阳性单克隆菌落,将pAbAi-PaCYP79p 初筛获得的阳性单克隆菌落再次转移到SD/-Leu/AbA(400 ng/mL)筛选平板上,进行二次筛选,共获得41 个候选阳性单克隆菌落(图7A)。提取质粒测序得到对应的序列,并结合NCBI 和uniprot 数据库进行序列比对和蛋白功能注释,排除文库构建时由于核酸移码突变造成的假阳性克隆,合并重复序列,鑒定得到10 个候选的可编码不同的蛋白基因序列,具体信息见表2。提取10 个候选阳性克隆的酵母质粒DNA与诱饵载体pAbAi-PaCYP79p 共转Y1HGold 酵母感受态细胞,涂布在SD/-Leu/AbA(500 ng/mL)筛选培养基上进行酵母单杂交验证,这10 个候选基因与诱饵载体pAbAi-PaCYP79p 共转Y1HGold酵母菌均可在SD/-Leu/AbA(500 ng/mL) 平板上正常生长(图7B),说明这些蛋白可以激活PaCYP79 启动子。
3 讨 论
构建高质量的杏仁cDNA 文库,是后续利用酵母文库筛选互作蛋白的重要前提[32]。本试验中用于酵母文库构建的RNA 样品取自‘串枝红‘骆驼黄杏仁不同发育时期的种皮和子叶,包含了尽量多的转录本信息。提取的杏仁发育时期总RNA 的RIN 值9.0,经mRNA 分离纯化后,反转录获得双链cDNA 条带呈弥散分布,符合文库构建对其纯度和完整性的要求。本研究中用于筛选的酵母次级文库容量为1.2×107 CFU,插入片段均在1 000 bp 以上,重组率为100%,覆盖度和完整性良好,可用于后续苦杏仁苷合成路径调控基因的筛选研究。
利用诱饵载体pAbAi-PaCYP79p 对构建好的杏仁cDNA 酵母文库进行单杂交筛选,获得10 个可能与苦杏仁苷合成路径关键基因PaCYP79 启动子互作的候选蛋白。对这10 个蛋白的基因序列在NCBI 和uniprot 数据库进行序列比对和蛋白功能注释,结果显示,其中5 个比对到有功能注释的蛋白,另外5 个功能未知的新蛋白。其中包括淀粉样蛋白聚集和蛋白毒性的正调控相关的small EDRKrichfactor 2(SERF2)蛋白[33-34],与种子发育和萌发调控相关的蛋白seed biotin-containing proteinSBP65[35],与参与控制纤维素微原纤维定向沉积调控的类运动蛋白kinesin-like protein KIN-4C[36],60S核糖体蛋白L19-2(60S ribosomal protein L19-2),聚腺苷结合蛋白2 亚型X1(polyadenylate-bindingprotein 2 isoform X1),以及5 个未知功能的蛋白。酵母单杂交进一步证实这10 个蛋白能与PaCYP79启动子结合,为深入研究杏仁苦杏仁苷合成与调控的通路奠定基础。
对SERF2 蛋白的研究与应用主要集中在医学方面。SERF2 蛋白最初被分离出来是用于亨廷顿病、帕金森病和阿尔茨海默病等疾病的研究,纯化的SERF2 蛋白在体外加速了这些疾病中相关的淀粉样蛋白的形成[33]。同时,SERF2 是一种高度保守的蛋白质,在体外修饰淀粉样纤维组装并促进蛋白质错误折叠,在调节与年龄相关的蛋白质毒性中具有一定作用[34]。苦杏仁苷在适宜的浓度范围对于抗肿瘤、抗器官纤维化、抗动脉粥样硬化等方面能发挥显著作用,但是过量食用则会由于苦杏仁苷分解产生的氢氰酸(HCN)而中毒[37-38]。PaCYP79 是苦杏仁苷合成路径上的起始位置重要限速酶,属于细胞色素P450 家族基因。该基因家族编码的单加氧酶,可参与体内药物代谢的氧化还原反应,在毒性物质和致癌物质代谢过程中发挥重要作用[39]。因此SERF2 蛋白有可能与细胞色素P450 家族基因相互作用,共同参与苦杏仁苷合成代谢的相关路径。
SBP65 基因编码65 kDa 的种子生物素化LEA蛋白(胚胎发育晚期丰富蛋白),且ABA 在种子胚胎发育的特定阶段对SBP65 的表达起特异性调控作用[35]。SBP65 蛋白在豌豆种子发育后期大量积累,并在其突变体(vip-1)中的表达量和蛋白含量水平都很低[32]。SBP65 是LEA 大家族中的一員。而LEA 蛋白在提高种子耐储性、增强植物响应干旱、低温等逆境胁迫的抗性中发挥重要作用[40-41]。拟南芥、玉米、小麦、苜蓿种子中许多与种子耐贮性相关的LEA 蛋白已被鉴定,如拟南芥LEA14,AtLEA3 蛋白,玉米的LEA 蛋白(EMB564),小麦和苜蓿种子的Em 蛋白等[42-45]。此外玉米种子发育过程中的LEA 类蛋白—胚胎蛋白DC-8 在高活力的种子中大量积累,并在种子发育后期的胚胎形成过程中受ABA 的调控[46]。扁桃中CYP79 的表达随着种仁发育进程呈现规律性变化,且在甜、苦仁间的种皮、子叶、胚乳等组织中表现组织表达特异性,并与苦杏仁苷的含量紧密相关[47]。对杏PaCYP79 启动子顺式作用元件分析发现,其启动子上存在种子特异调控的顺式作用元件(RY-element)和ABA 响应元件(ABRE),有可能作为SBP65 蛋白发挥互作的作用位点。
类驱动蛋白KIN-4C 在开花植物中参与沿皮层微管运输含有非纤维素成分的物质[36]。而KIN-4C的同源蛋白KIN-4A 在赤霉素(GA)生物合成途径中起转录激活作用[48]。该蛋白可特异性结合到贝壳杉烯氧化酶2(ent-kaurene oxidase,KO2)启动子的DNA 序列上,通过调节GA 生物合成途径来调控OsKO2 基因表达并介导细胞伸长[48]。贝壳杉烯氧化酶ent-kaurene oxidase(KO)作为细胞色素P450(CYP)701 家族成员,是所有高等植物中参与赤霉素(GA)生物合成所必需的酶[49]。但是细胞色素P450(CYP701)不同家族成员在功能上存在差异,如水稻中有5 个CYP701A 亚家族成员,只有一个(OsKO2/CYP701A6)是GA 生物合成所必需的[50-51]。PaCYP79 启动子上也具有赤霉素响应元件GARE-motif,受GA 的调控,同时与CYP701A6 同为细胞色素P450 蛋白,可能存在相似结构,与类运动蛋白KIN-4C 相结合发挥功能。
酵母单杂交是利用基因启动子与蛋白之间的相互作用来研究基因转录调控的重要实验技术,也是筛选鉴定与启动子特异调控序列相结合的转录因子的有效手段[52]。因此,除了具有高质量的重要发育阶段的杏仁cDNA 文库外,构建含有特异调控DNA 片段的诱饵载体也是筛选转录因子的重要影响因素[53]。为了获得较多的互作蛋白,本研究中所用的酵母单杂交试验的诱饵质粒包含了PaCYP79 起始密码子ATG 上游的1 674 bp 序列。PaCYP79 启动子序列中含有较丰富的元件,不仅包含有ABA、赤霉素等多种植物激素响应元件、光响应、环境胁迫响应的元件,还包含有植物的组成型核心启动子顺式作用元件,以及参与分生组织发育及种子特异调控等的顺式作用元件。此外,还有可能发生互作的未知片段。因此除了筛选到与PaCYP79 互作的可能参与苦杏仁苷合成路径的SERF2,SBP65,KIN-4C 调控因子外,还筛选到调节基础功能的蛋白60S 核糖体蛋白L19-2和聚腺苷结合蛋白2 亚型X1。60S 核糖体蛋白L19-2(60S ribosomal protein L19-2)是大核糖体亚基的组成部分。核糖体是一种大型核蛋白复合体,负责细胞内蛋白质的合成。聚腺苷结合蛋白2 亚型X1(polyadenylate-binding protein 2 isoformX1)参与RNA 结合与多核苷酸腺苷转移酶活性的正调控。两者在基因转录和蛋白形成过程中发挥基础调节功能。
本研究以较长片段而非特异序列的启动子序列为诱饵,利用酵母单杂交技术在杏仁cDNA 酵母文库中筛选并验证到了10 个与PaCYP79 启动子互作的蛋白,因此获得的候选蛋白的特异性还有待验证。与植物相比,利用酵母杂交系统进行DNA 特异序列与转录因子的互作验证,可能缺乏高等生物在转录过程所特有的修饰反应,其在植物细胞中DNA 特异序列与转录因子互作的真实性还需要进一步验证。另外由于酵母杂交自身技术也有可能在实验结果出现少数假阳性和假阴性的现象。针对以上问题,下一步可利用荧光素酶报告基因分析及EMSA 凝胶迁移分析等方法进一步验证SERF2 蛋白,SBP65 蛋白及KIN-4C 蛋白对PaCYP79 转录调控的真实性,结合启动子序列短截或突变等实验来验证其特异互作区段和关键结合位点。对筛选到的其他功能未知的蛋白进行基因功能鉴定,发掘可能参与苦杏仁苷代谢的新基因,以期完善PaCYP79 的功能解析,为深入解析苦杏仁苷合成路径分子调控网络提供参考。
4 结 论
本研究成功构建了高质量的杏仁cDNA 酵母文库,并利用酵母单杂交技术在酵母文库中筛选并验证了10 个与PaCYP79 启动子互作的蛋白。这些互作蛋白的筛选为深入研究杏仁中苦杏仁苷的合成与调控奠定了基础。
参考文献:
[1] 章秋平, 刘威生. 杏种质资源收集、评价与创新利用进展[J].园艺学报,2018,45(9):1642-1660.
ZHANG Q P, LIU W S. Advances of the apricot resourcescollection, evaluation and germplasm enhancement[J]. ActaHorticulturae Sinica,2018,45(9):1642-1660.
[2] 張清安, 张馨允, 冯郁蔺, 等. 甜杏仁分离蛋白的组成及部分理化特性[J]. 中国农业科学,2017,50(13):2564-2575.
ZHANG Q A, ZHANG X Y, FENG Y L, et al. Compositions andphysicochemical properties of sweet almond isolate proteins[J].Scientia Agricultura Sinica,2017,50(13):2564-2575.
[3] 包文泉, 敖敦, 王彦超, 等. 内蒙古西伯利亚杏种子脂肪酸组分的遗传变异[J]. 中南林业科技大学学报,2021,41(5):21-28.
BAO W Q, AO D, WANG Y C, et al. Genetic variation of fatty acidcomponents in seeds ofArmeniaca sibirica in Inner Mongolia[J].Journal of Central South University of Forestry & Technology,2021,41(5):21-28.
[4] 陈俊兴, 包文泉, 敖敦, 等. 西伯利亚杏种仁油脂积累及脂肪酸组分变化规律[J]. 经济林研究,2021,39(1):145-152.
CHEN J X, BAO W Q, AO D, et al. The regularity of attyacid compositions and lipid accumulation changes in kernel ofArmeniaca Sibirica[J]. Non-wood Forest Research,2021,39(1):145-152.
[5] 张清安, 姚建莉. 苦杏仁资源加工与综合利用研究进展[J].中国农业科学,2019,52(19):3430-3447.
ZHANG Q A, YAO J L. State-of-the-art on the processing andcomprehensive utilization of the apricot kernels[J]. ScientiaAgricultura Sinica,2019,52(19):3430-3447.
[6] 黄雪, 图尔荪古丽·吾拉伊木, 郭玲. 新疆南部地区杏种核表型性状与苦杏仁苷含量分析[J]. 经济林研究,2020,38(4):143-151,160.
HUANG X, TUERSUNGULI WULAYIMV, GUO L. Phenotypictraits and amygdalin content of apricot seed kernels in southernXinjiang[J]. Non-wood Forest Research,2020,38(4):143-151,160.
[7] EL-DESOUKY M A, FAHMI A A, ABDELKADER I Y, et al.Anticancer effect of Amygdalin (Vitamin B-17) on hepatocellularcarcinoma cell line (HepG2) in the presence and absence ofZinc[J]. Anti-Cancer Agents in Medicinal Chemistry,2020,20(4):486-494.
[8] ZHANG N, ZHANG Q A, YAO J L, et al. Changes of amygdalinand volatile components of apricot kernels during the ultrasonicallyaccelerateddebitterizing[J]. Ultrasonics Sonochemistry,2019,58:104614.
[9] KANG S H, JUNG H, KIM N. Micellar electrokineticchromatography for the analysis ofD-amygdalin and its epimerin apricot kernel[J]. Journal of Chromatography,2000,866(2):253-259.
[10] H E X Y, WU L J , WA N G W X , e t a l . A m y g d a l i n - Apharmacological and toxicological review[J]. Journal of Ethnopharmacology,2020,254:112717.
[11] S?NCHEZ-P?REZ R, J?RGENSEN K, OLSEN C E, etal. Bitterness in almonds[J]. Plant Physiology,2008,146(3):1040-1052.
[12] DEL CUETO J, MOLLER B L, DICENTA F, et al. beta-Glucosidase activity in almond seeds[J]. Plant Physiology andBiochemistry,2018,126:163-172.
[13] SUELVES M, PUIGDOMENECH P. Molecular cloning of thecDNA coding for the (R)-(+)-mandelonitrile lyase ofPrunusamygdalus: temporal and spatial expression patterns in flowersand mature seeds[J]. Planta,1998,206(3): 388-393.
[14] THODBERG S, DEL CUETO J, MAZZEO R, et al. Elucidationof the amygdalin pathway reveals the metabolic basis of bitterand sweet almonds (Prunus dulcis) [J]. Plant Physiology,2018,178(3):1096-1111.
[15] SWAIN E, LI C P, POULTON J E. Tissue and subcellularlocalization of enzymes catabolizing (R)-amygdalin in maturePrunus serotine seeds[J]. Plant Physiology,1992,100(1):291-300.
[16] SWAIN E, POULTON J E. Immunocytochemical localization ofprunasin hydrolase and mandelonitrile lyase in stems and leavesofPrunus serotina[J]. Plant Physiology,1994,106(4):1285-1291.
[17] S?NCHEZ-P?REZ R, BELMONTE F S, BORCH J, et al.Prunasin hydrolases during fruit development in sweet and bitteralmonds[J]. Plant Physiology,2012,158(4):1916-1932.
[18] YAMAGUCHI T, YAMAMOTO K, ASANO Y. Identificationand characterization of CYP79D16 and CYP71AN24 catalyzingthe first and second steps in L-phenylalanine-derived cyanogenicglycoside biosynthesis in the Japanese apricot,Prunus mumeSieb. et Zucc[J]. Plant Molecular Biology,2014,86:215-223.
[19] 董勝君, 温佳星, 卢彩云, 等. 野杏经济性状SSR 关联分析及优异等位变异挖掘[J]. 经济林研究,2022,40(2):71-82.
DONG S J, WEN J X, LU C Y, et al. Association analysis withSSR markers and mining elite allelic variation of economictraits ofArmeniaca vulgaris[J]. Non-wood Forest Research,2022,40(2):71-82.
[20] JASZCZAK-WILKE E, POLKOWSKA Z, KOPROWSKIM, et al. Amygdalin: toxicity, anticancer activity and analyticalprocedures for its determination in plant seeds[J]. Molecules,2021,26:2253.
[21] KOSTINA K F. Apricot breeding under conditions of USSRsouth[J]. Acta Horticulture,1978,85:190-194.
[22] 陈学森, 吴燕, 陈晓流, 等. 杏杂种一代群体部分性状遗传趋势研究[J]. 中国农业科学,2005,38(9):1863-1868.
CHEN X S, WU Y, CHEN X L, et al. Research on hereditytrend of some characters in F1 progenies of apricot[J]. ScientiaAgricultura Sinica,2005,38(9):1863-1868.
[23] NEGRI P, BASSI D, MAGNANINI E, et al. Bitternessinheritance in apricot (P. armeniaca L.) seeds[J]. Tree GeneticsGenomes,2008,4(4):767-776.
[24] CERVELLATI C, PAETZ C, DONDINI L, et al. A qNMRapproach for bitterness phenotyping and QTL identification inan F1 apricot progeny[J]. Journal of Biotechnololy,2012,159(4):312-319.
[25] LIU M P, DU H Y, ZHU G P, et al. Genetic diversity analysis ofsweet kernel apricot in China based on SSR and ISSR markers[J].Genetics and Molecular Research,2015,14(3):9722-9729.
[26] K A R S AV U R A N, N; C H A R E H S A Z, C E L I K H, et al.Amygdalin in bitter and sweet seeds of apricots[J]. Toxicologicaland Environmental Chemistry,2014,96(10):1564-1570.
[27] BRAUN P, AUBOURG S, VAN LEENE J, et al. Plantprotein interactomes[J]. Annual Review of Plant Biology,2013,64(6):161-187.
[28] 燕麗萍, 吴德军, 王因花, 等. 利用酵母双杂交系统筛选绒毛白蜡FvCAMTA1 互作蛋白[J]. 中南林业科技大学学报,2021,41(12):111-120.
YAN L P, WU D J, WANG Y H, et al. Screening of FvCAMTA1-interactive proteins inFraxinus velutina using yeast two hybridsystem[J]. Journal of Central South University of Forestry &Technology,2021,41(12):111-120.
[29] 赵彩良, 张洁, 唐锐敏, 等. 甘薯块根cDNA 酵母文库的构建及IbNCED3 启动子互作蛋白的筛选鉴定[J]. 山西农业大学学报( 自然科学版),2022,42(4),19-27.
ZHAO C L, ZHANG J, TANG R M, et al. Construction of a yeastcDNA library of sweet potato tuberous root and identificationofIbNCED3 promoter?interacting proteins[J]. Journal ofShanxi Agricultural University (Natural Science Edition),2022,42(4),19-27.
[30] 余婧, 杨慧, 余世洲, 等. 烟草NtCBT 基因启动子酵母单杂诱饵载体构建及互作蛋白筛选[J]. 生物技术通报,2022,38(10):73-79.
YU J, YANG H, YU S Z, et al. Construction of yeast one-hybridbait vector of tobaccoNtCBT gene promoter and screening ofinteracted proteins[J]. Biotechnology bulletin,2022,38(10):73-79.
[31] 刘振宁, 袁黎,Sundaresan V, 等. 拟南芥CKI1 基因上游转录调控因子筛选及鉴定[J]. 遗传,2019,41(5):430-438.
LIU Z N, YUAN L, Sundaresan V, et al. Screening andidentification ofCKI1 upstream transcription regulators inArabidopsis[J]. Hereditas,2019,41(5):430-438.
[32] GAO X H, JIA R Y, WANG M S, et al. Construction andidentification of a cDNA library for use in the yeast two-hybridsystem from duck embryonic fibroblast cells post-infected withduck enteritis virus[J]. Molecular Biology Reports,2014,41(1):467-475.
[33] CLEVERLEY K, LEE W C, MUMFORD P, et al. A novelknockout mouse for the small EDRK-rich factor 2 (Serf2) showingdevelopmental and other deficits[J]. Mammalian Genome,2021,32(2):94-103.
[34] SAHOO B R, BARDWELL J C A. SERF, a family of tiny highlyconserved, highly charged proteins with enigmatic functions[J].The FEBS Journal,2022,1-13.
[35] DEHAYE L, DUVAL M, VIGUIER D, et al. Cloning andexpression of the pea gene encoding SBP65, a seed-specific biotinylated protein[J]. Plant Molecular Biology,1997,35(5):605-621.
[36] KONG Z S, IOKI M, BRAYBROOK S, et al. Kinesin-4 functionsin vesicular transport on cortical microtubules and regulates cellwall mechanics during cell elongation in plants[J]. MolecularPlant,2015,8(7):1011-23.
[37] SHI J M, CHEN Q Q, XU M, et al. Recent updates and futureperspectives about amygdalin as a potential anticancer agent: areview[J]. Cancer Medicine,2019,8(6):3004?3011.
[38] SONG Z Q, XU X H. Advanced research on anti-tumoreffects of amygdalin[J]. Journal of Cancer Research andTherapeutics,2014,10(Suppl 1):3-7.
[39] ESTABROOK R W, MASON J, SIMPSON E R, et al. Theheterologous expression of the cytochromes P450: a newapproach for the study of enzyme activities and regulation[J].Advances in Enzyme Regulation,1991,31:365-383.
[40] ZENG X, LING H, YANG J W, et al. LEA proteins fromGastrodia elata enhance tolerance to low temperature stress inEscherichia coli[J]. Gene,2018,646(5):136-142.
[41] SALLEH F M, EVANS K, GOODALL B, et al. A novelfunction for a redox-related LEA protein (SAG21/AtLEA5) inroot development and biotic stress responses[J]. Plant Cell andEnvironment,2012,35(2):418–429.
[42] HUNDERTMARK M, BUITINK J, LEPRINCE O, et al. Thereduction of seed-specific dehydrins reduces seed longevity inArabidopsis thaliana[J]. Seed Science Research,2011,21(03):165-173.
[43] CHATELAIN E, HUNDERTMARK M, LEPRINCE O, et al.Temporal profiling of the heat-stable proteome during latematuration ofMedicago truncatula seeds identifies a restrictedsubset of late embryogenesis abundant proteins associated withlongevity[J]. Plant Cell and Environment,2012,35(8):1440-1455.
[44] WU X L, LIU H Y, WANG W, et al. Proteomic analysis of seedviability in maize[J]. Acta Physiologiae Plantarum,2011,33(1):181-191.
[45] CHEN X L, YIN G K, B?RNER A, et al. Comparativephysiology and proteomics of two wheat genotypes differing inseed storage tolerance[J]. Plant Physiology and Biochemistry,2018,130:455-463.
[46] WU X L, GONG F P, YANG L, et al. Proteomic analysis revealsdifferential accumulation of small heat shock proteins and lateembryogenesis abundant proteins between ABA-deficient mutantvp5 seeds and wild-typeVp5 seeds in maize[J]. Frontiers in PlantScience,2015,5:801.
[47] S?NCHEZ-P?REZ R, PAVAN S, MAZZEO R, et al. Mutationof a bHLH transcription factor allowed almond domestication[J].Science,2019,364(6445):1095-1098.
[48] LI J, JIANG J F, QIAN Q, et al. Mutation of riceBC12/GDD1, which encodes a kinesin-like protein that binds to a GAbiosynthesis gene promoter, leads to dwarfism with impaired cellelongation[J]. Plant Cell,2011,23(2):628-40.
[49] LI Q F, WANG C, JIANG L, et al. An interaction betweenBZR1 and DELLAs mediates direct signaling crosstalk betweenbrassinosteroids and gibberellins inArabidopsis[J]. ScienceSignaling,2012,5(244):ra72.
[50] WANG Q, HILLWIG M L; WU Y S, et al. CYP701A8: Ariceent-kaurene oxidase paralog diverted to more specializedditerpenoid metabolism[J]. Plant Physiology,2012,158(3):1418-1425.
[51] SAKAMOTO T, MIURA K, ITOH H, et al. An overview ofgibberellin metabolism enzyme genes and their related mutantsin rice[J]. Plant Physiology,2004,134:1642-1653.
[52] LI J J, HERSKOWITZ I. Isolation ofORC6, a component of theyeast origin recognition complex by a one-hybrid system[J]. Science,1993,262(5141):1870-1874.
[53] HICKS J A, PORTER T E. SUNNY N E, et al. Delayed feedingalters transcriptional and post-transcriptional regulation of hepaticmetabolic pathways in peri-hatch broiler chicks[J]. Genes,2019,10(4):272.
[ 本文編校:赵 坤]

