光质对油茶花粉活性和花蕾激素含量的影响
盘鑫海 王肖 葛璐瑶 赫雯琳 杜勤辉 曾艳玲
摘 要:【目的】筛选能提高花粉活性的辅助光源,为进一步深入研究光质调控油茶花粉活性及激素代谢机制提供前期基础和科学依据。【方法】选取树龄3 年长势一致的花芽分化期油茶苗使用不同发光二极管(LED)进行光照处理,光质分别为红光、蓝光、红蓝光、白光和自然光,采用TTC 法和萌发法检测油茶花粉活性,采用高效液相色谱质谱联用技术测定油茶花蕾生长素类激素、分裂素类激素、茉莉酸类激素、水杨酸(SA)、氨基环丙烷羧酸(ACC)和脱落酸(ABA)含量。【结果】不同光质条件下,油茶花粉萌发率和活力存在显著差异,单红光处理显著抑制油茶花粉活性,但红蓝光处理能有效提高油茶花粉活性,蓝光和白光处理也降低了油茶花粉活性。红蓝光处理显著提高了二氢茉莉酸(H2-JA)和氨基环丙烷羧酸的含量。而红光处理显著提高了吲哚乙酸(IAA)的含量,同时显著降低了异戊烯基腺嘌呤(IP)含量。蓝光处理显著提高了吲哚甲醛(ICA)和脱落酸含量,降低了水杨酸和氨基环丙烷羧酸含量。白光处理显著提高了细胞分裂素和脱落酸含量,降低了氨基环丙烷羧酸含量。相关性分析发现吲哚乙酸含量与花粉活性呈显著负相关,氨基环丙烷羧酸含量与花粉活性呈显著正相关。【结论】红蓝光处理能有效提高油茶花粉活性,红光处理通过提高IAA 含量抑制了花粉活性。
關键词:油茶;光质;花粉活性;激素调控
中图分类号:S601;S794.4 文献标志码:A 文章编号:1003—8981(2023)03—0048—09
油茶Camellia oleifera Abel. 山茶科山茶属植物,是我国重要的木本油料树种,种植面积超过400 万hm2,是保障粮油安全的重要组成部分。茶油营养价值高,是深受人们喜爱的保健型食用油,具有较高的经济价值,在山区扶贫和乡村振兴方面发挥着巨大作用[1-2]。茶油来自于茶籽,油茶必须要授粉受精成功才能形成茶籽,而花粉活性正是成功授粉受精的关键之一,花粉活性直接影响到茶油的产量与效益[3]。激素能调控植物体内各种生化活动,能直接影响植物的花粉萌发[4]。而光质可以通过光受体来调控植物基因表达和相关酶活性来影响植物激素含量[5]。有研究发现番茄在蓝光及蓝光占比较大的红蓝光下,其花粉活力显著高于白光和红光[6],而Mostafa 等[7] 发现蓝光可以降低乙烯含量提高脱落酸含量,梅锡玲等[8]发现蓝紫光能提高吲哚乙酸氧化酶的活性,从而降低生长素含量。而生长素、细胞分裂素、脱落酸和赤霉素是影响花粉生长发育的重要激素[9],水杨酸和茉莉酸类激素也能显著影响花粉萌发[10],而光质可以通过影响光敏色素和隐花色素来调控茉莉酸和水杨酸的含量[11]。综上所述,光质可以通过不同方式调节激素含量从而影响花粉活性。
目前,关于光质对油茶生长发育影响的报道已有部分发表。张巧琴等[12] 研究色膜覆盖栽培对油茶生长的影响时发现油茶幼苗较喜红光和蓝紫光,忌黄绿光;油茶的新梢生长要求较弱的光照,且喜红、橙、黄光较多,蓝紫光较少的环境;红、黄、蓝、紫色膜处理过的油茶坐果率和收果率都比未处理的大,并且红、紫色膜中的优越性更大;油茶果实呈现出数量较少但质量较优的趋势,色膜内标准株产量远大于露天的;紫膜可以推迟展叶期,黄膜可以提早开花期,而红、紫膜可以让果实成熟提早。龚洪恩等[13] 研究发现LED 不同光质理下,‘长林4号油茶苗可溶性物质含量、激素水平及抗氧化酶活性差异比较显著。适当比例的红蓝复合光(红光为主或蓝光为主)较单色蓝光或红光更有利于植株整体性能的提高。LED不同光质对油茶组培苗增殖也存在较大影响,红蓝光(4?1)条件下增值系数可达7.33,显著高于单一红光组[14]。目前光质对油茶花粉活性及激素的影响还未得到系统性研究。本研究采用不同光质LED 为油茶提供光源,通过比较分析不同光质下油茶花激素含量和花粉萌发特性,探究光质调控花蕾激素含量和花粉活性的联动效应。
1 材料与方法
1.1 试验材料与设计
试验地点为中南林业科技大学经济林重点实验室植物自然培养室。试验材料为树龄3 年的油茶苗C. oleifera Abel.,品种为‘华硕,种植于直径150 mm、高200 mm 的花盆中,每盆1 株,每组10 株,3 次重复。于2021 年7 月发芽分化盛期置于培养室进行光质处理,光照条件分别为白光(W,450 ~ 700 nm)、蓝光(B,470±10 nm)、红光(R,625±10 nm)、红蓝光(RB,R∶B=1∶1),通过调整光源高度使各处理油茶冠层光量子通量密度(PPFD) 相等, 为200±10 μmol·m?2·s?1,光周期为12 h·d?1(上午8:00—下午8:00),各处理起止时间一致,自然光(NL,作为对照)。于2021 年11 月晴朗上午采集露白花苞,用镊子将花药取下,放在纸盒中均匀摊开,在25 ℃环境下干燥,待花药充分裂开散粉,用离心管收集花粉,当天检测。
1.2 花粉萌发率测定
花粉萌发率的检测参照已发表方法[3],每个处理重复3 次,每个重复观察3 个区域,每个区域中不少于50 粒花粉,以花粉管长度大于花粉直径作为萌发的标准统计萌发率。花粉萌发率(%)=区域内花粉萌发数/ 区域内花粉总数×100。
1.3 花粉生活力测定
采用TTC 法测定花粉生活力[3],TTC 溶液使有活力的花粉变为红色或粉红色。每处理取少量花粉于0.5% 的TTC 溶液中,重复3 次,每重复观察3 个区域,每个区域中不少于50 粒花粉,花粉呈红色或粉红色视为有活力。花粉生活力(%)= 区域内有活力花粉数/ 区域内花粉总数×100。
1.4 油茶花蕾激素含量测定
采用超高效液相色谱质谱联用(UHPLC-MSMS)技术测定油茶花蕾激素含量,将不同处理下油茶露白花苞冻干研磨成粉末,取0.2 g 样品,加入1 000 μL 提取液(体积分数50% 的乙腈水溶液,?40 ℃预冷,含同位素标记内标混合物)涡旋30 s,样本在40 Hz 匀浆4 min,冰水浴条件下超声5 min,重复匀浆超声步骤3 次;样品于4 ℃,13 800×g,离心15 min;取上清液900 μL,氮气吹干,用90 μL 体积分数10% 的乙腈水溶液复溶,涡旋15 s,冰水浴超声5 min,将复溶溶液转移至帯膜的EP 管中;4 ℃,13 800 ×g 离心15 min,取80 μL 上清液进行UHPLC-MS-MS 分析,每处理重复3 次。使用仪器为EXIONLC System(SCIEX)超高效液相色谱仪和SCIEX 6500 QTRAP质谱仪,通过Waters ACQUITY UPLC CSH C18(150 mm×2.1 mm, 1.7 μm)液相色谱柱对目标化合物进行色谱分离,液相色谱A 相为0.01% 的甲酸水溶液,B 相为乙腈,离子源参数为:Curtain Gas=40 psi,IonSpray Voltage=±4 500 V,Temperature=475 ℃,Ion Source Gas 1=30 psi,Ion Source Gas 2=30 psi。
1.5 数据处理
质谱数据采集及目标化合物定量分析工作,通过SCIEX Analyst Work Station Software(Version1.6.3)和Sciex MultiQuant ? 3.0.3 来完成。单因素方差分析和相关性分析采用SPSS 26.0 软件,图片由采用GraphPad Prism 8 和Adobe Illustrator2022 软件制作。
2 结果与分析
2.1 不同光质对油茶花粉活性的影响
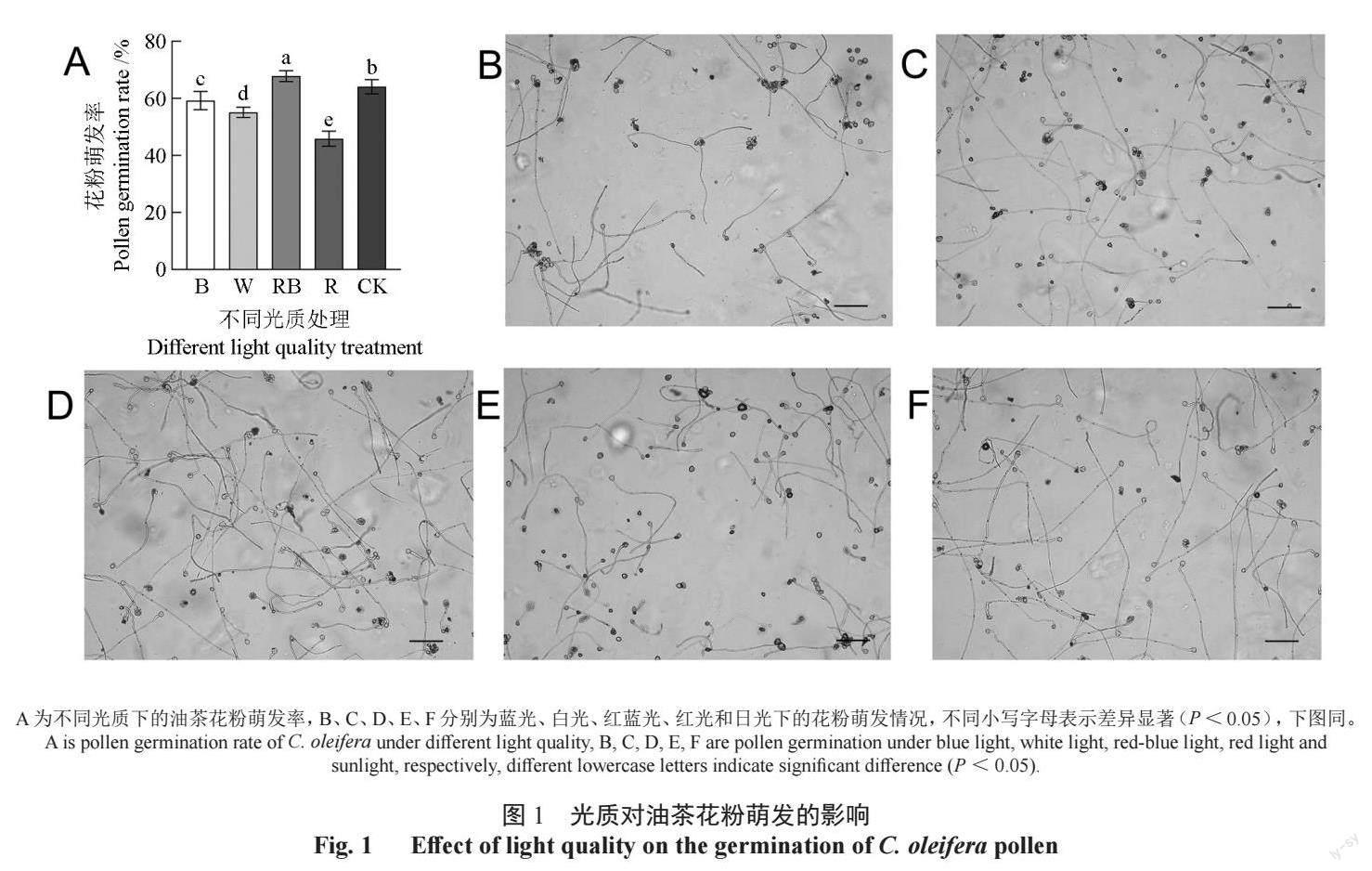
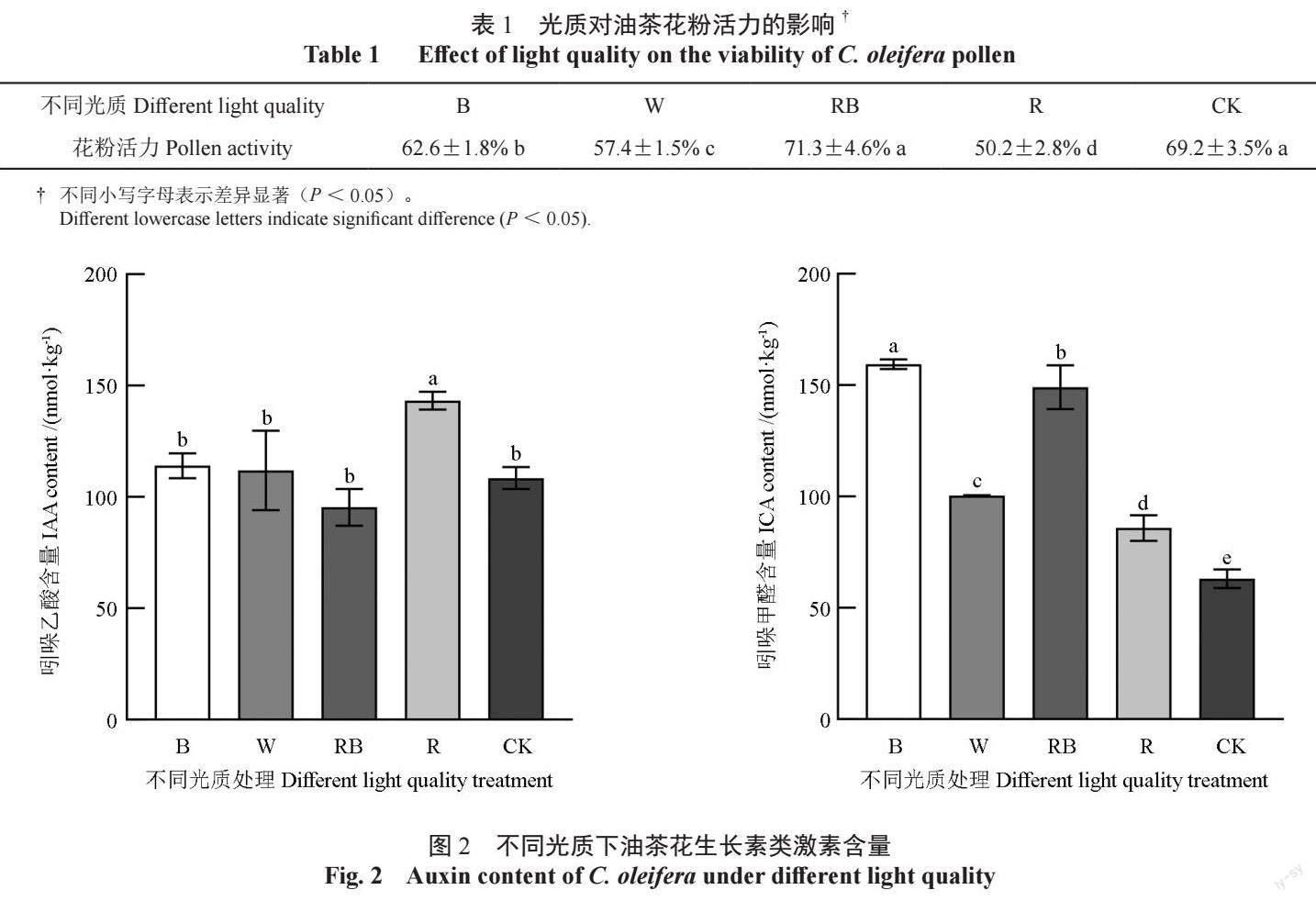
不同光质处理下,油茶花粉萌发率存在显著差异(图1)。在R∶B=1∶1 的红蓝光下,油茶花粉萌发率最高,显著高于其他处理和对照。R 单红光处理中花粉萌发率最低。不同光质下油茶花粉萌发率由高到低为:RB > CK > B > W > R。单色光处理中花粉萌发率均显著低于对照,而红蓝光下油茶花粉萌发率显著高于对照,说明红蓝混合光有利于提高油茶花粉活性,单红光对油茶花粉活性有显著抑制作用。掺入了蓝光份额的白光能略微提高花粉活性,而单蓝光条件下虽然花粉萌发率显著高于白光,但是仍低于红蓝混合光,说明红光能辅助蓝光进一步提高花粉活性。油茶的花粉活力TTC 检测进一步验证了这个结果,红蓝光下油茶花粉活力最高,单色红光下花粉活力最低(表1)。
2.2 光质对油茶花蕾生长素类激素的影响
花粉活性与花蕾尤其是花药中各种激素的变化密切相关。其中植物生长素是一类重要的植物激素,主要由吲哚类衍生物组成,包括吲哚乙酸(IAA)、吲哚甲醛(ICA)、吲哚丁酸(IBA)、吲哚乙腈(IAN)等。本试验主要检测到IAA 和ICA 两种生长激素。结果显示(图2),R 处理下IAA 含量最高且显著高于其他处理,B、W、RB和对照间无显著差异,但相对而言,RB 处理下IAA 含量最低。光质处理对ICA 含量的影响大于IAA,各组均表现出显著差异。所有处理组ICA含量均显著高于对照,B 和RB 处理较高,W 和R处理较低。这说明,单红光促进了IAA 的积累,而蓝光促进了ICA 的积累。
2.3 光质对油茶花蕾细胞分裂素类激素的影响
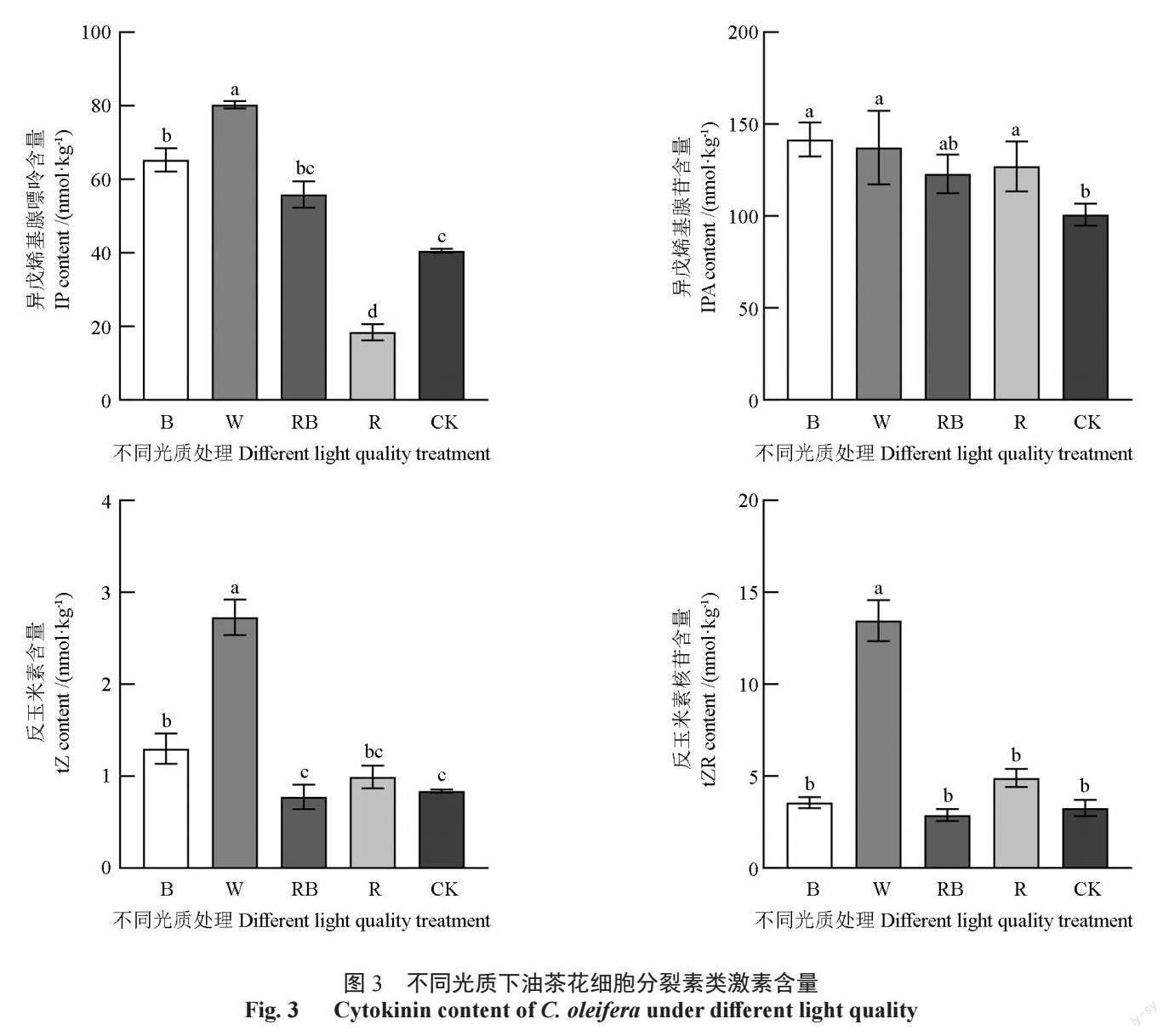
细胞分裂素是腺嘌呤的衍生物,在高等植物中发现的细胞分裂素主要为玉米素和玉米素核苷。本试验主要检测到异戊烯基腺嘌呤(IP)、异戊烯基腺苷(IPA)、反玉米素(tZ)和反玉米素核苷(tZR)4 种细胞分裂素。结果如图3 所示,光质处理对IP 含量的影响最大,含量由高到低为:W > B >RB > CK > R,其中B 和RB 处理IP 含量无显著差异,W、B 和RB 处理IP 含量显著高于对照,而R 处理下IP 含量显著低于对照,说明红光具有抑制IP 合成的作用,同时自然光中还存在除红光之外抑制IP 合成的光质。B、W、RB 和R 处理下IPA 含量无显著差异,但均显著高于对照,说明红、蓝光质均有促进IPA 合成的功能,且蓝光作用更强。不同光质影响tZ 和tZR 含量的规律基本一致,均表现为W 组显著高于其他组,B 和R 组次之,RB和对照组最低,说明W 处理组存在优于单红光和单蓝光促进tZ 和tZR 积累的光质,而自然光中存在抑制其合成的光质。相对而言本试验中的光质tZ 含量影响大于tZR。
2.4 光质对油茶花蕾水杨酸和茉莉酸类激素物质的影响
水杨酸和茉莉酸类激素在植物体内普遍存在,在植物生理反应和基因表达方面发挥着重要的调控作用。本试验主要检测到茉莉酸(JA)、茉莉酸异亮氨酸(JA-Ile)、二氢茉莉酸(H2-JA)和水杨酸(SA)4 种。JA-Ile 是JA 的活性形式,从图4 可以看出不同光质条件下这两种物质的含量差异特征基本一致,由高到低均为:CK > W > B >R > RB,但各组JA 含量差异显著,而B、R 以及RB 组JA-Ile 含量差异不显著,说明红蓝混合光有助于提高茉莉酸的活性。RB 处理下H2-JA 含量显著高于其他处理和对照,W 处理组次高,对照组最低,说明红蓝混合光有促进H2-JA 积累的作用,但是除红光和蓝光以外的自然光中存在抑制H2-JA积累的光质。光质对油茶花蕾中水杨酸含量影响差异显著,SA 含量依次为:CK >W> RB > R > B,其中对照组SA 含量高达13 136.65 nmol·kg?1,说明多混合光质更有利于SA 的积累。
2.5 光质对油茶花蕾氨基环丙烷羧酸和脱落酸的影响
氨基环丙烷羧酸(ACC)是环状氨基酸的一种,可分解产生乙烯,促进成熟。脱落酸(ABA)主要作用是抑制植物生长。本试验检测到ACC 和ABA,在不同光质条件下表现出的含量差异如图5所示,RB 处理ACC 含量最高,与对照无显著差异,但显著高于B、W 和R 处理,B、W 和R 处理间则无显著差异,说明红蓝混合光更有利于ACC 的积累,W 光源中存在部分不同波长的光质会抑制ACC 的积累,如绿光,但在自然光中这种抑制被削弱。B 和W 处理组ABA 含量较高,对照最低,RB 和R 处理组ABA 含量无显著差异,仅高于对照组说明红光有抑制ABA 积累的作用。
2.6 油茶花粉活性與激素含量关联分析
由表2 可知,花粉生活力与花粉萌发率存在极显著正相关性,相关系数为0.984;IAA 含量与花粉生活力和萌发率均存在极显著负相关性,相关系数分别为?0.906 和?0.888;ACC 含量与花粉生活力和萌发率均存在极显著正相关性;IAA 含量与IP、H2-JA 和ACC 含量呈显著负相关;ICA含量与JA 和SA 含量存在极显著负相关性,相关系数分别为?0.674 和?0.743;IP 含量与tZ、tZR、H2-JA 和ABA 含量呈极显著正相关;IPA 含量与JA-Ile 和SA 含量呈显著负相关,与ABA 含量呈显著正相关;tZ 含量与tZR 含量和ABA 含量存在显著正相关性;JA 含量与JA-Ile 含量和SA含量呈显著正相关;JA-Ile 含量和SA 含量存在极显著正相关性,相关系数达0.922。综上所述,花粉活性由多种激素共同影响,其中较高含量的IAA 抑制花粉活性,而较高含量的ACC 促进花粉萌发,其他激素相互影响共同作用于花粉萌发。
3 结论与讨论
本研究通过对不同光质下油茶花粉活性和激素含量的研究发现红蓝混合光质条件下油茶花粉活性明显提升。相关性结果显示,花粉活性与ACC 含量呈显著正相关,而与IAA 含量呈显著负相关。说明红蓝光下油茶花蕾生长素和细胞分裂素含量适中,且具有较高的H2-JA 和ACC 含量,能显著提高油茶花粉活性,红光条件下较低的细胞分裂素含量导致油茶花粉活性大幅降低,蓝光条件下ABA 含量过高同样也导致油茶花粉活性降低,白光条件下导致花粉活性的降低的主要原因则是细胞分裂素和脱落酸含量过高。
生长素类激素在植物体中广泛参与生长发育等各种生命活动,是最重要的植物激素之一[15]。有研究发现红光能增加植物顶部IAA 合成和极性运输[16],而蓝光能提高吲哚乙酸氧化酶活性从而降低IAA 含量[8],还有研究发现较低含量的IAA和较高含量的ABA 有利于油茶雄蕊的成熟[17]。本研究结果也表现出红光条件下油茶花蕾IAA 含量高,而蓝光条件下IAA 含量低。吲哚乙醛ICA是IAA 的氧化产物,本研究发现蓝光和红蓝光下ICA 含量较高, 说明蓝光确实通过提高吲哚乙酸氧化酶活性使IAA 转化为ICA。本研究结果表明IAA 含量与花粉活性呈负相关,这在百合[18]、辣椒[19] 等植物中也有相同报道,这可能是雄配子体发育过程中激素平衡失调所导致的。
细胞分裂素类激素是一系列腺嘌呤衍生物,主要包括异戊烯基腺嘌呤IP 和玉米素Z,其中玉米素是生物活性最强的细胞分裂素,异戊烯基腺苷IPA 和玉米素核苷tZR 分别是IP 和tZ 的合成前体[20]。本研究结果也显示IP 含量与tZ、tZR 含量呈极显著正相关。白光下油茶花蕾IP 含量最高,红光下最低,说明红光不利于IP 积累,但红光下IPA 含量与处理组间无显著差异,说明红光没有抑制IPA 的合成和转化,可能是红光具有促进IP 分解的功能,这在水稻[21] 中也有报道。白光IP 含量显著高于其他处理而IPA 含量差异不显著,说明白光抑制了IP 的分解。白光下tZ 和tZR 含量均显著高于其他处理,说明白光通过促进tZR 的合成提高了玉米素含量。大部分报道中活力较低的花粉中细胞分裂素含量较低 [4],但也有研究发现较低含量的细胞分裂素促进雄蕊发育[22]。在本试验中红光下花粉活性最低可能与IP 含量最低有关,白光下细胞分裂素含量最高但花粉活性较低,这可能是因为白光条件下油茶花蕾积累的细胞分裂素含量过高,反而抑制了花粉活性。
茉莉酸类激素在植物生殖器官发育过程中有重要作用,拟南芥的茉莉素缺失突变体表现为花粉不育[23],而喷施一定浓度的茉莉酸类生长调节剂可使育性得到一定恢复[24],但正常花粉在茉莉酸类生长调节剂处理下常表现出活力下降[22]。在本试验油茶花蕾茉莉酸类物质中JA 的形式占绝大部分,其中自然光对照组JA 含量最高,红蓝光下含量最低,而红蓝光下花粉活性高于對照,可能是因为红蓝光下H2-JA 含量显著高于对照组提高了花粉活性。水杨酸SA 同样是影响花粉萌发的重要激素,Lu 等[25] 发现较低浓度的SA 能显著提高油茶花粉萌发率。本试验中蓝光下SA 含量显著低于其他处理和对照,但蓝光下花粉活性低于对照组,这可能与其他激素共同作用有关。
氨基环丙烷羧酸ACC 是乙烯的合成前体,且乙烯合成主要限制因素是ACC合成酶的生成速率,所以ACC 含量与乙烯含量呈正相关[26]。在本试验中红蓝光和对照中ACC含量显著高于其他处理组,而红蓝光和对照中花粉活性也显著高于其他处理,说明乙烯有利于花粉的成熟和萌发。脱落酸ABA在大部分报道中都与花粉活性呈负相关,如冬瓜[4]、百合[17] 等。有研究表明蓝光处理可以通过下调乙烯生物合成基因DcACS、DcACO 表达和上调ABA 生物合成基因DcZEP1 和DcNCED1 表达降低乙烯含量而提高ABA 含量从而延长康乃馨花瓶插瓶寿命[7]。在本研究中蓝光下ABA 含量显著高于其他处理和对照组,且乙烯前体ACC 含量也显著低于红蓝光组和对照组,这与前人研究结果一致。但是蓝光条件下花粉活性显著低于红蓝光和对照组,说明ABA 含量过高会抑制油茶花粉活性。本研究主要对不同光质下油茶花粉活性和激素含量进行了研究,主要集中在生理指标的变化和生理机制上,下一步需要对光质影响哪些基因表达和酶活性变化等方面进行研究,深入探究光质影响油茶花粉活性的分子机制。
参考文献:
[1] 王金凤, 谭新建, 吴喜昌, 等. 我国油茶产业发展现状与对策建议[J]. 世界林业研究,2020,33(6):80-85.
WANG J F, TAN X J, WU X C, et al. Development status andsuggestions of camellia industry in China[J]. World ForestryResearch,2020,33(6):80-85.
[2] 谭晓风. 油茶分子育种研究进展[J]. 中南林业科技大学学报,2023,43(1):1-24.
TAN X F. Advances in the molecular breeding ofCamelliaoleifera[J]. Journal of Central South University of Forestry &Technology,2023,43(1):1-24.
[3] 王湘南, 陈永忠, 王瑞, 等. 不同种源油茶良种花粉生活力研究[J]. 中南林业科技大学学报,2016,36(12):1-5.
WANG X N, CHEN Y Z, WANG R, et al. Study on pollen viabilityofCamellia oleifera improved varieties from different species[J].Journal of Central South University of Forestry & Technology,2016,36(12):1-5.
[4] 万正林, 周艳霞, 邓俭英, 等. 内源激素对同源四倍体黑皮冬瓜自交花粉萌发生长的影响[J]. 华南农业大学学报,2018,39(1):57-63.
WAN Z L, ZHOU Y X, DENG J Y, et al. Effects of endogenoushormones on pollen germination and growth of autotetraploid blackwax gourd[J]. Journal of South China Agricultural University,2018,39(1):57-63.
[5] 王海波, 王帅, 王孝娣, 等. 光质对设施葡萄叶片衰老与内源激素含量的影响[J]. 应用生态学报,2017,28(11):3535-3543.
WANG H B, WANG S, WANG X D, et al. Effects of lightquality on leaf senescence and endogenous hormones contentin grapevine under protected cultivation[J]. China Journal ofApplied Ecology,2017,28(11):3535-3543.
[6] 刘晓英.LED光源对樱桃番茄生育和光合作用影响的研究[D].南京: 南京农业大学,2010.
LIU X Y. Studies for effect of LED light on growth anddevelopment, photosynthesis of cherry tomato seedlings[D].Nanjing: Nanjing Agricultural University,2010.
[7] MOSTAFA A, SASAN A, MOSTAFA A, et al. Blue lightpostpones senescence of carnation flowers through regulationof ethylene and abscisic acid pathway-related genes[J]. PlantPhysiology and Biochemistry,2020,151:103-112.
[8] 梅锡玲, 赵洲, 陈向东, 等. 光质对灵芝菌丝体生长及内源IAA 代谢调控的研究[J]. 中国中药杂志,2013,38(12):1887-1892.
MEI X L, ZHAO Z, CHEN X D, et al. Light quality regulation ofgrowth and endogenous IAA metabolism ofGanoderma lucidummycelium[J]. China Journal of Chinese Materia Medica,2013,38(12):1887-1892.
[9] ZAVESKA D, POKORNA E, DOBREV P I, et al. Hormonomedynamics during microgametogenesis in different nicotianaspecies[J]. Frontiers in Plant Science,2021,12:735451.
[10] RONG D Y, LUO N, JEAN C M, et al. Salicylic acid regulatespollen tip growth through an NPR3/NPR4-independentpathway[J]. Molecular Plant,2016,9(11):1478-1491.
[11] 楊有新, 王峰, 蔡加星, 等. 光质和光敏色素在植物逆境响应中的作用研究进展[J]. 园艺学报,2014,41(9):1861-1872.
YANG Y X, WANG F, CAI J X, et al. Recent advances inthe role of light quality and phytochrome in plant defenseresistance against environmental stresses[J]. Acta HorticulturaeSinica,2014,41(9):1861-1872.
[12] 张巧琴, 陈永密, 邓军辉, 等. 色膜棚复盖栽培对油茶生长的影响[J]. 中南林学院学报,1987,7:1-8.
ZHANG Q Q, CHEN Y M, DENG J H, et al. Effect of thecoloured plastic film shed on the growth of the oil tea trees[J].Journal of Central South University of Forestry & Technology,1987,7:1-8.
[13] 龚洪恩, 吴鹏飞, 姚小华, 等.LED 光质对油茶苗生理生化特性的影响[J]. 甘肃农业大学学报,2018,53(5):52-57.
GONG H E, WU P F, YAO X H, et al. Effect of LED lighton physiological and biochemical characteristics ofCamelliaoleifera seedlings[J]. Journal of Gansu Agricultural University,2018,53(5):52-57.
[14] HE C Y, ZENG Y L, FU Y Z, et al. Light quality affects theproliferation of in vitro cultured plantlets ofCamellia oleiferaHuajin[J]. Peerj,2020,8:e10016.
[15] LYU B S, ZHU J Y, KONG X P, et al. Light participates inthe auxin-dependent regulation of plant growth[J]. Journal ofIntegrative Plant Biology,2021,63(5):819-822.
[16] LIU X, COHEN J D, GARDNER G. Low-fluence red light increasesthe transport and biosynthesis of auxin[J]. Plant Physiology,2011,157(2):891-904.
[17] 黄润生, 张晖, 廖柏勇, 等. 油茶花芽分化后期内源激素与代谢组学差异分析[J]. 经济林研究,2021,39(3):99-113,155.
HUANG R S, ZHANG H, LIAO B Y, et al. Difference analysisof endogenous hormones and metabolomics in the late stage offlower buds differentiation ofCamellia oleifera[J]. Non-wood Forest Research,2021,39(3):99-113,155.
[18] 贾文杰, 郑洁, 崔光芬, 等. 百合育性与花药发育过程中激素和内源物质含量及能量代谢酶活性的关系[J]. 西北植物学报,2019,39(3):480-488.
JIA W J, ZHENG J, CUI G F, et al. Relationship betweenLiliumfertility and hormone, endogenous substances content, energymetabolizing enzyme activity during anther development[J]. ActaBotanica Boreali-Occidentalia Sinica ,2019,39(3):480-488.
[19] 吴智明, 胡开林, 符积钦, 等. 辣椒胞质雄性不育与花蕾内源激素含量的关系[J]. 华南农业大学学报,2010,31(2):1-4.
WU Z M, HU K L, FU J Q, et al. Relationship between cytoplasmicmale sterility and endogenous hormone content of pepper bud[J].Journal of South China Agricultural University,2010,31(2):1-4.
[20] SAKAKIBARA H. Cytokinins: activity, biosynthesis, andtranslocation[J]. Annual Review of Plant Biology,2006,57:431-439.
[21] ROY A, SAHOO D, TRIPATHY B C. Light-hormone interactionin the red-light-induced suppression of photomorphogenesis inrice seedlings[J]. Protoplasma,2016,253(2):393-402.
[22] 庆 军, 朱利利, 杜红岩. 杜仲雌雄花发育与内源激素含量动态变化的关系[J]. 中南林业科技大學学报,2021,41(4):58-65.
QING J, ZHU L L, DU H Y. Flower bud differentiation and dynamicchanges of endogenous hormone inEucommia ulmoides[J].Journal of Central South University of Forestry & Technology,2021,41(4):58-65.
[23] JEWELL J B, BROWSE J. Epidermal jasmonate perception issufficient for all aspects of jasmonate-mediated male fertility inArabidopsis[J]. Plant Journal,2016,85(5):634-647.
[24] HE Y, LIU C, ZHU L, et al. Jasmonic acid plays a pivotal rolein pollen development and fertility regulation in different typesof P(T)GMS rice lines[J]. International Journal of MolecularScience,2021,22(15):7926.
[25] LU M Q, ZHOU J Q, LIU Y Y, et al.CoNPR1 andCoNPR3.1are involved in SA- and MeSA- mediated growth of the pollentube inCamellia oleifera[J]. Physiologia Plantarum,2021,174(4):2181-2190.
[26] LI J F, QU L H, LI N. Tyr152 plays a central role in the catalysisof 1-aminocyclopropane-1-carboxylate synthase[J]. Journal ofExperimental Botany,2005,56:2203-2210.
[ 本文编校:李义华]

