miR-375靶向PI3K/AKT通路在高糖诱导的人视网膜内皮细胞增殖和血管生成中的作用△
张悦之 殷小龙 邓 燕 熊晓顺
糖尿病是一种严重危害人类健康的慢性疾病[1],长期血糖代谢紊乱可诱发糖尿病视网膜病变(DR)[2]。然而,目前关于DR视网膜功能障碍的发病机制尚未完全清楚[3]。有研究表明,高血糖会导致微血管病变、黄斑水肿和新生血管形成,磷脂酰肌醇3 激酶(PI3K)/蛋白激酶B(AKT)通路能够促进视网膜内皮细胞(REC)的增殖[4],但该通路是否会影响REC的血管生成仍未完全清楚。miRNA在DR的进展中发挥多种功能[5-6],miR-375是最新发现的与DR相关的miRNA,有报道提示高葡萄糖会导致miR-375水平的降低[7]。但是miR-375对REC以及血管生成的影响仍未完全清楚。基于此,本研究分析miR-375靶向PI3K/AKT通路在高糖诱导的人视网膜内皮细胞(hRECs)增殖和新生血管生成中的作用,从而为DR的诊断和治疗提供新方向。
1 材料与方法
1.1 材料和试剂
hRECs购于武汉大学细胞库中国典型培养物保藏中心(武汉)。D-葡萄糖(广州百俊科技有限公司)。miR-375 模拟物(miR-375 mimic)和miR-375 阴性对照(miR-375 NC)(深圳市科普生物有限公司)。RNA转染试剂EntransterTM-R4000(广州速研生物科技有限公司)。QuickMutationTM突变和海肾荧光素酶质粒(广州特科锶科技服务有限公司)。PI3K/AKT激活剂LM22B-10(广州市左克生物科技发展有限公司)。兔抗PI3K、兔抗磷酸化AKT(p-AKT)、兔抗AKT、兔抗GAPDH(广州新晋生物科技有限公司)。超敏ECL发光液(杭州弗德生物科技有限公司)。
1.2 hRECs分组和处理
取对数生长期的hRECs,将其分为对照组、高糖组、高糖+miR-375组、高糖+miR-375+LM22B-10组。处理如下:(1)对照组,不做任何处理;(2)高糖组,在hRECs中加入终浓度为30 mmol·L-1的葡萄糖孵育24 h[8]后,按照RNA转染试剂EntransterTM-R4000的说明书转染适量miR-NC,转染36 h后继续下面的细胞学实验;(3)高糖+miR-375组,在hRECs中加入终浓度为30 mmol·L-1的葡萄糖孵育24 h[8]后,按照RNA转染试剂EntransterTM-R4000的说明书转染等量miR-375 mimic,转染 36 h 后继续下面的细胞学实验;(4)高糖+miR-375+LM22B-10组,在hRECs中加入终浓度为30 mmol·L-1的葡萄糖孵育24 h,然后按照RNA转染试剂EntransterTM-R4000的说明书转染等量miR-375 mimic,36 h后加入终浓度为50 μmol·L-1LM22B-10预培养24 h来激活PI3K/AKT通路[9]。
1.3 细胞转染
首先将miR-375 mimic或者miR-375 NC溶解于25 μL DMEM中,制成RNA稀释液。将1 μL 转染试剂EntransterTM-R4000和24 μL DMEM混合,室温静置5 min,制作成EntransterTM-R4000稀释液。将 25 μL RNA稀释液和25 μL转染试剂EntransterTM-R4000稀释液充分混合静置15 min后作为转染复合物,室温静置15 min,制成转染复合物。将上述50 μL转染复合物加入到完全培养基中,混合均匀后,孵育36 h。
1.4 方法
1.4.1 CCK-8实验检测细胞增殖能力
取对数生长期的四组细胞,用胰蛋白酶消化后,将细胞以5×104个·mL-1接种于96孔板内,每孔100 μL细胞悬浮液,每组设置3个复孔,之后将96孔板置于37 ℃的细胞培养箱中继续培养24 h后,每孔加入10 μL CCK-8溶液,继续放入37 ℃的细胞培养箱中孵育1 h,2 h后记录在450 nm波长处的光密度(OD)值,分别在培养24 h、48 h、72 h各测定一次细胞的OD值,绘制细胞的生长曲线。
1.4.2 血管形成实验检测细胞血管形成能力
将基质胶均匀涂到24孔板中(每孔90 μL),在37 ℃下硬化3 h,将四组处于对数生长期的细胞以每孔1.5×105个细胞的密度接种到基质胶包被的孔顶部,每组设置3个复孔,分别于37 ℃、体积分数5%CO2的培养箱中培养6 h,然后在倒置显微镜下观察体外管腔生成结果,使用ImageJ血管生成分析仪对每个样本中的管腔长度进行量化,以此比较各组细胞的血管形成能力。
1.4.3 RT-qPCR检测
取四组处于对数生长期的细胞,每组5×105个细胞,使用Trizol试剂盒提取hRECs的总RNA,并进行逆转录,生成cDNA。SYBR Green试剂用于qPCR扩增,反应条件为:95 ℃ 2 min,94 ℃ 20 s,58 ℃ 20 s,72 ℃ 2 s,40个循环,最后在72 ℃下延伸4 min。以U6和GAPDH为内参,使用2-ΔΔCt方法检测miR-375和PI3K mRNA的表达情况。
1.4.4 Western blot检测细胞内蛋白表达情况
利用裂解液体(100 μL)+ 蛋白酶抑制剂(1 μL)+苯甲基磺酰氟(1 μL)配备细胞裂解液,取四组处于对数生长期的细胞,每组5×105个细胞,PBS清洗后,加入100 μL细胞裂解液裂解30 min,然后离心(12 000×g,4 ℃,15 min)后,收集上清液。采用BCA蛋白检测试剂盒测定蛋白质浓度,然后加载到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳微型凝胶上并转移到聚偏二氟乙烯膜上,用50 g·L-1脱脂牛奶封闭膜1 h后,分别加入PI3K、AKT、p-AKT和GAPDH(均为1:1 000)4 ℃过夜,然后将膜与HRP标记的山羊抗兔IgG二抗(1:2 000)在室温下孵育2 h,ECL显色,凝胶成像系统成像分析,以GAPDH为内参,使用ImageJ软件分析目的蛋白的相对表达情况。
1.4.5 双荧光素酶报告实验
miR-375与PI3K的结合位点通过Starbase数据库得到。将50 μL miR-375 mimic和miR-375 NC分别与PI3K野生型载体(wt-PI3K-pGL4)使用转染试剂EntransterTM-R4000转染进3×104个hRECs内,随后将miR-375 模拟物和miR-375 阴性对照分别与PI3K突变型载体(mut-PI3K-pGL4)使用转染试剂EntransterTM-R4000转染进3×104个hRECs内36 h后,检测各组细胞荧光素酶的相对活性。
1.5 统计学分析
采用SPSS 19.00统计学软件进行数据分析,多组间比较采用单因素方差分析,采用LSD-t检验进行两两比较。检验水准:α=0.05。
2 结果
2.1 miR-375和LM22B-10对高糖下hRECs增殖活力的影响
培养24 h时,四组细胞的增殖活力差异无统计学意义(P>0.05); 培养48 h和72 h时,四组细胞的增殖活力差异均有统计学意义(均为P<0.001)。与对照组比较,培养48 h和72 h时,高糖组、高糖+miR-375组、高糖+miR-375+LM22B-10组细胞增殖活力均显著升高(均为P<0.05)。与高糖组比较,培养48 h和72 h时,高糖+miR-375组细胞增殖活力均显著降低(均为P<0.05)。与高糖+miR-375组比较,培养48 h和72 h时,高糖+miR-375+LM22B-10组细胞增殖活力均显著升高(均为P<0.05)(表1)。
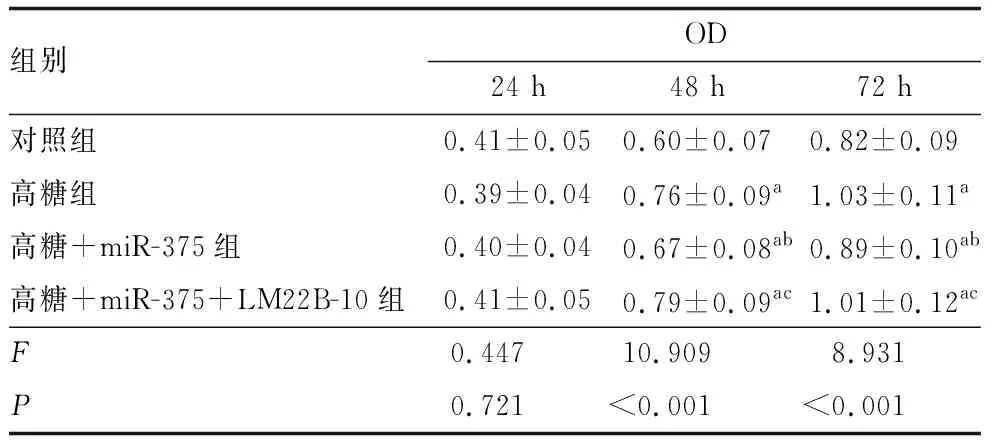
表1 miR-375和LM22B-10对高糖下hRECs增殖活力的影响
2.2 miR-375和LM22B-10对高糖下hRECs血管形成能力的影响
四组细胞的管腔长度差异有统计学意义(P<0.05)。与对照组[(1.74±0.18) mm·mm-2]比较,高糖组、高糖+miR-375组、高糖+miR-375+LM22B-10组的管腔长度[(4.31±0.42)mm·mm-2、(2.28±0.19)mm·mm-2、(3.97±0.36)mm·mm-2]均升高(均为P<0.05)。与高糖组比较,高糖+miR-375组的管腔长度降低(P<0.05)。与高糖+miR-375组比较,高糖+miR-375+LM22B-10组的管腔长度升高(P<0.05)(图1)。

图1 miR-375和LM22B-10对高糖下hRECs血管形成能力的影响
2.3 各组hRECs miR-375和PI3K mRNA水平比较
四组细胞内miR-375和PI3K mRNA水平差异均有统计学意义(均为P<0.001)。与对照组比较,高糖组的miR-375降低,而PI3K mRNA升高(均为P<0.05)。与高糖组比较,高糖+miR-375组的miR-375升高,而PI3K mRNA降低(均为P<0.05)。高糖+miR-375组与高糖+miR-375+LM22B-10组的miR-375、PI3K mRNA差异均无统计学意义(均为P>0.05)(表2)。

表2 各组hRECs miR-375和PI3K mRNA水平比较
2.4 miR-375和LM22B-10对高糖下hRECs中PI3K/AKT通路蛋白的影响
四组细胞内PI3K和p-AKT/AKT蛋白水平差异均有统计学意义(均为P<0.001)。与对照组比较,高糖组、高糖+miR-375组和高糖+miR-375+LM22B-10组PI3K 和p-AKT/AKT蛋白水平均显著升高(均为P<0.05)。与高糖组比较,高糖+miR-375组的PI3K和p-AKT/AKT蛋白水平均降低(均为P<0.05)。与高糖+miR-375组比较,高糖+miR-375+LM22B-10组的p-AKT/AKT蛋白水平升高(P<0.05),PI3K蛋白水平差异无统计学意义(P>0.05)(图2、表3)。
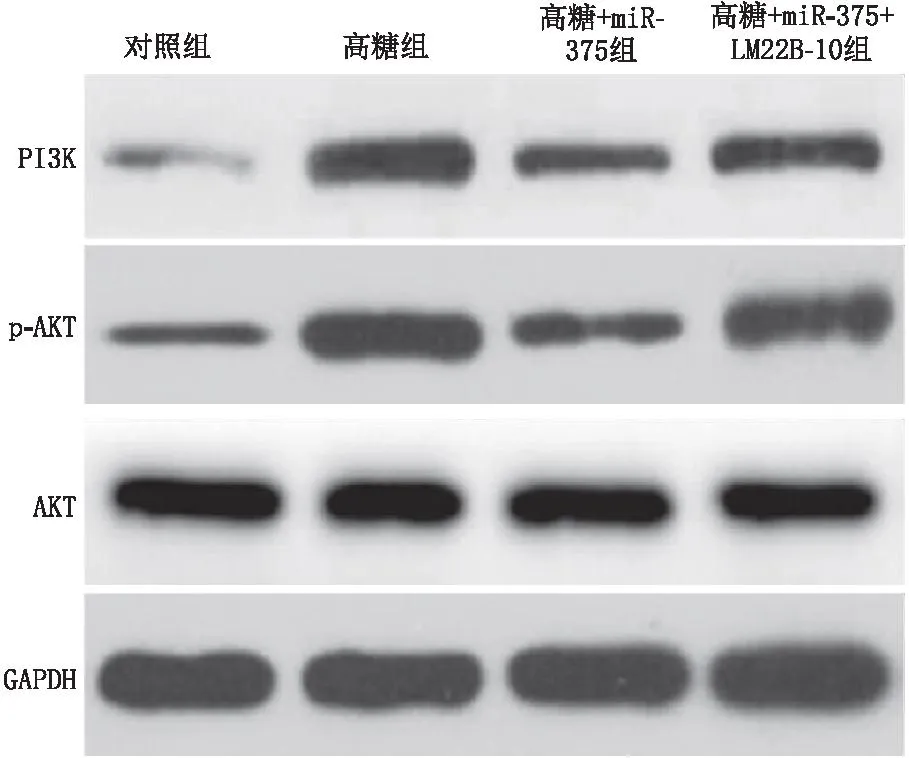
图2 miR-375和LM22B-10对高糖下hRECs中PI3K/AKT通路蛋白的影响

表3 miR-375和LM22B-10对高糖下hRECs中PI3K/AKT通路蛋白的影响
2.5 hRECs中miR-375靶向PI3K
miR-375与PI3K的靶向位点见图3。转染miR-375 NC、转染miR-375 mimic后hRECs中相对荧光素酶活性分别为 8.92±0.91、2.38±0.25,转染miR-375 mimic后hRECs中相对荧光素酶活性显著降低(P<0.05);另外,转染mut-PI3K-pGL4、转染wt-PI3K-pGL4后hRECs中相对荧光素酶活性分别为8.96±0.92、2.38±0.25,转染wt-PI3K-pGL4后hRECs中相对荧光素酶活性显著降低 (P<0.05)。
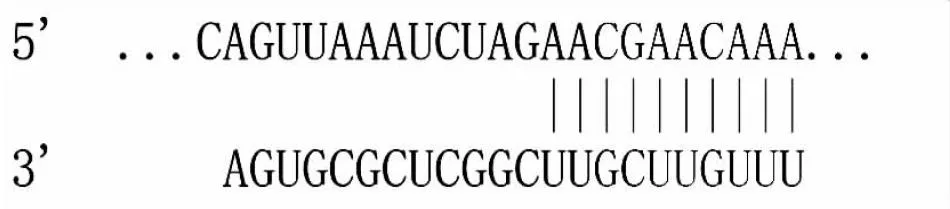
图3 miR-375与PI3K的结合位点
3 讨论
DR是目前成年人视力下降和失明的主要原因[10],其病理学特点是视网膜血管内皮细胞损伤和血管结构发生变化[11]。DR的发病机制是一个多因素综合作用的过程,研究显示,miRNA已被证明与糖尿病及其并发症的发病机制有关[12]。miR-21可作为DR的诊断生物标志物[13],miR-29c-3p和miR-138-5p的缺失或过度表达可能会导致hRECs及相关神经元的死亡和视网膜血流量的减少,从而促进DR的进展[14-15]。目前,临床研究已经证实2型糖尿病患者miR-375水平与β细胞功能、胰岛素抵抗和代谢参数密切相关[16]。miR-375 通过靶向芳烃受体和细菌色氨酸酶基因预防高脂饮食诱导的胰岛素抵抗和肥胖[17]。但是miR-375在DR中的作用仍未完全明了,因此,本研究拟通过模拟高糖环境,探索miR-375对hRECs增殖和血管生成的影响。
本研究将miR-375转染至hRECs内,比较高糖环境下hRECs的增殖和血管生成能力,结果显示,在高糖条件下,hRECs内miR-375的表达水平显著降低,hRECs的增殖和血管生成能力显著升高,而转染miR-375后,hRECs的增殖和血管生成能力下降,这一结果表明高糖能抑制miR-375的表达,且高糖能促进hRECs增殖及血管形成,而miR-375能抑制hRECs增殖及血管形成。另有研究显示,miR-375 通过靶向Kruppel样因子5调控糖尿病严重肢体缺血的血管生成[18],这与本研究所得出的结论相一致。
在高糖环境下,在转染miR-375的hRECs中加入LM22B-10(一种神经营养因子受体B型/神经营养因子受体C型激活剂,能诱导神经营养因子受体B型、神经营养因子受体C型、AKT和细胞外信号调节激酶的活化),hRECs的增殖和血管生成能力显著升高,说明miR-375可能通过PI3K/AKT通路调控DR的进展。本研究中,我们发现高糖会促进hRECs中PI3K mRNA和蛋白表达以及AKT磷酸化,而过表达miR-375不但抑制了PI3K mRNA和蛋白表达,还逆转了高糖诱导的AKT磷酸化。PI3K/AKT通路对正常血管的形成起到重要作用,而细胞和全身代谢的胰岛素依赖性调节也离不开PI3K/AKT信号通路[19]。细胞因子、生长因子和环境应激等刺激也都能够激活该信号通路,调节细胞增殖、迁移、分化和存活等生命过程[20]。有研究表明,PI3K/AKT的持续激活可以导致结构和功能异常的血管形成,而抑制该信号转导则可以抑制病理性血管的形成[21]。在DR中,PI3K的升高以及磷酸化促进AKT的磷酸化,这不但可活化REC使其增殖,还促进了血管生成[22]。另外,PI3K受到miRNA的调控,如在REC中,PI3K受到miR-199的靶向调控,进而抑制AKT磷酸化[23]。这也进一步佐证了本研究的结果。
为进一步验证PI3K/AKT通路在miR-375缓解DR中的关键机制,我们在过表达miR-375的基础上利用LM22B-10来持续激活PI3K/AKT通路,其中,LM22B-10可通过作用于PI3K蛋白来激活PI3K/AKT通路[9]。结果显示,LM22B-10对miR-375和PI3K mRNA的水平影响不显著,但却显著逆转了miR-375对AKT磷酸化的抑制作用。更重要的是,利用LM22B-10持续激活PI3K/AKT通路也阻断了miR-375的保护作用,逆转了miR-375过表达对hRECs增殖活力和血管生成能力的抑制作用。本研究明确了miR-375以及PI3K的结合位点,并且发现转染miR-375 mimic和wt-PI3K-pGL4后,hRECs中相对荧光素酶活性显著降低。另外,Yang等[24]发现,催产素可通过诱导miR-375抑制 PI3K/AKT 通路,从而防止异丙肾上腺素诱导的心脏肥大。在肺癌和乳腺癌细胞中,PI3K的表达抑制AKT的磷酸化[25-26]。这表明hRECs中PI3K/AKT通路被miR-375靶向,过表达miR-375通过靶向抑制PI3K/AKT通路降低DR中hRECs的增殖和血管生成。
4 结论
miR-375通过靶向抑制PI3K/AKT通路抑制高糖诱导的hRECs增殖和血管生成,进而缓解DR。关于miR-375在DR中的临床价值仍需要对大量DR患者进行进一步研究,其对DR的影响也需要进一步的体内实验来证实。说明靶向miR-375可能成为治疗DR的新靶点。

