高度近视患者弥漫性脉络膜视网膜萎缩的影响因素及预测模型构建△
孙敬文 刘 妍 郝 静
作者单位:150000 黑龙江省哈尔滨市,哈尔滨二四二医院眼科
高度近视(HM)是由于眼球过长导致眼球组织逐渐萎缩而引起的屈光不正,随着高度近视度数的增加,机械拉伸导致眼球过度伸长和扭曲,眼轴长度(AL)不断增长,可能会使眼球内层变薄,增加视网膜和脉络膜退行性病变,其中近视性黄斑病变是最常见的一种,与不可逆的双侧视力损害和失明有关[1]。弥漫性脉络膜视网膜萎缩(DCA)是近视性黄斑部脉络膜病变的一种,表现为黄白色和界限不清的脉络膜视网膜萎缩,通常始于颞部视盘周围区域,后扩展覆盖整个后极部[2]。DCA被认为是一种与视力损害相关的进行性病变,与无近视视网膜病变或豹纹状眼底患者比较,DCA患者AL更长,近视程度更高[3],并可演变为漆样裂纹、脉络膜新生血管(CNV)、斑片状萎缩、黄斑萎缩等严重威胁视力的病理后果[4]。目前关于DCA的文献报道较少,DCA发病机制和危险因素尚未完全清楚,鉴于此,本研究收集了169例HM患者的临床资料,拟探究DCA的影响因素并建立预测模型。
1 资料与方法
1.1 一般资料
回顾性病例对照研究。选择2018年10月至2022年10月于哈尔滨二四二医院眼科收治的169例(338眼)HM患者为研究对象,纳入标准:(1)门诊验光证实为双侧高度近视,AL≥26.5 mm或屈光不正≤-6.00 D;(2)临床资料完整。排除标准:(1)继发性近视;(2)屈光间质混浊、既往光动力疗法治疗史、抗血管内皮生长因子治疗史、玻璃体视网膜手术史、白内障手术史或屈光手术史;(3)严重全身性疾病;(4)其他视网膜疾病,如糖尿病视网膜病变、视网膜血管疾病、老年性黄斑变性、葡萄膜炎等;(5)其他类型近视性黄斑变性,如玻璃体黄斑牵拉、黄斑劈裂、黄斑裂孔伴视网膜脱离、活动性近视黄斑新生血管;(6)睫状肌完全麻痹。本研究严格遵循《赫尔辛基宣言》原则,并获得我院伦理委员会批准(批准号:S180594),患者知情同意并签署同意书。
1.2 检查方法
1.2.1 眼科检查
所有患者入组当日均进行全面眼科检查,Master700生物测量仪(德国卡尔蔡司)测量AL,Goldmann扁平眼压仪(瑞士Haag-Streit AG)测量眼压(IOP)。国际标准视力表检测最佳矫正视力(BCVA),记录时转换为logMAR最小分辨角对数视力进行统计。8800K验光仪(日本Topcon)测量屈光不正,屈光不正分析中排除有白内障手术史或屈光手术史的眼睛,等效球镜度(SE)=球镜度+1/2柱镜度。使用PLEX®Elite 9000光学相干断层扫描血管造影仪(德国卡尔蔡司)测量视网膜浅层和深层微血管密度(MVD)。视觉电生理仪(德国Ganzfeld)检测视野平均缺损(MD)、模式标准差(PSD)。CX-1相机(日本佳能)拍摄彩色眼底照片。
1.2.2 DCA诊断和分级
获得黄斑中心的眼底照片后,由眼底专业经验丰富的主治医生根据病理性近视研究组发布的近视眼黄斑病变国际摄影分类及分级系统[5]确定近视性黄斑病变情况,包括五类:非近视性视网膜病变(0类)、豹纹状眼底(1类)、DCA(2类)、斑片状脉络膜视网膜萎缩(3类)、黄斑萎缩(4类),另外有三种(漆样裂纹、Fuchs斑、继发于近视的CNV)为附加体征。DCA定义为位于视盘周围、黄斑内或整个后极的黄白色病变。根据DCA发生情况将患者分为DCA组(34例)和非DCA组(135例)。根据筛选标准本研究排除了斑片状脉络膜视网膜萎缩、黄斑萎缩、CNV。DCA分级:采用ETDRS网格来确定病灶与黄斑中心的相对位置,ETDRS网格由软件应用于眼底照片形成,以中央凹为中心制作3个同心圆,分别为外圆、中圆和中心圆,中圆和中心圆的直径分别为外圆的1/2和1/6。根据ETDRS网格中DCA受累程度分为四类:0级,无受累;1级,外圆受累;2级,中圆受累;3级,中心圆受累(图1)。以上检查由我院眼科两位10年以上工作经验的医师在不了解分组信息的情况下检查,取一致性结果。

A:DCA分级0级;B:DCA分级1级;C:DCA分级2级;D:DCA分级3级。图1 应用ETDRS网格的DCA分级
1.2.3 实验室检查
所有患者入组后均采集静脉血约3 mL,注入干燥试管,待血液干燥取上层液离心(2 000 r·min-1,半径15 cm,时间5 min)获得血清,采用Western blot检测血清抗视网膜抗体(ARAs),ARAs包括recoverin抗体、α-enolase 抗体、碳酸酐酶2(CAII)抗体和CRMP-5抗体。AQT90 FLEX全自动荧光免疫分析仪应用化学发光法检测25 羟维生素D[25(OH)D]水平。
1.3 相关资料收集
收集患者性别、年龄、吸烟史、饮酒史、基础疾病(高血压、糖尿病、冠心病)、家族近视史、AL、SE、BCVA、IOP、视网膜浅层和深层MVD、MD、PSD、ARAs、25(OH)D。
1.4 统计学分析
采用SPSS 25.00统计学软件进行数据分析,正态分布的连续变量以均值±标准差表示,采用Student-t检验。分类变量以例(%)表示,采用χ2检验。多因素Logistic回归分析HM患者发生DCA的危险因素,基于危险因素采用受试者工作特征曲线(ROC曲线)构建HM患者发生DCA的预测模型,Hosmer-Lemeshow(H-L)检验预测模型的校准度。检验水准:α=0.05。
2 结果
2.1 DCA发生情况
169例338眼HM患者中DCA组34例68眼(20.12%),非DCA组135例270眼(79.88%)。132例264眼(60.95%)为豹纹状眼底,3例6眼(1.78%)为漆样裂纹。DCA分级:0级8例16眼,1级13例26眼,2级10例20眼,3级3例6眼。
2.2 两组患者一般资料比较
两组患者年龄、性别分布比较差异均有统计学意义(均为P<0.05),吸烟史、饮酒史、基础疾病、家族近视史比较差异均无统计学意义(均为P>0.05)(表1)。

表1 两组患者一般资料比较
2.3 两组患者眼科检查结果比较
DCA组患者AL、PSD均大于非DCA组,BCVA、MD、SE、视网膜深层MVD均小于非DCA组,差异均有统计学意义(均为P<0.05)。两组患者IOP、视网膜浅层MVD比较差异均无统计学意义(均为P>0.05)(表2)。
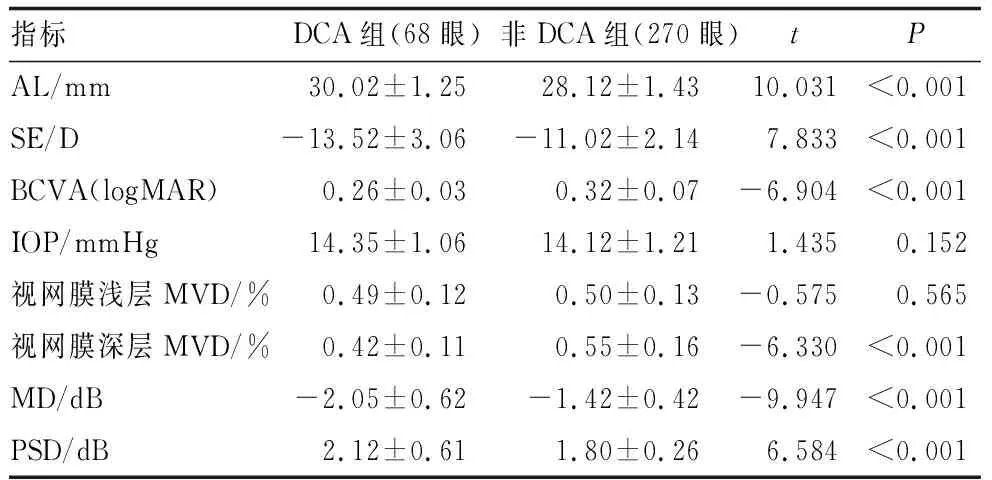
表2 两组患者眼科检查结果比较
2.4 两组患者实验室检查结果比较
DCA组患者血清25(OH)D水平小于非DCA组,CAII抗体阳性比例大于非DCA组,差异均有统计学意义(均为P<0.05)。两组患者recoverin抗体、α-enolase 抗体、CRMP-5抗体阳性比例比较差异均无统计学意义(均为P>0.05)(表3)。
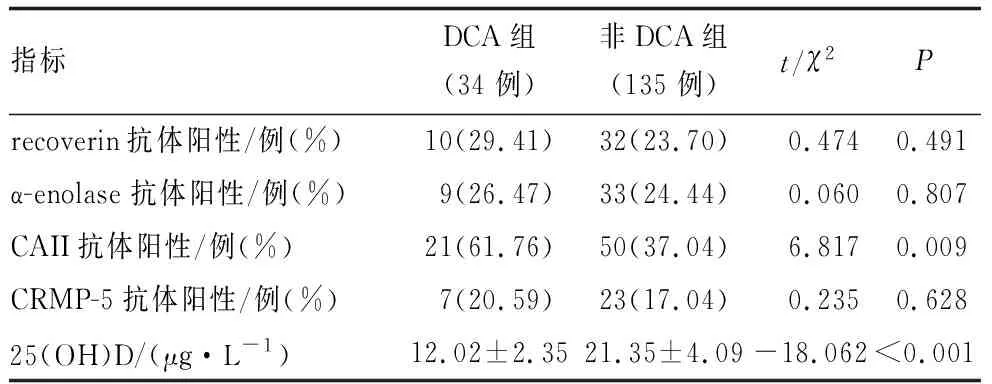
表3 两组患者实验室检查结果比较
2.5 HM患者发生DCA的因素分析
对年龄、性别(赋值:0=男,1=女)、AL、SE、BCVA、MD、视网膜深层MVD、PSD、25(OH)D、CAII抗体(赋值:0=阴性,1=阳性)赋值,连续性变量未赋值原值代入为自变量,以HM患者发生DCA为因变量(赋值:0=否,1=是),建立Logistic回归方程。单因素Logistic回归分析结果显示,年龄、AL、SE、BCVA、视网膜深层MVD、CAII抗体、25(OH)D均与HM患者发生DCA有关(均为P<0.05)(表4)。多因素Logistic回归分析结果显示,年龄较大、AL较长、CAII抗体阳性均是HM患者发生DCA的危险因素(均为P<0.05),视网膜深层MVD较大、25(OH)D较高均是其保护因素(均为P<0.05)(表5)。
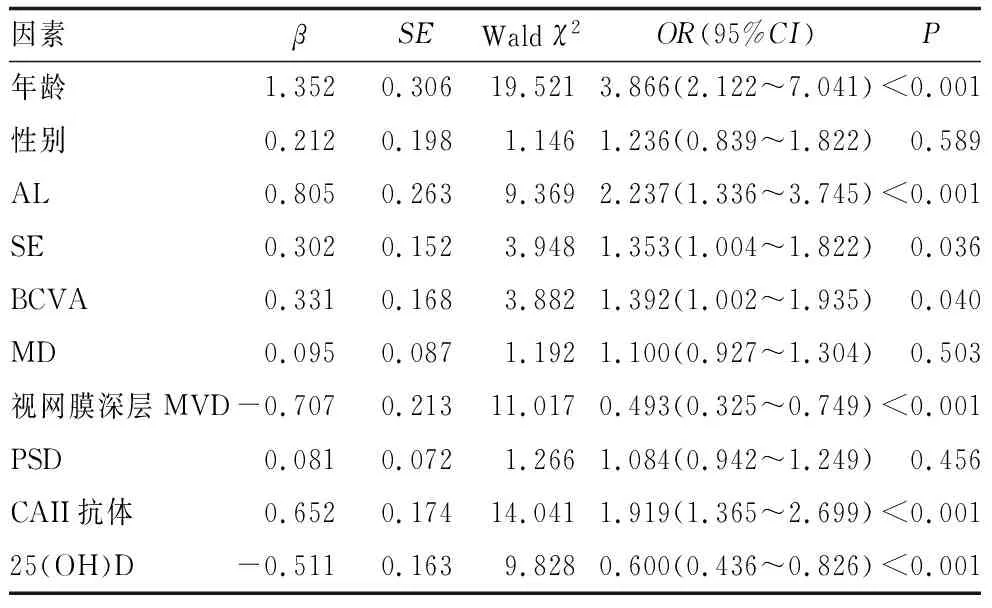
表4 HM患者发生DCA的单因素Logistic回归分析

表5 HM患者发生DCA的多因素Logistic回归分析
2.6 预测模型的构建
将上述多因素Logistic回归分析中具有统计学意义的变量引入多元回归方程,构建HM患者(所有HM患者)发生DCA的预测模型:Logit(P)=6.023+1.262×X1+0.682×X2-0.563×X3+0.568×X4-0.501×X5,其中X1表示年龄,X2表示AL,X3表示视网膜深层MVD,X4表示CAII抗体,X5表示25(OH)D。拟合优度NagelkerkeR2为0.525,模型系统总检验P<0.001。H-L检验χ2=4.052,P=0.092,说明预测模型预测结果与实际结果无统计学差异(P>0.05)。ROC曲线构建预测模型,结果显示,Logit(P)预测HM患者发生DCA的曲线下面积为0.864(95%CI:0.802~0.911,P<0.001),灵敏度、特异度分别为85.29%(29/34)、88.15 %(119/135),曲线下面积>0.5表明具有诊断价值,越接近1表示诊断价值越高(图2)。

图2 HM患者发生DCA预测模型的ROC曲线
3 讨论
DCA在HM中最常见,由视网膜色素上皮和脉络膜毛细血管缺失引起,其病变特征为通过萎缩的脉络膜透见白色的巩膜组织,这是区别其他类型近视黄斑病变的关键所在,也是视力损害的基础[6]。目前关于HM患者DCA发病情况的报道不尽相同,张景尚等[7]研究发现,黄斑部脉络膜萎缩在40岁以上中老年HM患者中患病率为19.5%,但是并未进行近视眼黄斑病变详细分类。Nguyen等[8]统计越南年龄12~47岁HM人群视网膜病变情况,发现 60.7%为豹纹状眼底,4.2%为DCA,1.2%为斑块性脉络膜视网膜萎缩。Ueda等[9]调查了日本普通人群中近视以及近视黄斑病变患病情况,结果显示,随着近视患病率增加,近视黄斑病变患病率也相应增加,其中普通人群中近视黄斑病变患病率为3.6%。Zhao等[10]报道HM患者中DCA检出率为28.46%。本研究对169例338眼HM患者的黄斑部脉络膜病变进行了统计分析发现,20.6%的HM患者患有DCA,与Zhao等[10]报道结果接近。
本研究发现,年龄较大、AL较长、CAII抗体阳性是HM患者发生DCA的危险因素,视网膜深层MVD较大、25(OH)D较高是其保护因素。年龄是HM患者黄斑病变的重要危险因素之一,年龄较小者多为漆样裂纹,年龄较大者多为DCA或斑块性脉络膜视网膜萎缩,CNV和黄斑萎缩[11],HM儿童DCA仅局限于颞部至视盘周围[12]。AL为27~33 mm的HM患者,AL长度每增加 1 mm,脉络膜萎缩的患病率增加13.3%[13]。
维生素D具有调节免疫、炎症、血管生成等多种生物学效应,研究发现,人类角膜上皮细胞、内皮细胞、晶状体、睫状体、视网膜神经节细胞、内核层、光感受器和视网膜色素上皮等均可检测到维生素D受体(VDR),维生素D缺乏与近视有关[14]。有研究表明,血清25(OH)D缺乏组发生中高度近视的患病率比血清25(OH)D充足组高2.051倍,血清25(OH)D浓度与近视儿童SE呈正相关[15]。维生素D可减少氧化应激,促使T细胞增殖和促炎剂的产生发挥抗炎作用,并抑制血管生成,在老年性黄斑变性中发挥保护作用[16]。
研究表明,随着近视程度增加,轴向扩张导致视网膜和眼底脉络膜变薄,从而减少视网膜神经纤维层的厚度,视网膜和脉络膜组织主要由微循环提供氧气和营养物质[17],因此,血流灌注异常可能与DCA发生有关。本研究结果显示,DCA组患者视网膜深层MVD明显低于无DCA组,推测视网膜微循环障碍,血供和氧供减少,导致视网膜色素上皮和脉络膜毛细血管缩窄或缺失,血管密度降低,进而导致脉络膜萎缩。Zheng等[18]报道也指出,近视性黄斑变性患者视网膜深层MVD明显降低,且与黄斑变性程度加重以及黄斑敏感性降低有关。
视网膜退行性病变、血-视网膜屏障破坏可导致视网膜蛋白释放,这些蛋白具有抗原性,可刺激ARAs产生,ARAs形成免疫复合物在绒毛膜和视网膜色素上皮积累导致视网膜色素上皮变性和视网膜疾病[19-21]。本研究结果显示,抗CAII抗体与DCA发生有关。有研究显示,抗CAII自身抗体通过抑制CAII催化活性,降低细胞内pH值破坏代谢功能,导致细胞内钙离子内流,最终促使视网膜细胞凋亡[22]。抗CAII自身抗体在视网膜色素上皮积累可引起免疫反应,导致黄斑Bruch膜断裂,发生视网膜退行性病变[23]。基于上述危险因素构建HM患者DCA的风险预测模型,其曲线下面积为0.864,说明该模型具有良好的预测能力。
4 结论
年龄较大、AL较长、CAII抗体阳性是HM患者发生DCA的危险因素,视网膜深层MVD较大、25(OH)D 较高是其保护因素,临床应高度重视具有高危因素患者,采取积极的预防措施,积极补充维生素D可能有助于延缓DCA的发生和进展。

