丝裂霉素C-全氟溴辛烷脂质体纳米药物对人翼状胬肉成纤维细胞治疗安全性及效果评价△
李 涛 廖灵珊 朱胜兰 唐 娟 吴小利 方其林 李 盈 李 彪 田 琴 万俊梅 阳 毅 谭越月 李佳倩 杜 鹃 周 燕 张 丹 刘兴德
翼状胬肉是睑裂区的球结膜及其膜下组织的异常增生肥厚,呈三角形向角膜浸润性生长的纤维血管组织疾病[1-2]。翼状胬肉浸润角膜后可能引起眼球转动障碍、角膜散光及视力下降等症状[3-4]。风尘、紫外线、干燥及烟雾等因素均可能导致翼状胬肉发生,是我国眼科临床的多发病及常见病[5]。目前关于翼状胬肉的最常见治疗方法是单纯切除+角膜缘干细胞移植,但手术治疗常存在术后复发率高与眼角修复困难等缺点[6]。既往研究显示,丝裂霉素C(MMC)是一种临床中广泛应用的抗代谢、抗增殖药物,可有效抑制多种细胞生长[7]。研究表明,手术过程中使用MMC对翼状胬肉患者进行干预,可有效降低患者术后复发率,但由于MMC易导致角膜穿孔、巩膜溶解、虹膜炎及继发性青光眼等并发症,其临床使用受到限制[8-9]。近年来,纳米技术逐渐应用于眼科研究,脂质体作为一种人工球形囊泡,由一个或多个磷脂双分子层组成,具有水溶性和脂溶性的药物载体特性,在药物的缓释、控释及降低药物不良反应等方面受到广泛关注[10-11]。全氟溴辛烷(PFOB)是一种相变材料,最初用于急性肺损伤治疗中改善肺功能。研究发现,PFOB可以靶向结膜上皮细胞,并局限作用于损伤区域的炎症,同时该材料可完全生物降解和相对无毒[12-13]。因此推测MMC和PFOB结合在脂质体上,其抗炎效果会得到增强,同时可以有效降低单独使用MMC的不良反应。基于此,本研究制备一种以脂质体为载体,以液态PFOB为内核,MMC搭载于脂质体壳的纳米药物PFOB@Lip-MMC,研究其对人翼状胬肉成纤维细胞(HPF)增殖的抑制作用,为临床治疗翼状胬肉提供参考。
1 材料与方法
1.1 实验材料
选用MMC作为实验药物,以脂质体和PFOB为包封材料制备PFOB@Lip-MMC。
1.2 主要试剂和仪器
主要试剂和生产厂家分别为大豆卵磷脂(上海麦克林生化科技有限公司);1,2-双(二苯基膦基)乙烷(DPPE)(Corden Pharm,瑞士);胆固醇(西安瑞禧生物科技有限公司);PFOB(Sigma,美国);甲醇(重庆川东化工集团);PBS(pH=7.5)缓冲液;MMC(西安山川生物科技有限公司)。主要仪器:旋转蒸发仪(上海泰坦生物有限公司);声震仪(Sonics,美国);低温高速离心机(Eppendrof,德国);透射电镜(TEM)(HiTachi,日本);Malvern3000SSA型激光粒径及电位测量仪(Malvern,美国);紫外分光光度计(Shimadzu,日本)。
1.3 制备方法
1.3.1 MMC溶液配置
采取精密天平称取MMC 2 mg,加入不同体积的HPF细胞培养液混合均匀,配制浓度分别为2、5、7、10、20、40、80 mg·L-1的MMC溶液备用。
1.3.2 PFOB@Lip-MMC的制备
采用薄膜分散-水化超声法(film-dispersion and hydration-sonication method)制备MMC和PFOB的脂质体(PFOB@Lip-MMC)。具体步骤:精密称取10 mg的磷脂(大豆卵磷脂:DPPE:胆固醇的质量比为7:1:2),6 mg MMC及7 mL三氯甲烷放入100 mL圆底烧瓶中;将圆底烧瓶转移到旋转蒸发仪上(50 ℃,负压-0.1 kPa,30 min),得到白色脂质膜,采用PBS洗脱,冷却,加入PFOB,MMC镶嵌在脂质膜上的脂质体用100 W、5 min(开/关时间为5 s/5 s)工作模式的声震仪将已形成的脂质体均匀化,最后用低温离心机(4 ℃,6 000 r·min-1)进行纯化,4 ℃低温避光保存,备用。用同样的方法制备载PFOB脂质体(PFOB@Lip)以及添加了荧光标记物DiI的纳米药物PFOB@Lip-MMC。
1.4 纳米粒表征测量
采用马尔文粒径仪测量PFOB@Lip-MMC和PFOB@Lip脂质体的粒径和Zeta电位。配制不同浓度的汉防己甲素甲醇溶液,通过紫外分光光度计测量其吸收度,根据最大吸光度值确定吸收峰,并且计算各自的浓度-吸光度标准曲线。MMC包封率=载药量/总投入量×100%;MMC载药率=载药量/脂质体总量×100%。
同时采用高效液相色谱法测量PFOB@Lip-MMC 在4 ℃(储存温度)和33 ℃(眼表温度)情况下的药物释放率。
1.5 HPF培养
选取资阳市第一人民医院翼状胬肉手术切除组织为标本,采用组织块培养法培养HPF。在恒温37 ℃,含体积分数5% CO2的环境中,用含体积分数10%胎牛血清和10 g·L-1青霉素-链霉素的DMEM培养基培养,当细胞融合度达到90%时进行传代。本实验取第3~6代HPF进行实验。
1.6 生物安全性验证
1.6.1 CCK-8实验
将HPF种植在96孔板(每孔1×104个)24 h,细胞铺满90%,用血清培养基稀释MMC和PFOB@Lip-MMC,添加MMC组和添加PFOB@Lip-MMC组中MMC浓度一致,分别为2、5、7、10、20、40和80 μg·L-1,血清培养基处理组作为对照组。每组设置5个复孔,孵育24 h和48 h后,移除培养基,PBS清洗3次,最后向每孔加入10 μL配制好的CCK-8溶液(CCK-8:无血清培养基=1:10),孵育30 min,再用全自动酶标仪检测波长在450 nm处每个孔的吸光度(OD)值。计算不同组别的细胞存活率:细胞存活率(%)=(OD实验组-OD对照组)/OD对照组×100%。
1.6.2 Cam-PI细胞活/死染色
将HPF接种在共聚焦培养皿(1×105个)上,分别加入血清稀释的MMC和PFOB@Lip-MMC,MMC和PFOB@Lip-MMC中MMC浓度一致(5 mg·L-1),共孵育24 h后,弃掉培养基,PBS洗3次,各皿加入1 mL配制好的Ca-AM/PI双染试剂并孵育15 min,观察细胞的存活/死亡情况。
1.6.3 流式细胞术实验
将HPF种植在6孔细胞培养板(每孔5×105个)24 h,待细胞铺满90%,分别加入血清稀释的MMC和PFOB@Lip-MMC,MMC和PFOB@Lip-MMC中MMC浓度一致(5 mg·L-1),共同孵育24 h,利用无菌PBS溶液清洗6孔细胞培养板3次,2.5 g·L-1胰蛋白酶500 μL消化细胞30 s,加入人角膜基质成纤维细胞专属培养液2 mL终止消化,收集细胞悬液于15 mL离心管,1 000 r·min-1离心,弃掉废液,取细胞沉淀,加入500 μL无菌PBS于15 mL离心管混合均匀,转入1.5 mL的EP管,放入流式细胞仪检测各组中活细胞数量。
1.7 纳米药物体外抗炎效果评价与分组
采用共聚焦显微镜观察予以PFOB@Lip-MMC治疗后炎症化HPF的数量及形态改变,同时利用DiI荧光标记的PFOB@Lip-MMC纳米药物在共聚焦显微镜下观察纳米药物的渗透性;此外,将HPF种植在6孔细胞培养板(每孔1×105个)12 h,细胞铺满50%,弃掉培养基,PBS清洗3次,加入含炎症诱导因子TGF-β2(5 μg·L-1)的培养基,炎症细胞模型建立后,按照实验要求分为对照组(加入无菌PBS溶液)、PFOB@Lip组(加入PFOB@Lip)、MMC组(加入MMC)、PFOB@Lip-MMC组(加入PFOB@Lip-MMC),正常HPF弃掉原有培养基后加入新鲜的培养基培养作为正常组,共孵育24 h后,收集每组的细胞和上清液,每组的细胞及上清液分成2份,一份PBS后洗2次,重悬,在室温下黑暗环境中与FITC结合膜蛋白V和PI共孵育15 min,然后用流式细胞仪检测炎症细胞的凋亡率;另一份采用RNA快速试剂提取盒提取RNA,进行cDNA的逆转录,PCR检测系统进行实时定量PCR,进行各炎症因子基因转录水平分析比较。在此过程中合成应用了引物前列腺素E2(PGE2)[NM_001171406.1]、血管内皮生长因子(VEGF)[XM_017345155.1]、白细胞介素(IL)-1β[NM_001082201.1]、肿瘤坏死因子(TFN)-α[NM_001082263.1]。
1.8 统计学处理
应用Graphpad 8.1统计软件处理数据,计数资料采用均数±标准差表示,组间比较采用单因素方差分析,检验水准:α=0.05。
2 结果
2.1 PFOB@Lip-MMC基本理化性质分析
PFOB@Lip-MMC的平均粒径[(103.45±2.17)nm]大于PFOB@Lip[(89.76±6.57)nm],PFOB@Lip-MMC与PFOB@Lip的Zeta电位分别为(27.34±1.03)mV与(-21.09±0.57)mV,动态光分散指数分别为0.19±0.01与0.14±0.03。相同浓度MMC情况下,MMC溶液呈乳白色,PFOB@Lip-MMC悬浊液乳白色颜色更深(图1)。PFOB@Lip-MMC纳米微球在投射电镜下呈脂质体的壳核结构,可观察到磷脂双分子层和实心球形结构(图2);检测PFOB@Lip和PFOB@Lip-MMC纳米微球1~7 d的粒径变化,结果显示,PFOB@Lip-MMC分散在PBS中高度稳定(图3);进一步采用用紫外分光光度计检测MMC的光学性质,结果显示,MMC和PFOB@Lip-MMC在286 nm处有特征性吸收峰,而PFOB@Lip则没有(图4)。PFOB@Lip-MMC纳米微球的包封率为(72.85±3.28)%,载药率为(34.27±2.04)%。药物释放实验方面,在4 ℃(储存温度)和33 ℃(眼表温度)条件下,PFOB@Lip-MMC经过24 h 累积释放率分别为(4.73±0.38)%和(78.34±2.92)%(图5)。

图1 MMC溶液与PFOB@Lip-MMC悬浊液颜色比较(MMC浓度相同)。图2 TEM下的PFOB@Lip-MMC纳米微球结构(浓度:250 mg·L-1)

图4 MMC、PFOB@Lip及PFOB@Lip-MMC的紫外吸收波普与吸收峰分布(浓度均为50 mg·L-1)。图5 PBS溶液中PFOB@Lip-MMC的MMC的体外累积释放率
2.2 PFOB@Lip-MMC生物安全性分析
CCK-8实验结果表明,HPF活力在MMC溶液和PFOB@Lip-MMC溶液中随MMC浓度的增加而呈剂量依赖性降低,相较于MMC溶液,PFOB@Lip-MMC纳米药物中的HPF活力明显较高(图6)。当MMC浓度为5 mg·L-1时,在活/死染色图像中,添加PFOB@Lip-MMC的悬浊液中绿色荧光细胞(活细胞)的大量存在证明该浓度MMC对HPF安全(图7)。同时流式细胞术实验结果表明,在共同孵育24 h后,添加PFOB@Lip-MMC的HPF细胞凋亡率[(9.28±1.12)%]明显低添加MMC的HPF细胞凋亡率[(22.78±2.71)%](图8)。各实验结果显示,MMC与纳米载体结合后,PFOB@Lip-MMC的生物安全性高于MMC。
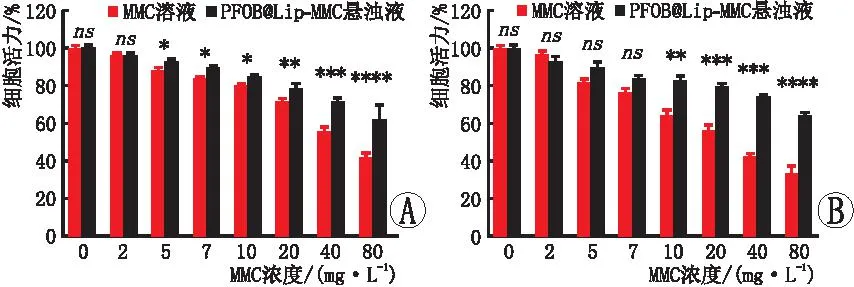
A:共孵育24 h;B:共孵育48 h。两两比较,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1,ns:差异无统计学意义。图6 HPF与不同浓度MMC溶液和PFOB@Lip-MMC悬浊液共孵育24 h与48 h后细胞活力比较
2.3 PFOB@Lip-MMC对翼状胬肉术后抗炎效果评价
通过炎症诱导因子TGF-β2诱导HPF转变为翼状胬肉术后纤维化炎症细胞模型(图9A),予以PFOB@Lip-MMC纳米药物治疗12 h后,炎症化细胞数量明显减少,细胞体积变小(图9B);进一步采用DiI荧光标记的PFOB@Lip-MMC与炎症化HPF共同孵育2 h,结果显示,DiI荧光标记纳米药物弥漫性分布于炎症化HPF中,说明PFOB@Lip-MMC可有效进入炎症化HPF中发挥抗炎作用(图10);同时流式细胞术检测结果显示,MMC和PFOB@Lip-MMC与炎症化HPF共同孵育24 h后,PFOB@Lip-MMC组炎症化HPF细胞凋亡率[(77.23±4.93)%]明显高于MMC组[(51.62±3.28)%](图11);进一步提取正常组、对照组、PFOB@Lip组、MMC组、PFOB@Lip-MMC组中细胞RNA进行实时定量PCR检查,结果显示,对照组和PFOB@Lip组中IL-1β、PGE2、TNF-α及VEGF基因表达水平均高于正常组,予以MMC和PFOB@Lip-MMC治疗后,IL-1β、PGE2、TNF-α及VEGF基因转录水平与对照组和PFOB@Lip组相比均明显下调,其中PFOB@Lip-MMC组降低最明显,差异均有统计学意义(均为P<0.05)(图12)。

A:TGF-β2诱导的翼状胬肉术后纤维化炎症细胞模型;B:PFOB@Lip-MMC与炎症化HPF共孵育12 h后细胞形态。图9 炎症化HPF模型及PFOB@Lip-MMC与炎症化HPF共同孵育12 h后细胞形态变化图
3 讨论
翼状胬肉是眼科常见的眼表疾病,翼状胬肉切除联合角膜缘干细胞移植术是目前最常用的手术方式,但瘢痕增生及复发等情况是眼科临床亟待解决的问题[14-15]。研究表明,翼状胬肉术后HPF受到手术刺激,会大量产生IL-1β、PGE2、TNF-α及VEGF等炎症因子表达,而该类炎症因子的表达是术后翼状胬肉复发的重要原因,因此抗炎治疗在该病的发生和发展中具有非常重要的作用[16-17]。既往研究表明,手术过程中使用MMC可以有效降低术后翼状胬肉复发风险,但由于MMC易导致角膜穿孔、巩膜溶解、虹膜炎及继发性青光眼等并发症,其临床使用受限[8-9]。因此,本研究利用脂质体为载体,以液态的PFOB为内核,MMC搭载于脂质体壳,合成纳米粒PFOB@Lip-MMC,利用纳米材料易修饰性、缓释性及良好的生物相容性等优势,研制一种旨在抑制翼状胬肉术后复发且不良反应较小的新药。
本研究采用薄膜-分散-水化超声法成功合成了一种新型纳米脂质体PFOB@Lip-MMC。PFOB@Lip-MMC的粒径、形态、Zeta电位以及紫外光谱结果均表明MMC成功负载到PFOB@Lip脂质体上,并且PFOB@Lip-MMC纳米药物1~7 d的粒径变化分析进一步证明了该纳米药物的良好稳定性,同时4 ℃和33 ℃温度释放曲线表明该纳米药物在眼表环境下(33 ℃)具有良好的释放性;其中Zeta电位结果显示,PFOB@Lip纳米微球带负电荷电位,负载MMC药物后,PFOB@Lip-MMC纳米药物带正电荷,说明大部分药物负载于脂质体内部,形成表面带正电荷的纳米脂质体,这有利于与带负电荷的细胞膜相互作用,增强细胞对载药纳米粒的摄取。有研究表明,在泪液的黏蛋白层中,糖基侧链中含有大量COO-和SO3-,使眼球表面附带负电荷,正负电荷的静电作用将有助于延长载药纳米微球的眼表滞留时间,更好地发挥药物的治疗作用[18-19]。
脂质体几乎无毒性,具有良好生物安全性。有研究发现,脂质体浓度为2.0 g·L-1时仍未对结膜上皮细胞产生任何毒性[20-21]。本研究进一步采用CCK-8、流式细胞术及活/死染色分析了MMC和PFOB@Lip-MMC的生物安全性,结果表明,随着MMC浓度的增加,PFOB@Lip-MMC纳米药物的细胞活力明显高于直接使用MMC,特别是在MMC药物浓度非常高(80 mg·L-1)的情况下,PFOB@Lip-MMC组细胞仍然保持良好的细胞活力。进一步将MMC和PFOB@Lip-MMC中MMC浓度设置为5 mg·L-1,与HPF共同孵育24 h后行细胞活/死染色检查发现,PFOB@Lip-MMC溶液中的细胞存活率明显高于MMC溶液;流式细胞术进一步从数据角度验证了该观点。上述结果均表明,MMC和纳米载体结合后,药物毒性降低,新合成的纳米药物PFOB@Lip-MMC生物安全性良好。
眼表炎症是翼状胬肉术后复发的重要因素,研究表明,炎症细胞因子IL-1β、TNF-α、PGE2及VEGF等在翼状胬肉的发生和发展中发挥重要作用,通过抑制IL-1β、TNF-α、PGE2及VEGF的表达可显著降低翼状胬肉术后复发率[16-17]。因此,本研究通过体外实验检测了MMC和PFOB@Lip-MMC的抗炎效果,炎症化的HPF经过PFOB@Lip-MMC治疗后,炎症细胞数量明显减少,细胞体积变小;同时DiI荧光标记的PFOB@Lip-MMC纳米药物在细胞质中的弥漫性分布进一步说明了该纳米药物对于炎症化的HPF具有良好的渗透性。采用流式细胞术检测经MMC和PFOB@Lip-MMC处理后的炎症化HPF的存活率,结果显示,PFOB@Lip-MMC组炎症化HPF凋亡率明显高于MMC组;同时在体外实验中,检测正常HPF和经PBS、PFOB@Lip、MMC及PFOB@Lip-MMC处理过后的炎症化HPF中IL-1β、TNF-α、PEG2及VEGF等细胞因子的表达,实时定量PCR结果显示,经MMC和PFOB@Lip-MMC处理后,4种炎症因子的表达均下调,其中PFOB@Lip-MMC组中4种炎症因子的表达下降最明显。上述结果表明,与单独使用MMC治疗相比,MMC与纳米载体相结合后,药物作用时间延长,纳米药物对细胞增殖的抑制作用明显增强,可达到有效降低眼表炎症的目的,降低翼状胬肉术后复发风险。
4 结论
本研究成功合成了一种新型的抗翼状胬肉术后复发的纳米药物PFOB@Lip-MMC,该纳米药物具有良好的生物相容性、缓释效应和抗炎效果,可以有效降低翼状胬肉术后眼表炎症反应,为翼状胬肉术后降低复发率提供了一种新的治疗思路。

