组织激肽释放酶家族在病原微生物感染中的作用
尚雪恬 潘丽萍
组织激肽释放酶(tissue kallikrein-related peptidase, KLK)家族广泛分布于皮肤、胰腺、肾脏、肺脏、心血管、肾上腺和前列腺等组织[1]。一直以来,KLK在心血管、癌症等慢性病领域中研究较多,而在病原微生物感染领域知之甚少。近年来,逐渐有研究发现KLK可以通过切割病原体表面关键蛋白、激活多种宿主受体、调控激肽系统等方式参与机体多种生理活动,在病毒、细菌、真菌感染中发挥重要作用,影响病原微生物感染的进程[2-3]。但是,尽管KLK家族蛋白在各类微生物感染中有一定的研究,而且也发现部分家族蛋白在结核感染和结核病发病中发挥作用,但迄今为止,并无该家族在感染性疾病及结核病领域方面的总结研究。因此,笔者通过梳理KLK家族蛋白在感染性疾病发病中或宿主抗感染过程中的具体作用及功能机制,对KLK家族在感染性疾病领域的研究现状进行总结,这将为未来在结核病领域更广泛地开展针对于KLK家族蛋白的功能和机制研究提供一定的研究思路和方向。
一、KLK家族及生物学活性
1.KLK家族:KLK家族是丝氨酸蛋白酶家族中一种具有胰蛋白酶或胰凝乳蛋白酶性质的蛋白水解酶亚群,由15个保守基因(KLK1~KLK15)编码的分泌丝氨酸蛋白酶组成,编码基因均位于19q13.4区域,是人类基因组中最大的蛋白酶基因簇[4]。激肽释放酶这一概念最初用于描述人胰腺中能产生激肽的物质,此后又陆续鉴定出10余种激肽释放酶相关肽酶[4],目前主要分为血浆激肽释放酶(plasma kallikrein, PK)和组织激肽释放酶家族(tissue kallikrein,TK)[3]两大类。KLK家族不仅广泛分布于各种组织中,也表达于多种免疫细胞(如中性粒细胞)、肺巨噬细胞,以及血浆、尿液、唾液、泪液和汗液等多种体液中[5-7]。
2.KLK生物学活性:所有的KLK蛋白都是以前肽的形式合成的,分泌后进行蛋白质水解处理,去除前肽,转化为具有酶活性的成熟形式,并释放到血液中,其活性可以被抑肽酶和激肽酶相关肽酶抑制剂抑制[4]。近些年发现,KLK可以水解多种病毒和细菌的关键蛋白。由于微生物感染机制的不同,在病毒感染中多表现为促进病毒感染,如流感病毒;在细菌感染中则表现为干扰细菌的定植,如奈瑟菌[8-9];在结核分枝杆菌感染中,KLK可以通过调节自噬、凋亡和促炎症因子释放发挥其抗菌作用。KLK是激肽释放酶-激肽系统(kallikrein-kinin system, KKS)的重要成员,可以水解激肽原产生激肽,而激肽是一种具有促炎活性的生物活性肽,可以诱导不同类型的细胞释放前列腺素,诱导内皮细胞释放一氧化氮(NO)[10]。人中性粒细胞可以分泌KLK1、KLK6、KLK10、KLK13和KLK14,这些激肽释放酶可能通过水解组织中的激肽原产生激肽而维持炎症状态[6]。KLK除了可以调控激肽释放酶-激肽系统外,还可以激活肝细胞生长因子(HGF)和尿激酶纤维蛋白溶酶原激活剂受体(urokinase plasminogen activator receptor, uPAR)等分子来促进肺结核患者肺部炎症[11]。
二、KLK与病原微生物感染
由于KLK的酶活性作用可以水解多种蛋白,因此,能够参与包括病毒、细菌和真菌在内的多种病原微生物的感染过程。但是,目前的研究提示在不同微生物感染过程中KLK发挥的作用及机制均有所不同(表1),现笔者参照功能分类阐述KLK在不同病原微生物感染中的作用机制并进行总结归类,为KLK在结核分枝杆菌感染中的机制研究提供思路。
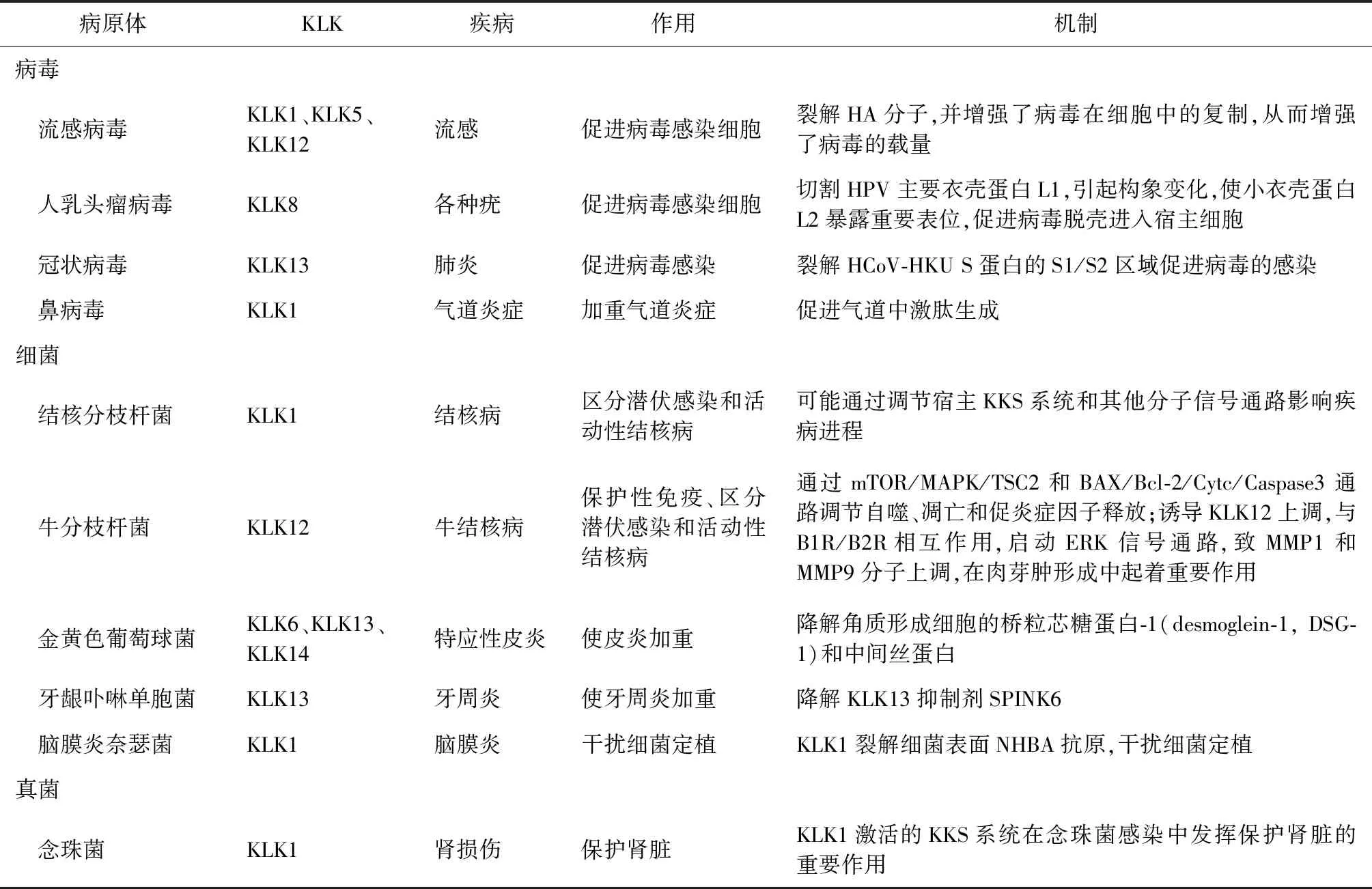
表1 KLK家族基因在不同病原微生物感染中的作用
(一)KLK可水解微生物表面关键蛋白
很多病毒需要通过表面关键蛋白裂解活化后才能感染宿主细胞。在流感病毒感染宿主细胞过程中血凝素(hemagglutinin, HA)介导的与细胞表面受体结合及膜融合是不可或缺的步骤[12]。流感病毒的血凝素被丝氨酸蛋白酶水解激活后才具有感染性。Magnen等[9]发现流感病毒感染体外重组的人支气管上皮细胞后,会引发KLK1和KLK5表达增加,因此,流感发病期患者的下呼吸道分泌物中KLK1和KLK5含量增加,其丝氨酸蛋白酶活性能够水解激活流感病毒血凝素,进一步促进病毒感染;同时还发现,使用KLK5选择性抑制剂预处理气道分泌物并与病毒粒子共同孵育,可显著降低流感病毒的激活,从而抑制病毒侵染细胞。另有研究发现,在流感期间小鼠肺部的KLK1分泌增加,而组织激肽释放酶结合蛋白水平下降,KLK1裂解血凝素分子,并增强病毒在细胞中的复制,从而增强病毒的载量;相反,酶结合蛋白通过抑制KLK1介导的血凝素裂解可以减少病毒的产生[13]。有研究表明,不同KLK对不同亚型的流感病毒的蛋白切割有选择性,如KLK5切割流感病毒蛋白H1和H3最有效,而KLK12切割H1和H2最有效;另外,纤溶酶、尿激酶和前激酶不仅是活性胰蛋白酶样蛋白酶的前体,还可以激活流感病毒;在流感病毒感染后,这些酶原集中在呼吸道组织损伤的部位,也可能被KLK5和KLK12激活,进一步促进流感病毒的感染[14]。人乳头瘤病毒(human papillomavirus, HPV)衣壳蛋白L1、L2构象改变在病毒入侵细胞的过程中十分关键。KLK8可以介导切割HPV主要衣壳蛋白L1,引起构象变化,使小衣壳蛋白L2暴露重要表位,促进病毒脱壳进入宿主细胞[15]。但另有研究发现,亲环素和弗林蛋白酶介导的结构修饰可以使L2的N端暴露,导致病毒内化的时间缩短,使结合到细胞表面的病毒快速内化;而KLK8裂解引起的构象变化则对病毒的内化没有影响,使其在组织细胞感染过程中的切割效率较低,不能使病毒更同步或更快速地进入细胞[16],故KLK8是否促进HPV病毒的感染还需进一步研究。Milewska等[17]使用冠状病毒HCo-HKU1感染人气道上皮细胞后,发现KLK13的表达增加,而使用化学方法或短发夹RNA(shRNA)将KLK13阻断后则可使病毒感染减少;同时,他们还证实KLK13裂解HCoV-HKU S蛋白的S1/S2区域可促进病毒的感染。
KLK的丝氨酸酶活性也可以水解细菌表面抗原,干扰细菌感染。研究发现,唾液中的KLK1可以裂解脑膜炎奈瑟菌表面的奈瑟菌肝素结合抗原(neisserial heparin binding antigen, NHBA),该抗原是一种脂质抗原,不仅可以促进细菌在人血清中的存活,还可能在脑膜炎奈瑟菌定植的黏附步骤中发挥关键作用[8]。
虽然目前尚未有KLK裂解结核分枝杆菌表面蛋白或分泌蛋白进而调控结核分枝杆菌入侵的报道,但如同脑膜炎奈瑟菌感染中KLK1可以裂解脂质抗原NHBA一样,结核分枝杆菌表面也有很多其他的脂质抗原,所以并不能排除KLK也可能通过裂解结核分枝杆菌表面脂质抗原来影响结核分枝杆菌的入侵。除了裂解病原微生物蛋白之外,KLK家族蛋白还可能通过调控宿主其他生理和病理作用来影响结核病的发生和发展。
(二)KLK通过激肽释放酶-激肽系统影响感染进程
激肽是由激肽原经激肽释放酶的作用而产生,通过激肽酶水解而失活。这一过程中参与的各种因子组成了激肽释放酶-激肽系统。激肽释放酶-激肽系统包括激肽释放酶、激肽原、激肽(缓激肽和胰激肽)、激肽受体及激肽酶。目前已经发现激肽受体和激肽系统的其他成分参与了诸多感染性疾病,包括新型冠状病毒感染、念珠菌病和结核病等。
研究发现,下呼吸道速发超敏反应与激肽释放酶-激肽系统密切相关,缓激肽(bradykinin, BK)及其受体参与了其中一系列的病理改变。在实验性感染鼻病毒的受试者中,上呼吸道症状的严重程度与鼻分泌物中的激肽生成水平直接相关,鼻病毒诱导KLK1激活可能导致气道炎症和哮喘加重[18-19]。研究表明,新型冠状病毒感染患者可能存在缓激肽相关通路的失调,缓激肽可能引发新型冠状病毒感染患者的细胞因子风暴和肺水肿[20-21],阻断激肽系统可以预防患者出现急性呼吸窘迫综合征,并且通过阻断激肽系统中KLK的产生、降解激肽、下调激肽受体等不同环节来减少或降低新型冠状病毒感染的相关症状和疾病恶化[2]。此外,Ramani等[22-23]发现白细胞介素17(IL-17)在白色念珠菌感染的肾脏中诱导KLK1表达,导致肾小管上皮细胞高表达KLK1,通过激肽释放酶-激肽系统产生缓激肽,并作用于缓激肽受体B1R和B2R,通过限制肾脏驻留细胞的凋亡来保护全身真菌感染期间的肾功能,防止播散性念珠菌感染后免疫活性小鼠的肾损伤;同时在小鼠实验中,过表达KLK1和使用缓激肽治疗可以使IL-17-/-小鼠感染念珠菌后存活时间延长;而使用抑制剂阻断野生型小鼠的缓激肽受体B1R和B2R后则存活时间缩短。由此可见,KLK1激活的激肽释放酶-激肽系统在念珠菌感染中发挥着保护肾脏的重要作用;同时基于KLK1受到IL-17的调控,侧面说明了KLK1与炎症反应相关。如前所述,激肽的激活在呼吸道感染中会加重炎症和呼吸道疾病,在肺结核患者中激肽释放酶-激肽系统是否也会加重患者的临床症状将有待进一步研究。
虽然目前关于KLK家族蛋白在结核病发生发展中的作用机制研究相对较少,但已有报道发现与KLK家族蛋白功能相关的激肽释放酶-激肽系统在结核病中发挥重要作用。随着患者从预处理到治疗早期、延长给药阶段和治疗结束这一周期内,活动性结核病患者循环水平的缓激肽和脱精氨酸9缓激肽(des-Arg9-BK)的浓度均下降,二者可以诱导炎症和先天性免疫反应[24]。在结核分枝杆菌感染的小鼠脾脏和肺脏中缓激肽受体 B1R均上调,应用B1R阻断剂对菌落形成单位(CFU)计数有明显抑制作用[25]。由此可推测,激肽释放酶-激肽系统与结核分枝杆菌的感染活动有关。此外,有研究发现KLK1基因可能作为活动性结核病患者与结核分枝杆菌潜伏感染者鉴别诊断的生物标识[26]。这些研究均提示KLK1作为激肽释放酶-激肽系统的关键分子,可能通过该系统调控体内结核分枝杆菌的增殖,但其中涉及的具体分子及机制仍有待进一步研究。
(三)KLK通过激活其他宿主蛋白影响感染进程
KLK除了参与激肽释放酶-激肽系统外,还可以激活其他宿主蛋白。研究发现,KLK4和KLK5可以激活肝细胞生长因子激活因子(hepatocyte growth factor activator, HGFA)。HGFA是一种丝氨酸蛋白酶和原肝细胞生长因子/分散因子(pro-HGF/SF)的有效激活剂,因此,KLK可以间接激活肝细胞生长因子[27],参与肺部炎症。有研究发现,活动性肺结核患者血清肝细胞生长因子水平升高,疾病稳定后血清肝细胞生长因子水平降低[28]。He等[29]采用Luminex多因子检测技术分析活动性结核病、结核分枝杆菌潜伏感染和健康对照组中受早期分泌抗原靶6(ESAT-6)蛋白刺激的外周血单个核细胞分泌的细胞因子,发现肝细胞生长因子可以有效区分结核分枝杆菌潜伏感染与健康对照组。有研究对比分析发现肺军团菌病、肺结核及其他细菌感染患者的血清肝细胞生长因子水平均高于健康对照组[30]。也有研究表明,KLK可以激活uPAR,而血清可溶性uPAR在活动性结核病患者中的表达水平升高,在患者治疗效果较好时降低,因此,认为血清可溶性uPAR水平可以用于指导结核病的治疗管理[31]。Araujo等[32]研究也发现,抗肽P-12034 IgG和uPAR联合检测可用于鉴别结核病患者。这说明KLK可能在结核病发病过程中通过这些受体发挥作用,但对于KLK是如何通过各种受体调节机体对结核分枝杆菌感染免疫应答的具体过程和机制还需要进一步深入探讨。
作为蛋白酶,KLK成员还可以降解其他宿主蛋白。在金黄色葡萄球菌引发的特应性皮炎中,金黄色葡萄球菌能够刺激人胶质细胞,增加其内源性蛋白酶的活性,同时能够诱导KLK6、KLK13和KLK14表达,降解角质形成细胞的桥粒芯糖蛋白-1(desmoglein-1, DSG-1)和中间丝蛋白,使皮炎加重[33]。桥粒形成受损会导致肺上皮屏障功能受损[34],因此,KLK是否通过降解各种连接蛋白破坏肺上皮细胞的屏障作用来加重肺结核患者肺部病理变化值得进一步研究。此外,病原蛋白与宿主蛋白相互作用是感染的重要介质。有研究发现,牙龈卟啉单胞菌分泌的牙龈菌蛋白酶(gingipains)既能降解KLK13抑制剂SPINK6,又能激活KLK13蛋白,加重对组织的损伤,加重牙周炎[35]。因此,基于结核分枝杆菌也可分泌多种蛋白和酶类[36],也可认为其有可能通过与宿主蛋白之间的相互作用起到激活或抑制KLK活性的作用,进而影响感染进程。
(四)KLK通过调控各类信号通路影响感染进程
Sabir等[37]研究发现,KLK12在牛分枝杆菌感染的小鼠原代巨噬细胞中上调,可通过mTOR/MAPK/TSC2和BAX/Bcl-2/Cytc/Caspase3通路调节自噬、凋亡和促炎症因子的释放,在保护性免疫应答调节中发挥重要作用;同时,牛分枝杆菌特异性抗原ManLAM也可诱导感染后的巨噬细胞内的KLK12上调,并与缓激肽受体B1R/B2R相互作用,启动ERK信号通路,导致基质金属蛋白酶MMP1和MMP9分子的表达上调,在肉芽肿形成中起着重要作用。另外,KLK12在牛结核病和牛结核分枝杆菌潜伏感染模型中差异表达,可用作区分潜伏性和活动性牛结核病的血清学标记物[38]。研究发现,KLK家族蛋白参与多种信号通路[39],包括KLK4可以调控ERK/AKT信号通路[40]、KLK8可以调控MAPK信号通路[41]、KLK3可以调控Wnt信号通路等[42]。尽管目前尚未有报道关于上述KLK家族蛋白与结核病发生发展的相关研究,但这些信号通路均与结核病的发生发展密切相关[43],因此,KLK家族蛋白在结核病的发生发展过程中是否通过上述信号,抑或通过其他信号通路影响宿主内结核分枝杆菌的存活及疾病进程,仍需要进一步研究。
三、总结和展望
尽管目前的研究已经发现KLK可以通过切割病毒蛋白促进病毒感染、调控经典的激肽释放酶-激肽系统,或调控宿主特定蛋白、影响信号通路等方式参与到病毒、细菌、真菌等微生物感染后的疾病进程中,但具体的分子、机制、调控通路等并未能完全清晰阐释。此外,现有数据表明,在不同微生物感染中KLK家族蛋白发挥的作用可能有所差别,但具体差别如何尚需要更深入和广泛的研究。另外,既往研究发现的这些KLK家族基因,是否可以作为微生物感染的生物标志物,通过靶向这些KLK是否能够发挥治疗作用也未能确定。再者,KLK并非独立存在,可能是作为复杂蛋白酶网络的一部分在发挥作用,而我们对于调控这些KLK的复杂的蛋白网络的理解并不完整。特别是在结核感染和结核病研究领域,目前仅发现KLK1和KLK12具有鉴别诊断结核病和结核分枝杆菌潜伏感染的潜力,且针对上述两个分子在结核病发病中的作用和机制解析尚不够深入,对KLK家族其他分子是否具备作为结核病诊断或治疗靶标的潜力,其作用机制如何,也需要进一步广泛研究。
笔者通过对KLK家族蛋白既有研究的梳理和总结,展现了KLK作用机制的多样性与复杂性,同时也提示该家族在病原微生物感染领域中可能存在较好的研究潜质,对KLK家族蛋白功能及作用机制的深入研究,可能为后续研发靶向KLK的新型抗感染药物提供较好的理论基础。因此,未来应在感染领域加深对KLK家族基因功能和机制的相关研究,以明确其在病原微生物感染中的具体作用并指导临床应用。
利益冲突所有作者均声明不存在利益冲突
作者贡献尚雪恬:查阅文献、撰写初稿;潘丽萍:文献审核、修改文稿、基金支持

