酶水解柴胡皂苷B1 制备稀有前柴胡皂苷A 的研究
徐天真,吴梦茹,邵佳丽,常 悦,朱烨婷,陈季璇,陈璐阳,陈登艳,杨 欢,夏国华*
(1.如皋市人民医院药剂科,江苏 如皋 226500; 2.南通大学附属如皋医院药剂科,江苏 如皋 226500;3.江苏大学药学院,江苏 镇江 212013)
中药柴胡是伞形科植物柴胡BupleurumchineseDC.或狭叶柴胡B.scorzonerifoliumWilld.的干燥根,分别习称“北柴胡” 和“南柴胡”[1],用药历史悠久,始载于《神农本草经》,性辛、苦,微寒,具有疏散退热,疏肝解郁,升举阳气等功效。柴胡皂苷是柴胡的主要有效成分,具有抗肿瘤、抗炎等药理作用[2-5],其齐墩果烷型分子结构较大,限制了其通过口服吸收进入体循环。前柴胡皂苷A 是柴胡皂苷B1脱除一分子葡萄糖基后的次级苷[6-8]。现代药理研究表明,前柴胡皂苷的药理活性高于其原生苷[9],且更易被小肠吸收,因此研究者围绕该类中药活性成分的制备技术开展了一些研究,主要有化学法、微生物转化法[10-12]。但是由于其在原植物中的含量很低,传统色谱分离手段难以大量制备; 化学法的副产物较多且废水污染严重; 微生物转化法亦存在副产物较多、反应条件难以控制等不足;而酶水解法反应条件温和,特异性强,已被广泛地应用于多种中药苷类活性成分的转化反应[13-16]。因此,本文通过酶水解柴胡皂苷B1获取前柴胡皂苷A,进而采用单因素和响应面实验对水解条件进行考察及优化,建立了关键技术,从而为大量制备前柴胡皂苷系列成分以开展药理药效研究奠定基础。
1 材料
HP1100 型高效液相色谱仪(HPLC,美国Agilent 公司); HRQ-3110 型涡旋混匀器(美国Silentshake 公司);85-2 型控温磁力搅拌仪(江苏金怡仪器科技有限公司);AL-104 型电子分析天平(瑞士Mettler-Toledo 公司); LXQ型电喷雾质谱(ESI-MS,美国Thermo Fisher Scientific 公司); Advance Ⅱ型核磁共振仪(NMR,400 MHz,德国Bruker 公司)。
柴胡皂苷B1(纯度≥98.0%,批号18041708)由成都普非德生物技术有限公司提供。乙腈为色谱纯(美国Omni公司); 甲醇、乙酸、乙酸钠均为分析纯(国药集团上海化学试剂有限公司)。β-葡聚糖苷酶(活力≥20 000 U/g)购自江苏金穗生物科技有限公司; β-葡萄糖苷酶(活力100 U/g)购自江苏锐阳生物科技有限公司; 纤维素酶(活力≥15 000 U/g,批号20190719)购自国药化学试剂有限公司; 柚苷酶(活力100 000 U/g,批号208008)由河南百康化工产品有限公司提供; 蜗牛酶(批号S20200421)购自合肥博美生物科技有限责任公司。
2 方法
2.1 色谱条件 Kromasil-C18 色谱柱(250 mm×4.6 mm,5 μm); 流动相乙腈(A)-水(B),梯度洗脱(0 ~10 min,35% ~50% A; 10 ~20 min,50% ~60% A; 20 ~25 min,60% ~35% A); 体积流量1.0 mL/min; 柱温30 ℃; 检测波长250 nm; 进样量20 μL。
2.2 标准曲线 精密称取柴胡皂苷B1对照品9.840 mg,置于10 mL 量瓶中,甲醇溶解并稀释至刻度,得到质量浓度0.984 0 mg/mL 的对照品储备液。按照二倍稀释法制备得到一系列对照品溶液,0.20 μm PTFE 微孔滤膜过滤,取续滤液,在“2.1” 项色谱条件下测定。以柴胡皂苷B1质量浓度为横坐标(X),以峰面积为纵坐标(Y)进行回归,得方程为Y=42.343X+8.615 9 (R2=0.999 1),在0.120 1~123.0 μg/mL 范围内线性关系良好。
2.3 酶水解柴胡皂苷B1分别吸取柴胡皂苷B1溶液和酶溶液(0.20 mol/L HAc-NaAc 缓冲液)置于离心管中,在一定温度下孵育一段时间。待反应结束后,向水解液中加入等体积甲醇,涡旋混匀。12 000 r/min 高速离心10 min,0.45 μm 微孔滤膜过滤,取续滤液用于HPLC 分析,以不加酶的反应体系为空白对照。
2.4 单因素试验 以柴胡皂苷B1转化率为指标,采用单因素实验考察了水解酶(β-葡萄糖苷酶、β-葡聚糖苷酶、纤维素酶、蜗牛酶)、缓冲液pH (3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5)、酶-底物质量比(0.5 ∶1、1 ∶1、2 ∶1、3 ∶1、4 ∶1、5 ∶1、10 ∶1、15 ∶1、20 ∶1、30 ∶1、40 ∶1、50 ∶1、60 ∶1)、反应温度 (30、40、50、60、70 ℃)和反应时间(12、24、36、48、60、72 h)对酶水解柴胡皂苷B1转化率的影响。
2.5 Box-Behnken 响应面法 在单因素试验的基础上,以柴胡皂苷B1转化率为响应值,进行响应面实验设计(Design-Expert v8.0.6.1); 此外,对预测所得最佳反应条件进行验证,并考察实际值与预测值的相对误差。响应面实验设计因素及水平见表1,模型回归方程为Y=β0+。式中Y为柴胡皂苷的转化率,β0为拦截系数,βi为线性项,βii为二次项,βij为交互项,Xi、Xj为自变量编码值(i≠j,i,j=1,2,3,……,k)。
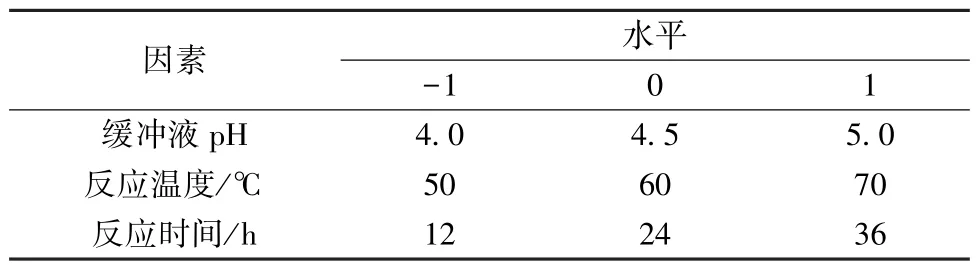
表1 因素水平
2.6 酶解产物的结构鉴定 酶水解结束后,通过反相柱层析对酶解产物进行纯化,并采用LC-MS、1H-NMR 和13CNMR 对其化学结构进行鉴定。
3 结果
3.1 HPLC 色谱图 按“2.1” 项下HPLC 分析条件对前柴胡皂苷A、柴胡皂苷B1及其酶解液进行分析。如图1 所示,柴胡皂苷B1及其水解产物前柴胡皂苷A 均能得到较好地分离(R>1.5)。

图1 柴胡皂苷B1 对照品(A)、前柴胡皂苷A 对照品(B)和柴胡皂苷B1 酶解液(C)的HPLC 色谱图(250 nm)
3.2 单因素试验结果
3.2.1 水解酶 如图2 所示,4 种酶均可以选择性地脱去柴胡皂苷B1末端的葡萄糖,生成前柴胡皂苷A,其中蜗牛酶所得的转化率远高于其他3 种酶。这可能是由于蜗牛酶含有纤维素酶、β-D-葡糖糖苷酶、淀粉酶、蛋白酶等20 多种酶,其中的一些酶对葡萄糖苷键具有较强的水解作用。相比单一酶来说,蜗牛酶这种复合酶对于葡萄糖苷键的水解更有优势。因此,在后续实验中选择了蜗牛酶。
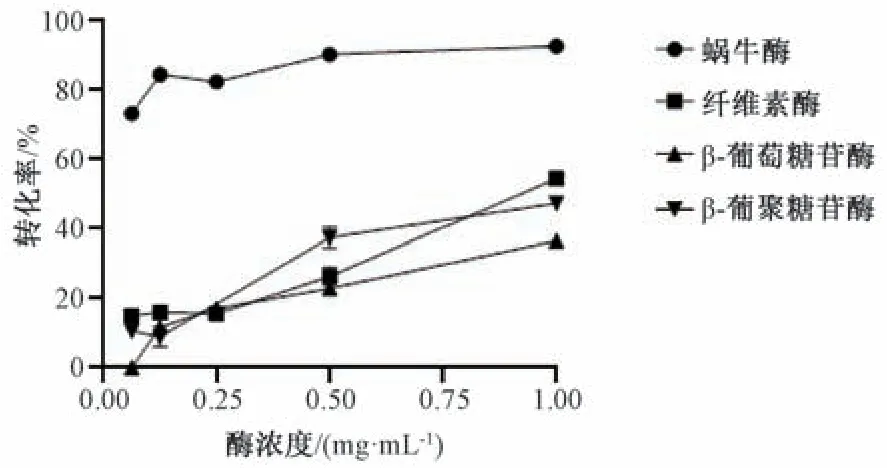
图2 不同浓度水解酶对柴胡皂苷B1 转化率的影响
3.2.2 酶/底物质量比 如图3A 所示,当质量比由4 ∶1提高到30 ∶1 时,转化率从94%增加至99%,继续提高质量比,则转化率变化不明显。因此,最佳酶/底物质量比为30 ∶1。

图3 单因素对柴胡皂苷B1 转化率的影响
3.2.3 缓冲液pH 如图3B 所示,在pH3.0~4.5 范围内,随着缓冲液pH 升高,转化率逐渐升高,并在pH4.5 时达到最高值99.5%,但是将pH 进一步提高至5.5 后,转化率明显下降,当pH 为6.5 时,转化率仅为81.2%。因此,最佳缓冲液pH 值为4.5。
3.2.4 反应温度 如图3C 所示,蜗牛酶对柴胡皂苷B1的转化效果随着温度的升高呈现先增加后减弱的趋势,并在60 ℃时达到最大值; 当温度继续升高时,酶蛋白开始变性失活,导致转化率下降。因此,最佳反应温度为60 ℃。
3.2.5 反应时间 如图3D 所示,柴胡皂苷B1被蜗牛酶水解12 h 之后,转化率可达95%,延长水解时间至24 h,转化率可进一步提高到99%; 此后,转化率保持平稳。综合考虑柴胡皂苷B1转化率和节约时间,选择24 h 作为最佳酶水解时间。
3.3 响应面试验结果
3.3.1 回归方程及显著性分析 通过Box-Behnken 响应面实验设计考察了缓冲液pH (X1)、反应温度(X2)和反应时间(X3)对柴胡皂苷B1转化率的影响,实验结果见表2。
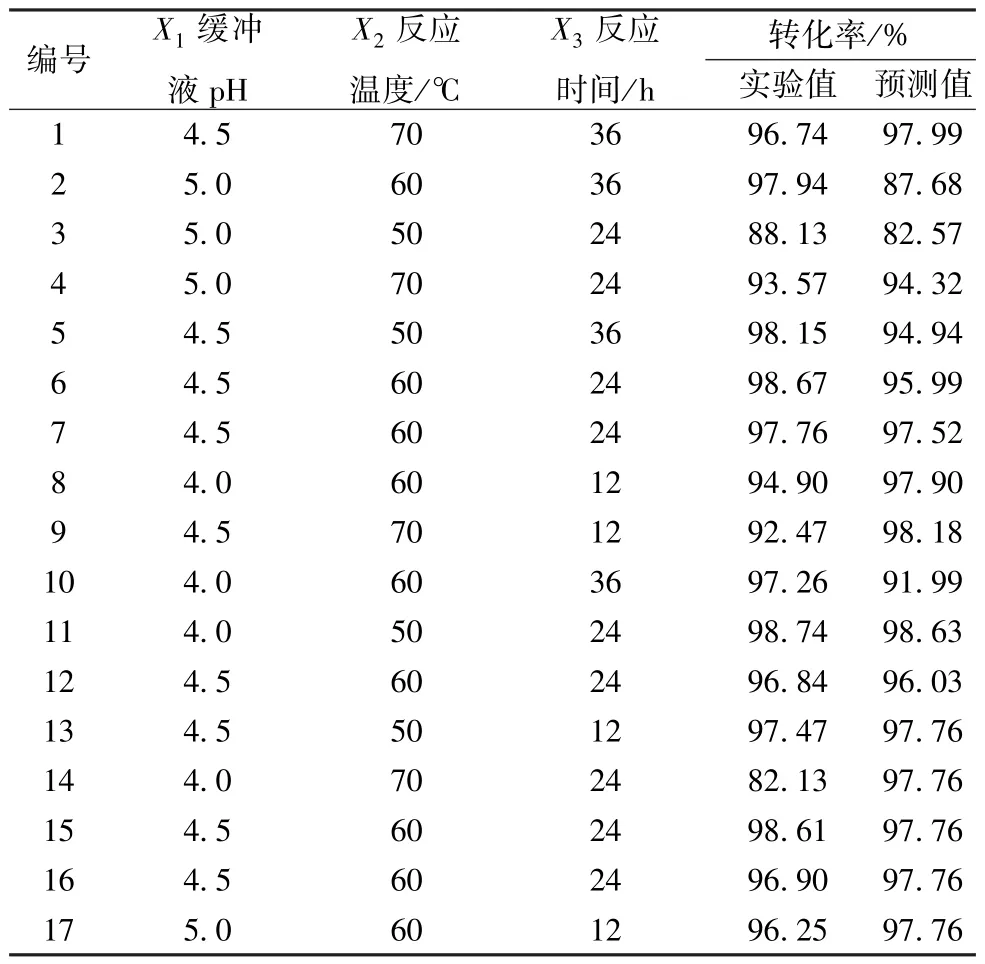
表2 响应面实验设计与结果
将以上所得数据进行多元回归分析,得到拟合方程Y=97.76 +0.36X1- 2.20X2+1.12X3+5.51X1X2- 0.17X1X3+0.90X2X3-3.37X21- 3.75X22+2.20X23。此外,以转化率为响应值对各因素的显著性进行分析(表3),P<0.000 1 且失拟项不显著,可见所得模型能准确分析和解释模型中各因素对响应值的影响; 同时,反应温度的升高不利于转化率的增加,而较长的反应时间和较高的缓冲液pH 则有利于提升柴胡皂苷B1转化率。从二次项的P值分析可知,X12(P=0.0002)、X22(P<0.0001)、X32(P=0.0020)均小于0.05,三者对柴胡皂苷B1的转化率具有显著性影响。

表3 二阶多项回归方程方差分析
3.3.2 反应时间和缓冲液pH 对柴胡皂苷B1转化率的影响 反应时间和缓冲液pH 的交互作用见图4。当体系中pH为4.5 时,随着反应时间的增加,柴胡皂苷B1转化率缓慢上升后趋于稳定; 当反应时间为24 h 时,转化率随着pH值的增加呈现先增加后降低的趋势,pH 偏高或偏低时会影响蜗牛酶与底物的结合,降低反应速率。

图4 交互项(反应时间和缓冲液pH)对柴胡皂苷B1转化率的影响
3.3.3 反应温度和缓冲液pH 对柴胡皂苷B1转化率的影响 反应温度和缓冲液pH 的交互作用见图5。当反应温度为60 ℃时,随着体系中pH 升高,柴胡皂苷B1转化率先上升后下降; 当pH 4.5 时,转化率随着温度的升高呈现出相同的趋势,即先增加后降低,表明反应温度和缓冲液pH 过高或过低均不利于酶水解反应的进行。

图5 交互项(反应温度和缓冲液pH)对柴胡皂苷B1转化率的影响
3.3.4 反应温度和反应时间对柴胡皂苷B1转化率的影响 反应温度和反应时间的交互作用见图6。当反应温度为60 ℃时,随着反应时间的增加,柴胡皂苷B1转化率先上升后趋于稳定; 当反应时间为24 h 时,转化率随着温度的升高先增加后迅速降低。
3.3.5 最佳水解条件及验证试验 通过Design-expert 8.0.6.1 软件优化后得到蜗牛酶水解柴胡皂苷B1的最佳反应条件为反应温度55.78 ℃,反应时间33.24 h,缓冲液pH
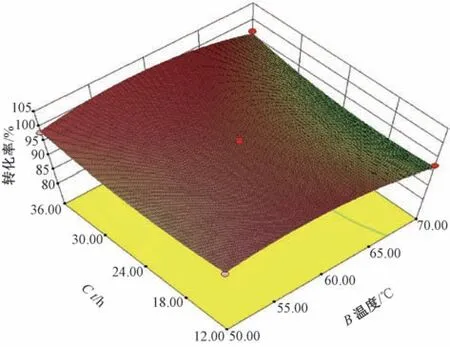
图6 交互项(反应温度和反应时间)对柴胡皂苷B1转化率的影响4.36,并对其进行验证,考虑到实验的实际可操作性,将水解条件调整为反应温度56 ℃,反应时间33 h,缓冲液pH 4.5; 在此条件下,3 次平行实验所得的柴胡皂苷B1转化率为99.1%,与预测值100.2%基本相符,表明优化得到的酶水解条件与实际拟合度较好。
3.4 酶解产物的结构鉴定 ESI-MSm/z:641[M+Na]+。1H-NMR (400 MHz,DMSO-d6)δ:0.58 (s,24-CH3),0.66 (s,26-CH3),0.73 (s,29-CH3),0.84(s,25-CH3),0.90 (s,30-CH3),0.93 (s,27-CH3),1.22 (d,H-6′),4.33 (d,H-1′),5.55 (dd,H-11),6.35 (dd,H-12);13C-NMR (100 MHz,DMSO-d6)δ:38.0(C-1,19),25.5 (C-2),80.3 (C-3),43.0 (C-4),46.6(C-5),18.7 (C-6),32.0 (C-7),40.4 (C-8),54.0 (C-9),36.1 (C-10),126.8 (C-11),125.4 (C-12),135.7(C-13),43.8 (C-14),34.2 (C-15),75.4 (C-16),43.7(C-17),133.2 (C-18),32.6 (C-20),34.8 (C-21),29.7 (C-22),63.1 (C-23),12.9 (C-24),17.7 (C-25),17.2 (C-26),21.9 (C-27),62.8 (C-28),24.9 (C-29),32.4 (C-30),105.2 (3-O-Fuc-C-1′),74.1 (C-3′),71.6(C-2′),71.4 (C-4′),70.2 (C-5′),17.0 (C-6′)。以上数据与文献[17-18]报道基本一致,故鉴定该化合物为前柴胡皂苷A。
4 结论与讨论
本研究基于酶水解构建了从柴胡皂苷B1制备稀有前柴胡皂苷A 的关键技术。与传统酸水解相比,该方法可方便地获取柴胡次级苷,而不产生柴胡皂苷元副产物; 而且在反应过程中不使用无机酸,因此是一种清洁的水解技术。本文所建立的酶水解关键技术,可为大量制备前柴胡皂苷A 以开展药理药效研究奠定基础。
采用单因素和响应面相结合的方法对酶水解条件进行优化,并利用LC-MS、NMR 确定产物的化学结构。结果表明,柴胡皂苷B1的最佳水解酶为蜗牛酶,当酶/底物质量比为30 ∶1、酶解反应时间33 h、酶解反应温度56 ℃、缓冲液pH 4.5 时,柴胡皂苷B1转化率高达99.1%,产物为前柴胡皂苷A。
中药活性成分包括三萜类、黄酮类、蒽醌类、甾体类、生物碱类等,是中医药在临床实践中发挥防病治病作用的重要物质基础,同时也是现代医药产业中备受关注的药用分子实体,其新型制备技术是近年来较为活跃的研究领域。本文所构建的酶水解法具有效率高和操作方便等优点,利用该技术从天然产物中获取生物活性化合物(包括次级苷或苷元)具有良好的发展潜力。

