基于ITS 和ITS2 序列的药用石斛DNA 条形码鉴定研究
张高曼,赵立佳,刘光富,王正亮
中国计量大学生命科学学院,浙江省生物计量及检验检疫技术重点实验室,浙江 杭州 310018
石斛是兰科(Orchidaceae)石斛属DendrobiumL.多年生草本植物,我国有近80 种,其中一半以上种类具有药用价值,是中国传统的名贵中药材,素有“人间仙草”之称[1]。现代药理学研究表明,药用石斛富含多糖、黄酮、生物碱和香豆素等化学成分,在抗衰老、抗肿瘤、降血糖和调节机体免疫等方面功效显著[2]。随着居民生活水平的提高和对健康饮食的追求,近年来我国药用石斛市场需求量逐年增加。然而,石斛对生长条件要求苛刻、生长周期长、繁殖率低,无法满足日益增长的消费需求。在高额利益的驱动下,一些不法商家在药用石斛生产和销售过程中掺伪造假、以次充好,如以相对廉价的紫皮石斛、棒节石斛、铜皮石斛冒充高价的铁皮石斛和霍山石斛出售,严重影响了石斛产业的可持续发展[3-4]。因此,为有效保障消费者权益和稳定市场秩序,迫切需要建立快速准确的药用石斛种类鉴定技术体系。
目前,石斛种类鉴定技术主要包括传统鉴定技术、光谱和色谱鉴定技术以及分子鉴定技术。传统鉴定方法主要基于形态特征,而石斛在非花期及近缘种间外观极其相似,精深加工后更加难以准确区分[5];光谱和色谱鉴定技术依据不同石斛理化特征差异进行鉴别,但该方法依赖昂贵仪器,且存在样品前处理过程复杂繁琐、操作耗时、成本较高等缺点,无法满足快速和低成本的需求[6-7]。基于核酸检测的分子鉴定技术不受植物生长环境、发育阶段、样品形态和组织部位的限制,是目前石斛种类鉴别过程中比较主流和权威的方法,具有操作简单快速、结果准确可靠的优点[8-10]。其中DNA 条形码技术(DNA barcoding)是利用生物体DNA 中一段标准化的短基因片段对物种进行快速鉴定的新兴分子鉴定技术,近年来已被广泛应用于包括石斛在内的诸多药用植物的种类快速鉴别[11-13]。如基于叶绿体trnH-psbA片段,邵世光等[14]和Yao 等[15]分别对我国15 种和17 种药用石斛进行了准确的鉴定;陈文强等[16]通过比较分析9 条候选DNA片段(ITS2、nad1、matK、ycbL、psbK-psbI、trnL-trnF、trnG-trnS、rbcL和trnH-psbA)对11种药用石斛的分辨率,最终推荐ITS2+trnL-trnF组合片段作为铁皮石斛及其近缘种鉴别的DNA条形码。
研究表明,DNA 条形码的物种鉴定效率与待测物种集的物种数量密切相关[17]。Asahina 等[12]和刘静等[18]分别证明叶绿体序列matK可对常见的5 种和12 种药用石斛进行区分,而Singh 等[17]在评估常用植物DNA 条形码(matK、rbcL、rpoB、rpoC1、trnH-psbA和ITS)对36 种石斛属植物的种类鉴别效率时,发现matK仅能有效鉴别约80%的待测种类。徐素素等[19]对12 种药用石斛及其3 种常见混伪品的4 种DNA 条形码(ITS、ITS2、matK和trnH-psbA)进行了序列分析,结果显示ITS2 能够成功区分12 种药用石斛及其混伪品。然而,当Nguyen 等[20]将石斛物种取样数量扩大到24 种时,发现ITS2 对石斛物种鉴别效率仅为79%。目前,针对我国药用石斛DNA 条形码的研究中物种取样数量总体偏低,关于药用石斛DNA 条形码适用性相关研究有待进一步深入。为此,本研究收集了铁皮石斛、金钗石斛、细茎石斛和密花石斛等27 种药用石斛样本,以通用引物扩增其ITS 和ITS2 序列,并结合公共数据库中其他14 种药用石斛对应序列,验证DNA 条形码技术对我国41 种药用石斛的鉴定能力,旨在进一步充实我国药用石斛的DNA 条形码数据库,为药用石斛的质量控制和市场监管奠定技术基础。
1 材料与仪器
1.1 材料
本研究涉及药用石斛共41 种,其中27 种药用石斛样本采自浙江、四川、云南、安徽和广西等地区,经中国计量大学生命科学学院刘光富高级实验师鉴定,分别为鼓槌石斛D.chrysotoxumLindl.、流苏石斛D.fimbriatumHook.、金钗石斛D.nobileLindl.、铁皮石斛D.officinaleKimura et Migo、霍山石斛D.huoshanenseC.Z.Tang et S.J.Cheng、细茎石斛D.moniliforme(L.) Sw.、束花石斛D.chrysanthumWall.ex Lindl.、兜唇石斛D.aphyllum(Roxb.) C.E.C.Fisch.、密花石斛D.densiflorumLindl.ex Wall.、球花石斛D.thyrsiflorumRchb.f.、玫瑰石斛D.crepidatumLindl.ex Paxt.、喇叭唇石斛D.lituiflorumLindl.、美花石斛D.loddigesiiRolfe、晶帽石斛D.crystallinumRchb.f.、叠鞘石斛D.aurantiacumKerr.、尖刀唇石斛D.heterocarpumLindl.、长苏石斛D.brymerianumRchb.f.、紫瓣石斛D.parishiiRchb.f.、短棒石斛D.capillipesRchb.f.、报春石斛D.primulinumWall.ex Lindl.、肿节石斛D.pendulumRoxb.、细叶石斛D.hancockiiRolfe、重唇石斛D.hercoglossumRchb.f.、广东石斛D.wilsoniiRolfe、小黄花石斛D.jenkinsiiWall.ex Lindl.、杯鞘石斛D.GratiosissimumRchb.f.、大苞鞘石斛D.wardianumWarner、齿瓣石斛D.devonianumPaxt.、曲茎石斛D.flexicauleZ.H.Tsi, S.C.Sun et L.G.Xu、钩状石斛D.aduncumWall.ex Lindl.、苏瓣石斛D.HarveyanumRchb.f.、滇桂石斛D.ScoriarumW.M.Sw、少花石斛D.parciflorumRchb.f.、杓唇石斛D.Moschatum(Buch.-Ham.) Sw.、曲轴石斛D.gibsoniiLindl.、梳唇石斛D.StrongylanthumRchb.f.、勐海石斛D.MinutiflorumS.C.Chen et Z.H.Tsi、聚石斛D.lindleyiStendel、黄石斛D.TosaenseLindl.、藏南石斛D.monticolaP.F.Hunt et Summerh.和串珠石斛D.falconeriHook.。取各样本鲜茎或鲜叶,保存于−20 ℃冰箱,其余14 种药用石斛和1 种石仙桃(用于系统发育树构建的外群)序列信息来自GenBank公共数据库,具体信息见表1。

表1 药用石斛样本信息Table 1 Sample information of medicinal Dendrobium species
1.2 仪器与试剂
电子分析天平(Sartorius 公司,美国);T100 PCR仪(Bio-Rad 公司,美国);涡旋混合器(IKA 公司,德国);核酸电泳仪(Bio-Rad 公司,美国);自动凝胶成像仪(Bio-Rad 公司,美国);干式恒温器(杭州奥盛仪器有限公司);高速离心机(Thermo 公司,美国);Nanodrop2000 微量核酸蛋白分析仪(Thermo公司,美国);高压蒸汽灭菌锅MLS-3780(Sanyo公司,日本);DNA Maker(Takara 公司,日本);植物DNA 提取试剂盒(天根生化科技有限公司,中国);PrimeSTAR®HS(Premix)(Takara 公司,日本);DNA 凝胶回收试剂盒(Axygen 公司,美国);引物由杭州有康生物科技有限公司合成。
2 方法
2.1 基因组DNA 提取
选取药用石斛新鲜组织(鲜茎或鲜叶),用75%乙醇溶液擦拭,待其表面干燥后称取0.1 g 组织样本,用液氮研磨至粉末。按植物基因组DNA 提取试剂盒说明书操作步骤进行基因组总DNA 提取。利用Nanodrop 超微量分光光度计测定基因组总DNA 浓度和纯度测定,并通过1%的凝胶电泳检测DNA 的完整性,合格DNA 样品置于−20 ℃冰箱保存备用。
2.2 PCR 扩增及测序
采用通用引物 ITS-5F/ITS-4R ( 5’-GGAAGTAAAAGTCGTAACAAGGPCR-3’/5’-TCCTCCGCTTATTGATATG-3’)和ITS2F/ITS2R(5’-CGTAACAAGGTTTCCGTAGGTGAAC-3’/5’-TTATTGATATGCTTAAACTCAGCGGG-3’)分别扩增ITS 和ITS2 序列。PCR 扩增体系为50 μL:2×Premix PrimeSTAR HS 25 μL,DNA 模板2 μL,正反向引物(10 μmol/L)各1 μL,ddH2O 21 μL。PCR 反应条件为:94 ℃预变性5 min;94 ℃变性50 s,55 ℃退火30 s,72 ℃延伸90 s,35 个循环;72 ℃终延伸10 min。PCR 扩增产物经1%琼脂糖凝胶电泳检测合格后,送北京擎科生物科技有限公司进行双向测序。
2.3 数据处理与分析
测序结果经Chromas 软件评估序列峰图质量,除去低质量的序列;利用Bioedit 7.0 软件进行正向序列拼接[21],将所测序列在NCBI 中进行Blast 相似性比对,验证所获序列的准确性。从GenBank 数据库中下载与本研究扩增区段一致的药用石斛ITS 和ITS2序列,通过比对BOLD 数据库对序列准确性进行进一步验证。综合本研究所得和公共下载序列数据,使用MEGA X 软件进行多序列比对,去除两端冗余序列[22]。分析处理后序列的核苷酸组成、变异位点等,基于Kimura-2-parameter(K2P)模型计算种间和种内遗传距离。以石仙桃为外群,使用1 000 次重复的置信度以邻接法(neighbor joining tree,NJ)构建系统发育树。通过在线网站( http://its2.bioapps.biozentrum.uniwuerzburg.de/)预测ITS2 的二级结构。
物种鉴别效率=可鉴别的物种数/研究物种的总数
3 结果与分析
3.1 PCR 扩增、测序及序列分析
以各样本的基因组总DNA 为模板,利用ITS和ITS2 通用引物进行PCR 扩增,凝胶电泳检测结果显示,序列扩增效率达100%(图1)。PCR 扩增产物经纯化和测序后,共获得82 条ITS 序列和102条ITS2 序列。NCBI 在线Blast 比对结果表明所获序列均准确可靠。从GenBank 上获得41 种药用石斛(包括本研究采集种类)ITS 和ITS2 序列分别为351 和308 条。

图1 药用石斛ITS (A) 和ITS2 (B) 序列扩增产物琼脂糖凝胶电泳示意图Fig.1 Agarose gel electrophoresis of ITS (A) and ITS2 (B) sequence amplification products from medicinal Dendrobium species
本研究PCR 所获ITS 序列及GenBank 下载序列共433 条,经MEGA X 软件比对后,修剪成长度为612 bp 的共有片段进行后续分析。结果显示所有位点中保守位点189 个、可变位点407 个、简约信息位点374 个、单一多态位点共有33 个。在碱基组成上,A、T、G、C 的平均含量分别为23.2%、23.7%、28.9%、24.2%。A+T 总含量46.9%,C+G 总含量为53.1%。ITS2 序列共410 条,经序列对比并去除两端冗余序列后长度为256 bp,其中保守位点59个、可变位点194 个、简约信息位点190 个、单一多态位点共有4 个,分别占序列长度的23.0%、75.8%、74.2%和1.60%。在碱基组成上,A 占20.4%,T 占27.7%、G 占29.9%、C 占22.0%。A+T 总含量48.1%,C+G 总含量为51.9 %。
3.2 遗传距离分析
基于ITS 序列的药用石斛遗传距离分析结果表明,少花石斛的种内遗传距离最大(0.019 5),鼓槌石斛、霍山石斛、玫瑰石斛等9 种药用石斛的种内遗传距离均为 0,种内平均遗传距离为0.001 7。种间遗传距离在0~0.140 7,种间平均遗传距离为0.072 6,其中最小种间遗传距离存在于广东石斛和霍山石斛之间,而勐海石斛和肿节石斛之间的遗传距离最大。基于ITS2 序列的药用石斛种内遗传距离在0~0.012 4,种内平均遗传距离为0.001 0。鼓槌石斛、流苏石斛、金钗石斛等26 种药用石斛种内遗传距离均为0,最大种内遗传距离处于滇桂石斛种内。种间遗传距离大小范围为0~0.199 7,种间平均遗传距离为0.097 0,其中最小种间遗传距离存在于黄石斛铁皮石斛之间、广东石斛和霍山石斛之间、勐海石斛和藏南石斛之间,而藏南石斛和玫瑰石斛之间的遗传距离最大(表2)。

表2 基于ITS 和ITS2 序列的药用石斛种内和种间K2P 遗传距离分析Table 2 Intra- and inter-specific K2P genetic distances of medicinal Dendrobium based on ITS and ITS2
尽管基于ITS和ITS2序列的药用石斛种间平均遗传距离均远远大于种内平均遗传距离(分别为30.3 和97.0 倍),但种内遗传距离和种间遗传距离在分布上未出现条形码间隙(barcoding gap)。基于ITS 序列的种内遗传距离集中于0~0.01 区域,种间遗传距离集中分布于0.04~0.09,两者在0~0.02区域存在少许重叠(图2-A)。基于ITS2 序列的种内遗传距离和种间遗传距离之间分别集中0~0.02和0.06~0.12 区域,但在0~0.02 区域存在部分重叠(图2-B)。以某一物种最小种间遗传距离超过最大种内遗传距离为标准评估条形码间隙时,ITS序列分析显示可在30 种药用石斛种类中鉴定到条形码间隙,但金钗石斛、铁皮石斛、滇桂石斛、黄石斛、勐海石斛、霍山石斛、广东石斛、重唇石斛、曲茎石斛、细茎石和梳唇石斛11 种药用石斛的最大种内遗传距离超过最小种间遗传距离(图2-C);基于ITS2 序列的遗传距离比较分析结果类似,除ITS 序列分析中的30 种药用石斛外,勐海石斛ITS2 的种内和种间遗传距离之间亦存在条形码间隙(图2-D)。上述结果表明,ITS 和ITS2 作为DNA 条形码可分别有效区分待测的30和31 种药用石斛。
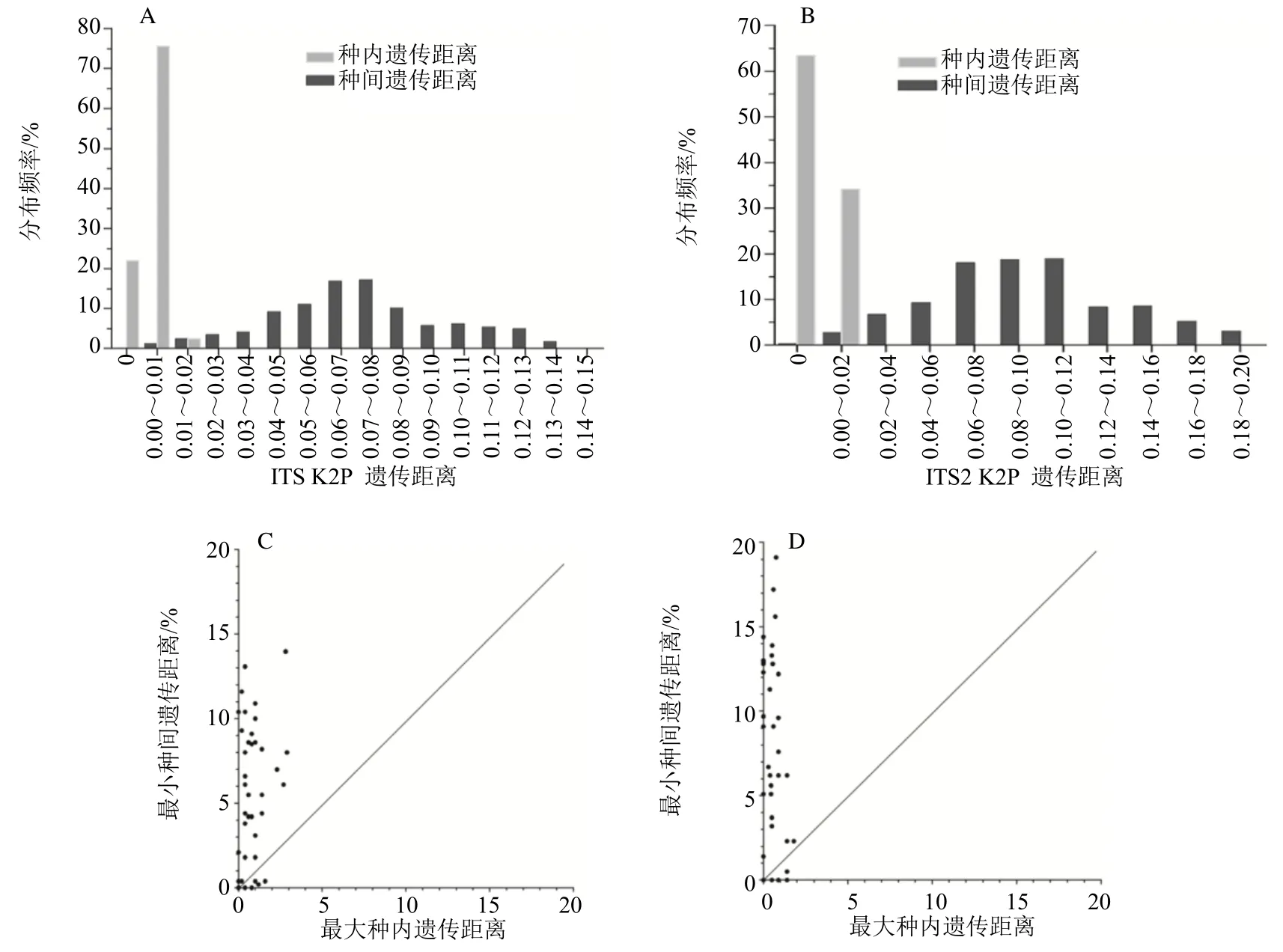
图2 药用石斛ITS 和ITS2 序列的种内和种间K2P 遗传距离分析Fig.2 Intra- and inter-specific K2P genetic distances analysis of medicinal Dendrobium based on ITS and ITS2 sequences
3.3 聚类分析
以石仙桃为外群,分别基于41 种药用石斛植物的ITS 和ITS2 序列,利用邻接法构建NJ 系统发育树(图3、4)。结果显示,基于ITS 序列的NJ 树中,除金钗石斛和重唇石斛,霍山石斛和广东石斛,曲茎石斛、铁皮石斛、滇桂石斛和黄石斛,勐海石斛、细茎石斛和梳唇石斛4 组11 种药用石斛外,其余30 种不同药用石斛可各自单独聚集于同一单系分支内,表明以ITS 序列作为DNA 条形码可有效区分本研究中73.2%的药用石斛种类。由图4 可知,ITS2 序列鉴定效率为75.6%,除与ITS 序列可有效鉴定的30 种药用石斛外,还可将勐海石斛有效区分。可见,基于遗传距离和聚类分析的物种鉴定效率一致。

图3 基于41 种药用石斛ITS 序列构建的邻接树Fig.3 Neighbor-joining (NJ) tree of 41 medicinal Dendrobium species based on ITS sequences
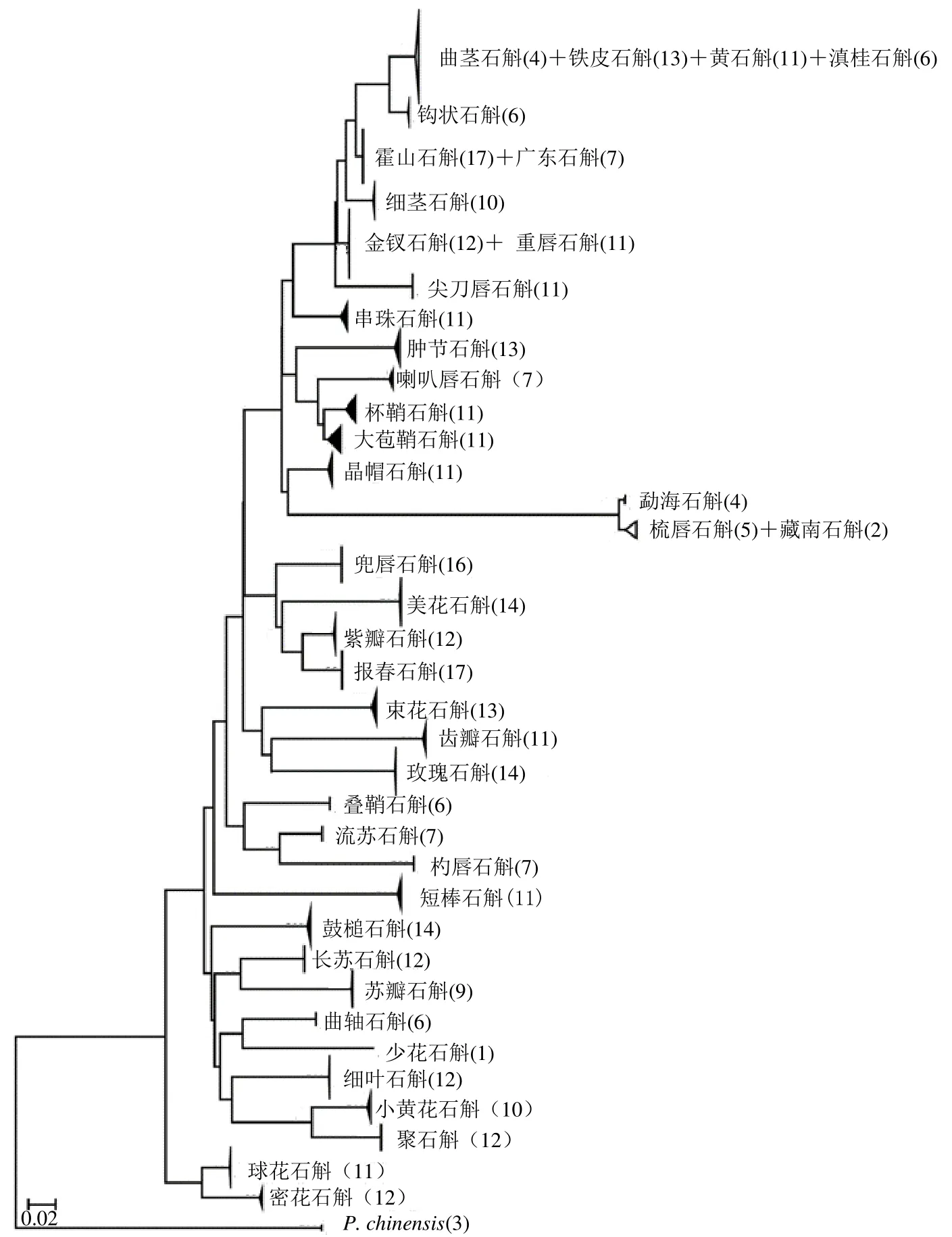
图4 基于41 种药用石斛ITS2 序列构建的邻接树Fig.4 Neighbor-joining (NJ) tree of 41 medicinal Dendrobium species based on ITS2 sequences
3.4 ITS2 二级结构分析
针对ITS2 序列聚类分析中未能有效区分的10 种药用石斛,预测其ITS2 序列的二级结构。由图5 可知,10 种药用石斛ITS2 序列均具有“一环四臂”的典型二级结构,但螺旋臂的结构、长短和复杂程度在部分石斛间存在明显不同。如金钗石斛和重唇石斛在NJ 树中聚为一支,但两者在ITS2 二级结构上具有明显差异,金钗石斛ITS2二级结构的Ⅲ臂上的茎环数目显著多于重唇石斛,而重唇石斛近环端处具有颈环;在NJ 树中聚为一支的细茎石斛和梳唇石斛在ITS2 二级结构的“分子形态”上同样存在明显差异;滇桂石斛与曲茎石斛、铁皮石斛和黄石斛相比,其I 臂Ⅲ臂上茎环数目明显不同。可见,通过ITS2 序列的二级结构比较分析,可进一步将金钗石斛、重唇石斛、滇桂石斛、细茎石斛和梳唇石斛5 种药用石斛区分开来。因此,联合系统发育树与ITS2 序列二级结构分析,ITS2 可有效鉴别36 种药用石斛种类(NJ 树分析31 种;二级结构分析5 种),物种鉴别效率达到87.8%。
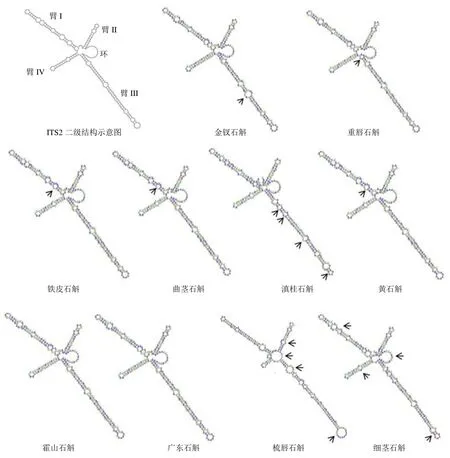
图5 10 种药用石斛的ITS2 序列二级结构Fig.5 Secondary structures of ITS2 sequences of 10 medicinal Dendrobium species
4 讨论
快速准确的种类鉴别对于保障药用石斛种质资源和药用安全至关重要。然而,药用石斛种类众多,许多种类形态特征相似,尤其是一些种类仅在花型结构上存在细微区别,即使是专业的分类学家也很难在较短时间内对其进行准确的鉴别。运用分子生物学技术可以在保证鉴别结果准确性的基础上显著提高鉴定工作效率,其中DNA 条形码技术具有简单、快速、通用性广和稳定性高等优点,已广泛应用于药用植物的基原鉴别过程中[23-25]。
本研究评估了核基因ITS 和ITS2 作为DNA 条形码在我国41 种药用石斛种类鉴别中的适用性。基于K2P 遗传距离分析显示,基于ITS 和ITS2 序列分析的药用石斛平均种间遗传距离分别为0.072 6 和0.097 0,平均种内遗传距离分别为0.002 4 和0.001 0。能否作为物种鉴别的有效DNA 条形码,取决于物种种间遗传距离和种内遗传距离之间的差异,但其差异程度还有待商榷[26]。Herbert 等[27]认为物种的种间平均遗传距离大于种内平均遗传距离10 倍以上,且遗传距离分布上存在“barcode gap”时,候选基因片段可以作为该研究类群的DNA 条形码,而Meier 等[28]则建议物种最小种间遗传距离大于最大种内遗传距离时即可有效区分物种。本研究中,基于ITS 和ITS2 序列分析的41 种药用石斛的平均种间遗传距离分别是平均种内遗传距离的30.3 和97.0 倍。然而,ITS 和ITS2 序列种内最大遗传距离与种间遗传最小距离均存在少许重叠,不存在显著的“barcode gap”。上述结果说明单一的ITS 和ITS2序列不能完全有效区分本研究待测的所有药用石斛物种,该结果亦与目前诸多石斛属植物DNA 条形码研究结论一致[19-20,29]。
构建系统发育树是评估DNA 条形码物种鉴别效率的一种直观的方法,同一物种聚类于同一分支表明该物种可被有效区分。以石仙桃为外群,基于本研究41 种药用石斛ITS 和ITS2 序列构建NJ 树。结果表明,基于遗传距离和聚类分析的物种鉴定效率完全一致,ITS 和ITS2 可分别有效区分待测的30和31 种药用石斛,鉴别效率分别为73.2%和75.6%。中国植物DNA 条形码研究组研究提出将ITS/ITS2序列作为种子植物的核心DNA条形码[30],Chen等[31]则建议将ITS2 序列作为药用植物鉴定的通用DNA条形码。本研究中,ITS2 序列的物种鉴别效率稍优于ITS 序列的物种分辨能力,该结果进一步证实了ITS2 作为药用植物DNA 条形码的优先性。此外,有研究表明,ITS2 序列二级结构在药用植物鉴定中具有着重要辅助作用,可提供物种分类水平上更多的信息,从而提高系统发育树重建的稳定性[32]。刘红梅等[34]通过对14 种石斛属植物的ITS2 二级结构的比较分析,发现喉红石斛与黑毛组石斛亲缘关系最近,认为其应归属于黑毛组石斛[33]。ITS2 二级结构通常具有“一环四臂”的保守结构,但其中心环大小以及四臂的长度、角度和茎环数目在不同物种间存在一定差异。本研究结果表明,NJ 树分析法无法区分的金钗石斛、重唇石斛、滇桂石斛、细茎石斛和梳唇石斛可通过ITS2 序列二级结构差异进行有效鉴别。因此,系统发育树结合ITS2 序列二级结构分析,可有效提升药用石斛种类的鉴定效率。
研究表明,物种取样数量可显著影响DNA 条形码的物种鉴定效率[17]。Nguyen 等[20]研究显示ITS和ITS2 作为DNA 条形码在24 种石斛属植物种类鉴定中成功率接近80%,但在Xu 等[35]的研究中,随着石斛种类取样数量的扩大,发现ITS 和ITS2的鉴定效率均低于35%。Singh 等[17]研究发现当石斛属植物物种数量为36 种时,DNA 条形码matK可有效区分80.56%的待测种类,但当取样物种数量扩大到52 种时,其物种鉴别效率下降到76.92%。最近,徐素素等[19]研究表明ITS2 对我国12 种药用石斛的鉴别效率可达100%,而基于相同分析方法,在本研究41 种药用石斛中ITS2 的物种鉴定效率仅为75.6%。可见,本研究结果与上述研究结论相符,即随着物种取样数量的增加,DNA 条形码的物种鉴别效率呈现下降趋势。
目前,关于DNA 条形码研究中待测物种集的物种数量要求还没有相关标准。除物种取样数量外,样本取样范围,取样个体数、候选条形码在待研究类群中的进化速度、干扰基因(假基因和内生菌)等也是DNA 条形码物种鉴定效率的重要影响因子[36-38]。鉴于不同候选条形码在待研究类群中的进化速度不同,诸多研究者提出使用不同DNA条形码片段的组合方案,如生命条形码联盟植物工作组[39]推荐使用rbcL+matK 组合作为陆生植物种类鉴定的DNA 条形码。Xu 等[35]通过比较不同组合片段对亚洲大陆石斛属植物的鉴定效率,提出ITS+matK 为最优DNA 条形码组合。近年来,叶绿体全基因组因含有更丰富的变异位点和遗传信息,已被证实比单个和组合DNA 条形码片段具有更高的物种分辨率,可作为植物种类鉴定的超级条形码[40]。我国石斛种类繁多,除药用石斛外,还有诸多观赏性石斛种类,后续研究有必要进一步扩大取样数量、取样范围和取样个体数,并评估组合条形码和超级条形码的物种鉴定能力,以期获得可有效区分我国所有石斛属植物的理想DNA 条形码。
利益冲突所有作者均声明不存在利益冲突