肿瘤相关糖类抗原Tn在子宫内膜癌中异常表达及其生物学意义
茹晓莉,曹广明,刘崇东
(首都医科大学附属北京朝阳医院 妇产科,北京100020)
子宫内膜癌是常见的女性生殖系统恶性肿瘤,其发病率逐年增高并有年轻化趋势,临床治愈率低[1-3]。目前对子宫内膜癌的发生和转移机制尚未阐明;实现早期诊断和有效预防子宫内膜癌复发、转移是提高其预后的关键环节,这要求我们必须从更深层面研究子宫内膜癌发生、发展和转移的分子机制。
黏蛋白型O-聚糖(Mucin-type O-glycans)是指由多肽:N-乙酰氨基半乳糖转移酶(ppGalNAc-Ts)催化合成的一类糖复合物,也是正常子宫内膜表面覆盖的黏液层的主要成分,其功能主要是修饰糖蛋白发挥重要的生理性保护作用[4-5]。在肿瘤中常伴随黏蛋白型O-聚糖结构及数量发生异常改变,形成不成熟、截短的O-聚糖结构,其中最重要的就是肿瘤相关糖类抗原-Tn的表达。研究发现,子宫内膜癌病人中常检测到Tn抗原,表明存在异常O-型糖基化,但目前尚不清楚Tn抗原介导的异常O-型糖基化在子宫内膜癌发生和转移中的具体生物学作用。本研究首先采用免疫组化技术检测Tn抗原在子宫内膜癌病人组织、子宫内膜非典型增生组织和正常人子宫内膜组织的表达状况;然后采用CRISPR/Cas9技术特异性敲除两株人子宫内膜癌细胞系Ishikawa和HEC-1B的Cosmc基因,以诱导Tn抗原表达,进而探讨Tn抗原对子宫内膜癌侵袭和转移的影响作用及其分子机制。
1 材料与方法
1.1 临床病理标本
收集2015年5月至2022年9月首都医科大学附属北京朝阳医院妇产科就诊而诊断为子宫内膜癌的患者手术后石蜡组织,一共168例;所有患者术前未接受过放疗或化疗;所有肿瘤标本均经病理鉴定证实。另外收集正常子宫内膜组织标本12例,非典型增生子宫内膜组织25例。
1.2 细胞系及试剂
人子宫内膜癌细胞系(Ishikawa和HEC-1B)购自美国ATCC;人胚胎肾HEK293T细胞由中国医学科学院肿瘤医院惠赠;DMEM高糖培养基、胎牛血清、青-链霉素混合液、嘌呤霉素等购自美国Gibco公司;Lipofectamine 3000购自美国Invitrogen公司;LentiCRISPv2、psPAX2和pMD2G质粒购自美国Addgene公司;Transwell小室购自美国Corning公司;小鼠抗Tn IgM单克隆抗体购自美国GeneTex公司,小鼠IgM Isotype抗体购自美国Santa Cruz公司;鼠抗人Cosmc、鼠抗人E-cadherin、兔抗人N-cadherin、Vimentin、GAPDH等抗体均购自美国CST公司;超敏ECL检测试剂盒购自南京凯基生物有限公司。
1.3 研究方法
1.3.1免疫组化染色 将石蜡切片常规脱蜡、水化、冲洗,进行抗原修复和阻断内源性过氧化物酶后,分别加入小鼠抗人Tn IgM一抗(20 μg/mL)和羊抗小鼠IgM二抗(5 μg/mL)进行免疫组化反应,最后PBS清洗,DAB 显色,苏木素复染,中性树胶封片。最后在光镜下观察并进行图像采集和结果判读。
1.3.2细胞培养、转染 使用含有10%胎牛血清、100 μg/mL链霉素和100 U/mL青霉素的DMEM培养基培养细胞,在37℃、含5% CO2的培养箱中培养。待细胞长至75%以上进行传代处理。与此同时,我们使用CRISPR/Cas9-sgRNA设计工具,设计一对靶向Cosmc基因的sgRNA(single guide RNA),由上海生工生物工程有限公司合成,其序列如下:F:5′-CACCGTGTGCTTTGATCACTATGCT3′;R:5′AAACAGCATAGTGATCAAACACAC-3′。将退火后形成的双链sgRNA产物和经酶切过的LentiCRISPRv2质粒连接,并利用Lipofectamine 3000将含有Cosmc sgRNA的重组质粒或对照质粒分别与慢病毒包装质粒psPAX2和pMD2.G共转染入HEK293T细胞,制备慢病毒溶液;然后以慢病毒溶液加入预先培养的细胞中,经嘌呤霉素筛选至少一周,最后得到Cosmc敲除细胞。
1.3.3流式细胞技术检测肿瘤细胞的Tn抗原表达 取对数生长期的Cosmc敲除组和对照组细胞消化并制成单细胞悬液,用预冷的PBS清洗细胞,然后加入小鼠抗Tn IgM单克隆抗体(10 μg /mL)、同时设置空白对照组和同型对照组(10 μg /mL小鼠IgM Isotype抗体),将抗体与细胞悬液轻柔混匀,在4℃孵育2 h;然后用PBS清洗细胞3次,加入PE标记的羊抗小鼠IgM二抗,在避光条件下置于4℃孵育1 h。最后以PBS清洗细胞后使用流式细胞仪(Canto Ⅱ,BD Bioscience)检测Cosmc敲除组和对照组细胞的Tn抗原表达情况,分别标记为Tn+、Tn-细胞。
1.3.4Transwell小室法检测细胞迁移和侵袭 迁移实验:取对数生长期的Tn+、Tn-细胞,经胰酶消化、中和、离心去除培养基后,再用无血清DMEM培养基制成单细胞悬液,然后将200 μL细胞分别接种在Transwell上室(1×106个/室),下室加入500 μL含10%胎牛血清的完全培养基,置于37℃含5% CO2的细胞培养箱中培养48 h;取出小室,去除培养基,用PBS清洗小室2~3次,然后用无水乙醇固定30 min,PBS清洗之后再用0.1%结晶紫染色30 min,用棉签轻轻擦去小室内侧的细胞,PBS清洗残余细胞后置于显微镜下观察。侵袭实验是在迁移实验的基础上,向小室内预铺一层按1∶8比例稀释的Matrigel胶,置于37℃孵箱内凝固至少6 h,然后以相同的细胞数量和操作方式检测细胞侵袭能力。
1.3.5Western blot法检测Tn抗原对肿瘤细胞EMT信号通路的影响
分别收集对数生长期的Tn+、Tn-细胞,加入含有1 mM蛋白酶抑制剂和1 mM PMSF的RIPA裂解液于冰上裂解,在4℃高速离心后分离上清液并采用BCA试剂盒进行蛋白定量;取40 μg/孔蛋白经10% SDS-PAGE电泳、转膜、封闭,然后分别加入下列抗体:E-cadherin、N-cadherin、Vimentin和GAPDH,在4℃孵育过夜(抗体稀释比例为1∶1000)。将膜以TBST漂洗3次后与辣根过氧化物酶(HRP)标记的山羊抗兔或山羊抗鼠IgG二抗在室温下孵育1 h(二抗稀释比例为1∶8000);再次用TBST漂洗后,使用ECL发光液进行显色,凝胶成像分析系统扫描图像,分析蛋白条带灰度值,以GADPH作为内参。
1.4 统计学分析
所有数据采用GraphPad Prism 6软件进行分析,P<0.05表示差异有统计学意义。
2 结果
2.1 Tn抗原在子宫内膜癌病人中高表达
免疫组化染色结果显示,在正常人子宫内膜组织中未检测到Tn抗原(0/12),在不典型增生子宫内膜组织中检测到Tn抗原呈低表达,阳性率为20%(5/25);而在子宫内膜癌病人组织中Tn抗原呈高表达,阳性率为73%(123/168),明显高于正常子宫内膜组织及非典型增生子宫内膜组织;Tn抗原阳性染色主要定位于细胞膜及细胞浆中,并有向管腔弥散表达的现象。
2.2 靶向敲除肿瘤细胞Cosmc可诱导Tn抗原异常表达
本研究中我们采用CRISPR/Cas9技术靶向敲除两株人子宫内膜癌细胞系的Cosmc基因以诱导Tn抗原表达;我们首先利用Western blot法检测Cosmc的表达水平,如图2A显示:与对照组相比,敲除组细胞的Cosmc表达水平明显下降,证实Cosmc被有效敲除。随后流式细胞技术检测显示,对照组细胞未检测到Tn抗原表达,而Cosmc敲除组细胞大量表达Tn抗原;这个结果证实了Cosmc敲除能直接诱导Tn抗原的异常表达(图2B)。

图2 Western blot法和流式细胞技术检测经CRISPR/Cas9技术敲除Cosmc的肿瘤细胞的Cosmc和Tn抗原表达
2.3 Tn抗原异常表达增强肿瘤细胞的侵袭和转移能力
我们利用Transwell实验检测了Tn抗原表达对子宫内膜癌细胞迁移和侵袭能力的影响,实验结果显示,在Ishikawa和HEC-1B细胞中,Tn抗原阳性表达均能显著增强细胞的迁移和侵袭能力,这个结果说明Tn抗原介导的异常O-型糖基化能够促进子宫内膜癌细胞的恶性生物学行为(图3)。
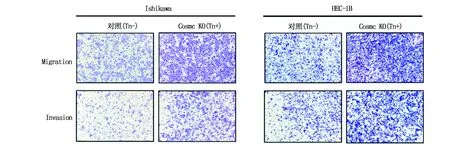
图3 Transwell法检测Tn抗原对细胞迁移和侵袭能力的影响
2.4 Tn抗原显著激活了EMT信号通路
我们进一步检测Tn+和Tn-细胞的EMT信号通路相关分子以探讨Tn抗原生物学作用的分子机制。Western blot结果显示:在Ishikawa和HEC-1B细胞中,与Tn-细胞相比,Tn+细胞的上皮相关蛋白E-cadherin表达水平明显下调,而间质相关蛋白N-cadherin、Vimentin的表达水平则明显升高(图4)。以上实验结果表明,Tn抗原异常表达能激活EMT信号通路,这可能是Tn抗原介导的异常O-型糖基化促癌作用的分子机制。

图4 Western blot法检测Tn抗原对肿瘤细胞EMT信号通路的影响作用
3 讨论
糖基化反应是一种常见的蛋白质翻译后修饰方式,不仅增加了蛋白质结构的多样性,而且对蛋白质的生物、物理及功能特性均具有重要调控作用。O-聚糖(O-glycans)介导的糖基化反应是蛋白质糖基化修饰的主要形式,对体内多数蛋白质特别是跨膜蛋白和分泌型蛋白的结构和功能都有重要影响,参与和调控许多生理病理过程[4-5]。近年来研究发现,在细胞癌变过程中常伴有O-型糖基化异常反应,表现为O-聚糖结构或数量发生异常,导致肿瘤相关糖类抗原-Tn呈现阳性表达。Tn抗原是指N-乙酰半乳糖胺(GalNAc)与肽链上的丝氨酸和苏氨酸残基以O-连接的方式共价连接形成的糖基结构,是一种残缺的O-聚糖结构,也是O-型糖基化异常反应的标志物[6-7]。生理状态下Tn抗原在相应的糖基转移酶的作用下被催化合成复杂完整的O-聚糖,因此在正常细胞/组织中不表达;而Tn抗原一旦表达阳性,则表明O-聚糖链合成障碍,糖基化修饰反应异常。大量研究显示,在结肠癌、胰腺癌、乳腺癌、肺癌、卵巢癌等上皮来源性肿瘤中能检测到高表达的Tn抗原,并且与肿瘤的远处转移和不良预后有相关性,因此Tn抗原常作为肿瘤相关糖类抗原(Tumor Associated Carbohydrate Antigen,TACA)用于此类肿瘤的检测[8-10]。但Tn抗原在子宫内膜癌中的表达情况及其生物学作用目前尚不清楚。
本实验中,我们首先采用免疫组化染色技术检测了Tn抗原在正常子宫内膜组织、非典型增生子宫内膜组织和子宫内膜癌组织中的表达情况,结果显示:Tn抗原在子宫内膜癌组织中的阳性表达率明显高于正常子宫内膜组织及非典型增生子宫内膜组织;Tn抗原在非典型增生子宫内膜组织中有一定阳性率(20%),但Tn抗原在正常子宫内膜组织中未见表达。Tn抗原阳性表明在细胞癌变中存在异常O-型糖基化反应,但其是否存在直接的促癌效应尚需深入探讨。
Cosmc是T合酶的分子伴侣,在O-型糖基化反应中起着不可或缺的重要作用。研究发现,Cosmc功能异常如基因突变、缺失和高甲基化等,都可以导致T合酶功能失活,致使糖基化修饰过程发生障碍,最后诱导Tn抗原异常表达[10-11]。因此,Cosmc分子功能异常是Tn抗原表达的重要机制。基于此,本研究应用基因编辑技术特异性敲除Cosmc基因以制备Tn抗原阳性的子宫内膜癌细胞系,然后探讨Tn抗原对肿瘤细胞生物学行为的影响作用。由于人子宫内膜癌细胞系(Ishikawa、HEC-1B)并不表达Tn抗原,我们采用CRISPR/Cas9技术成功敲除这两株细胞的Cosmc,发现确实能诱导细胞表达大量Tn抗原;然后通过Transwell实验检测细胞迁移和侵袭能力,发现Tn抗原阳性表达的两株细胞均显著促进了迁移和侵袭等恶性表型,这一结果证实Tn抗原介导的异常O-型糖基化能增强子宫内膜癌的恶性程度。
研究表明,EMT(Epithelial to Mesenchymal Transition)是上皮来源性肿瘤获得侵袭和远处转移能力的重要生物学过程,在肿瘤恶性进展中发挥着重要作用[12]。鉴于我们观察到Tn抗原明显促进子宫内膜癌的迁移和侵袭,我们拟探索Tn抗原是否通过EMT进行分子层面的调控。研究结果显示,与对照组Tn-细胞相比,Tn+细胞的上皮类分子标志物E-cadherin的表达水平明显下调,而间质类分子标志物(Vimentin和N-cadherin)的表达水平则显著升高,表明Tn抗原可激活EMT信号通路,这可能是其调控子宫内膜癌细胞恶性表型的分子机制。
综上所述,Tn抗原在子宫内膜癌病人中异常高表达,可能参与肿瘤的发生和转移。体外实验证实,Tn抗原通过激活EMT相关信号通路促进子宫内膜癌细胞的侵袭转移能力。本研究为深入探讨子宫内膜癌的发生机制和干预靶点等开辟了新的视角。

