银杏内酯K调节AMPK/mTOR/ULK1信号通路对乳腺癌细胞自噬和凋亡的影响*
时延龙 周鹏 王雪凯 郭煜
(1.解放军第960医院肿瘤科,山东 济南 250031;2.解放军第960医院甲状腺乳腺外科,山东 济南 250031;3.中国海洋大学医药学院,山东 青岛 266000)
乳腺癌是女性最常见的恶性肿瘤,发病率居于女性癌症之首,其治疗方式包括内分泌、手术、放化疗以及靶向治疗[1-3]。其中化疗是最重要的治疗策略之一,虽然效果显著,但会对患者造成损伤,影响预后[4],因此寻找预防或治疗乳腺癌的药物至关重要。银杏内酯 K(ginkgolide K,GK)常作为治疗人类心血管疾病的天然药物但其在治疗癌症中鲜有报道[5-6]。AMPK是调节细胞能量和代谢的关键因子,通过调节多种下游信号分子诱导自噬,参与肿瘤细胞的进展[7-8]。因此本研究旨在探讨GK通过AMPK/mTOR/ULK1信号通路对乳腺癌细胞自噬和凋亡的影响。现报告如下。
1 材料与方法
1.1 细胞来源 ATCC提供MCF-7细胞。将细胞置于10% FBS和1%青霉素-链霉素的DMEM中,并培养于温度为37 ℃,湿度为5% CO2培养箱中。
1.2 主要材料 GK购自上海研生实业有限公司;逆转录试剂盒购自天根生化科技有限公司;MCE公司提供AMPK抑制剂-Compound C;Sigma提供吖啶橙(AO)染色液;Annexin V-FITC/PI细胞凋亡检测试剂盒购自锐赛生物有限公司;CCK-8试剂盒购自智杰方远科技有限公司;ECL发光检测试剂盒购自翌圣生物科技有限公司;Abcam公司提供AMPK、p-mTOR、mTOR、p-ULK1、ULK1一抗。
1.3 细胞分组及处理 取对数生长期的MCF-7细胞,依据前期预实验结果分组为对照组、GK低浓度(GK-L)组、GK中浓度(GK-M)组、GK高浓度(GK-H)组、GK-H+Compound C组,其中GK-L、GK-M、GK-H组分别以12.5、25、50 μg/mL GK处理细胞[9];GK-H+Compound C组分别以50 μg/mL GK、50 μmol/L Compound C同时处理细胞[10];对照组不作任何处理。
1.4 观察各组细胞形态 将MCF-7细胞(1×105个细胞/mL)接种到12孔板中,按照上述分组,并继续培养48h后拍摄图像,在×200倍的光学显微镜下观察形态变化。
1.5 检测细胞增殖 将MCF-7细胞以5×104个/mL密度接种到96孔板中。细胞附着后,将上述各组细胞分别培养0、24、48 h时,加入CCK-8(10 μL,5 mg/mL),孵育2.5 h。用酶标仪测量450 nm处的吸光度(OD)值。
1.6 检测细胞凋亡 收获MCF-7细胞并用PBS洗涤两次,重新悬浮细胞,加入5 μL Annexin V-FITC、10 μL PI染色液,避光孵育。用流式细胞仪分析细胞凋亡。
1.7 LC3、P62、Beclin1 mRNA表达水平 TRIzol试剂提取细胞中的总RNA并进行逆转录以获取cDNA,使用荧光定量试剂盒对LC3、P62、Beclin1进行实时PCR。以GAPDH为内参,通过2-ΔΔCT方法计算LC3、P62、Beclin1 mRNA的相对表达量。引物序列见表1。

表1 qRT-PCR引物序列
1.8 AO染色检测细胞自噬 将MCF-7细胞以5×104个/mL密度接种到24孔板中,每孔加入100 μL AO染色液,避光染色1 min。经PBS洗涤后,拍照观察细胞自噬。
1.9 Western blot检测AMPK/mTOR/ULK1通路相关蛋白表达水平 收集细胞,用冷PBS冲洗两次,并用RIPA缓冲液在冰上裂解30 min,SDS-PAGE分离等量蛋白质,转移PVDF膜上,牛奶封闭3 h,将膜与AMPK、p-mTOR、mTOR、p-ULK1、ULK1、LC3、P62、Beclin1一抗4 ℃下孵育过夜,室温下与二抗孵育1 h,Image软件分析目标蛋白表达水平。
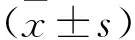
2 结果
2.1 细胞形态比较 GK-L组、GK-M组、GK-H组较对照组MCF-7细胞逐渐出现皱缩,数量减少,以GK-H组变化较为明显;GK-H+Compound C组较GK-H组细胞贴壁性增强,数量增多。见图1。
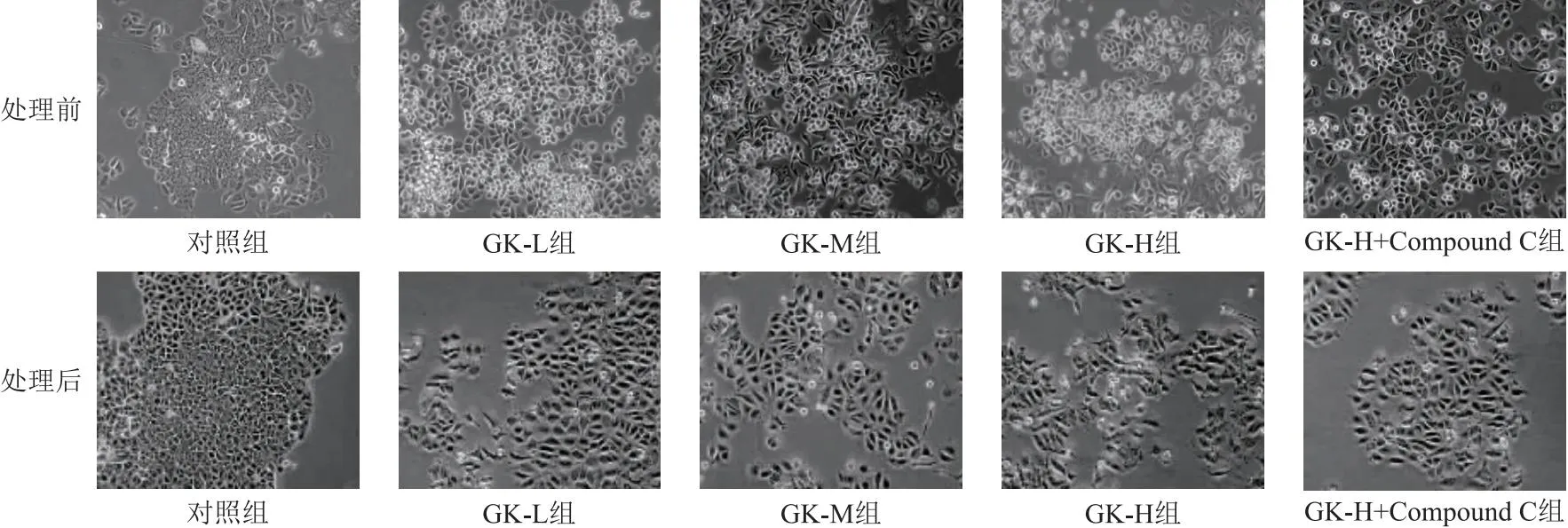
图1 光学显微镜观察各组细胞形态(200×)
2.2 细胞增殖率、凋亡率比较 GK-L组、GK-M组、GK-H组增殖率较对照组降低,但凋亡率增加(P<0.05);GK-H+Compound C组增殖率较GK-H组升高,但凋亡率降低(P<0.05),见图2、表2。

图2 观察各组细胞凋亡变化
表2 细胞增殖率、凋亡率的影响
2.3 细胞自噬状况 对照组未见自噬泡产生;GK-L组、GK-M组、GK-H组自噬泡数量较对照组逐渐增多;但GK-H+Compound C组较GK-H组自噬泡数量减少。见图3。
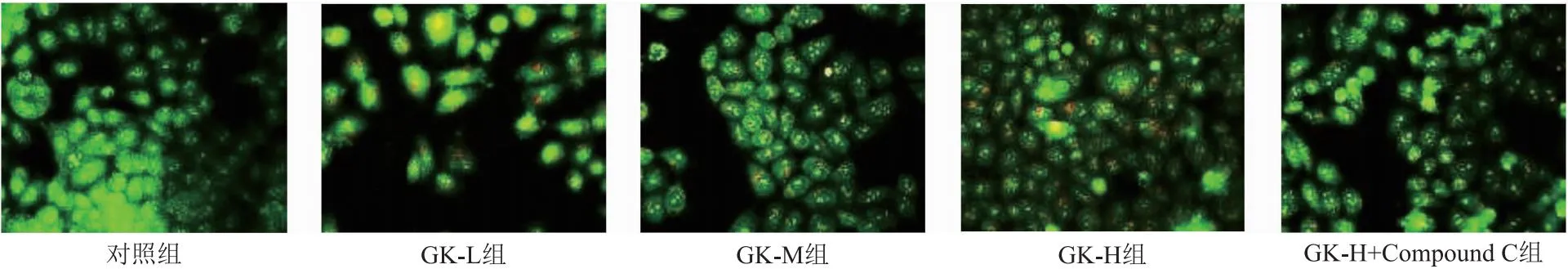
图3 观察各组细胞自噬情况(200×)
2.4 细胞LC3、P62、Beclin1 mRNA表达水平比较 GK-L组、GK-M组、GK-H组LC3、Beclin1 mRNA较对照组增加,但P62 mRNA降低(P<0.05);GK-H+Compound C组LC3 Beclin1较GK-H组降低,但P62 mRNA升高(P<0.05)。见表3。
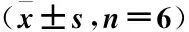
表3 LC3、P62、Beclin1 mRNA表达水平比较
2.5 AMPK/mTOR/ULK1通路蛋白表达比较 GK-L组、GK-M组、GK-H组AMPK、LC3、Beclin1表达较对照组增加,但P62、p-mTOR/mTOR、p-ULK1/ULK1降低(P<0.05);GK-H+Compound C组AMPK、LC3、Beclin1表达较GK-H组降低,而P62、p-mTOR/mTOR、p-ULK1/ULK1升高(P<0.05),见表4、图4。
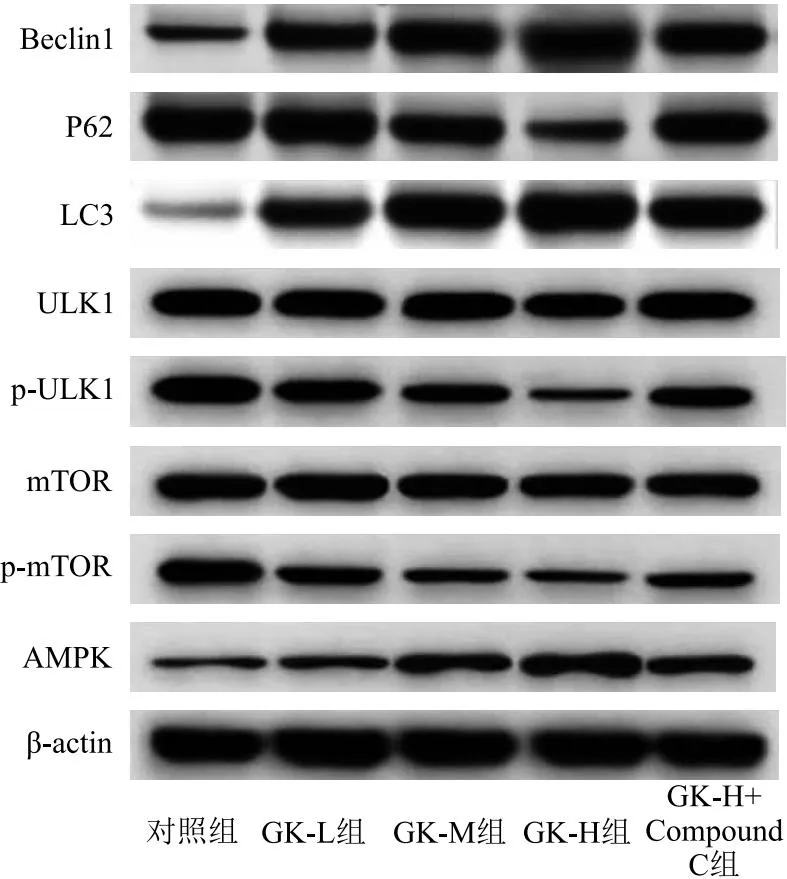
图4 AMPK、p-mTOR、mTOR、p-ULK1、ULK1、LC3、P62、Beclin1表达
表4 AMPK、p-mTOR/mTOR、p-ULK1/ULK1、LC3、P62、Beclin1比较
3 讨论
乳腺癌是女性癌症死亡的第二大原因,探索治疗乳腺癌的新方案已成为乳腺癌研究的重点[11-13]。而化疗是治疗乳腺恶性肿瘤的可靠方法,但其副作用在一定程度上缩小了化疗药物的临床应用范围[14]。研究MCF-7细胞对乳腺癌患者的预后影响较大,因此成为乳腺癌细胞系研究最多的肿瘤细胞[15]。本实验以MCF-7细胞为研究对象,探索GK对MCF-7细胞生物学影响及作用机制。
GK是一种银杏内酯和二萜内酯化合物,是银杏叶提取物的主要活性成分,具有多种药理特性包括神经保护、抗氧化应激以及炎症调节等[16-17]。如在缺血性中风研究中,GK表现出保护心脏和神经元损作的潜力[18-19]。然而GK在肿瘤方面的作用鲜有报道,但研究发现在口腔鳞状细胞癌中,GB可增强顺铂敏感性及细胞凋亡[20]。GC可通过抑制Wnt/β-catenin信号通路减少结肠癌细胞增殖并促进细胞凋亡,可作为治疗结肠癌的有效治疗药物[21]。本研究结果显示不同浓度GK可以抑制MCF-7细胞增殖、促进其凋亡,提示GK可以阻止MCF-7细胞恶性行为,但其作用机制尚不明确。
自噬性细胞死亡是癌症治疗的重要机制,其中AMPK/mTOR/ULK是一条经典自噬通路,AMPK作为自噬的中枢负调节剂,调节mTOR级联反应,共同参与癌症的进展[22]。GK通过激活AMPK/mTOR/ULK1信号通路诱导自噬,促进缺氧葡萄糖后的星形胶质细胞增殖和迁移[23-24]。此外,研究证明通过调节AMPK、mTORC和ULK1参与自噬,可促进癌细胞的发展[25]。因此推测GK可能通过AMPK/mTOR/ULK1信号通路参与自噬发挥抗癌作用。研究结果显示,经GK处理MCF-7细胞后,自噬泡数量增多,p-mTOR/mTOR、p-ULK1/ULK1表达下调,AMPK蛋白表达上调,自噬基因-LC3、Beclin1表达上调,p62表达下调,推测GK可激活AMPK/mTOR/ULK1信号通路,诱发自噬,促进癌细胞凋亡,其中以GK-H处理MCF-7细胞后,抑制其恶性行为最为显著,可能是AMPK/mTOR/ULK1信号通路可能受GK浓度的影响,GK浓度越高,AMPK/mTOR/ULK1通路中相关蛋白表达越为显著,对MCF-7细胞恶性行为影响也越大。为验证上述猜想,以AMPK抑制剂(Compound C)进行实验回复,结果发现Compound C逆转了GK对MCF-7细胞的抑制作用,提示GK可诱导乳腺癌MCF-7细胞恶性行为,可能与激活AMPK/mTOR/ULK1信号通路有关。本研究不足之处在于缺乏阳性对照及激活剂,后续将进一步完善该结论。
4 结论
综上所述,GK通过激活AMPK/mTOR/ULK1信号通路诱导乳腺癌MCF-7细胞自噬和凋亡、抑制其增殖,可能是乳腺癌治疗的潜在药物。

