基于DWI的影像组学列线图预测部分肝切除术后肝内胆管癌辅助化疗获益价值
何吉云 杨季春 杨民正
(永州市中心医院放射科,湖南 永州 425000)
近年来,肝内胆管癌(Intrahepatic cholangiocarcinoma,ICC)发病率在全球范围内呈上升趋势。根治性手术是治疗ICC最有效的方法,但术后5年存活率仅10%~30%[1-2]。其高复发率是患者预后不良的主因[3],为降低复发风险和提高生存率,临床实践指南建议术后接受辅助化疗(Adjuvant chemotherapy,AC)[4-5]。AC降低了17%复发风险,且可延长平均4个月的总生存期(Overall survial,OS)[6]。但并不是所有患者都能从术后AC中受益,部分患者可能遭受化疗毒性损害[7-8]。因此,需要寻找新的有价值的生物标志物来筛选AC受益人群。本次研究将建立基于DWI的影像组学列线图(Radiomic nomogram,RN),探讨其在筛选可能AC获益人群的潜在价值。
1 资料与方法
1.1 一般资料 选取2018年1月-2022年1月我院收治的85例接受肝部分切除术(HPx)的ICC患者,按7∶3随机分为训练集60例和验证集25例。纳入标准:①术前1月内行肝脏多参数MRI检查。②病理证实为ICC。排除标准:①术前有接受AC。②有其他恶性肿瘤史。③资料不完整。④图像质量不合格或肿瘤边界模糊难以分析。本研究得到了医院医学伦理审查委员会批准,签署知情同意书。术后辅助化疗方案共计有3种,治疗4~6个疗程不等。患者术后3个月内定期行CT、MRI或超声检查,并测定肿瘤标志物,然后每3~6个月复查。早期复发(Early recurrence,ER):术后1年内出现肿瘤复发或远处转移。ER评估主要根据临床病理资料及影像学资料。
1.2 方法
1.2.1 MRI采集参数 用3.0西门子核磁扫描仪采集。扫描序列:MR平扫、DWI和对比增强扫描。b值为0和1000 s/mm2。动态对比增强扫描:对比剂钆喷酸葡胺(江苏恒瑞医药股份有限公司生产) (0.1 mmol/kg)用高压注射剂(2.5 ml/s)静脉注射;然后快速注入30 mL生理盐水;分别于注射对比剂后20 s,70 s,240 s采集动脉期、门静脉期和延迟期图像。
1.2.2 MRI影像学特征分析 由两名经验丰富的放射科医生独立阅片。有分歧时增加第3名医师参与讨论决定。用3D Slice手动勾画DWI上的ROI,并将ROI复制到ADC图像中(b=1 000 s/mm2)。上述工作由1名放射科医师(对患者的信息不知晓)独立完成。4周后,随机选择20例患者,2名放射科医师再勾画ROI,评估观察者内和观察者者间的一致性(用组内相关系数评价)。图像预处理和特征提取使用PyRadiomics包;所有影像组学特征经ADC图像(b=1 000 s/mm2)计算。重采样为各向同性的 1×1×1 mm3[9-11]。在特征提取前行MRI信号强度归一化和灰度值离散化(设置16位带宽)。影像学特征类包括第一阶统计特征(n=18)、形态学特征(n=14)、纹理特征(n=78)。
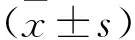
2 结果
2.1 临床基本特征 训练集和验证集的临床病理资料、MRI特征,见表1。两组的ER率、无病生存期(Disease-free survival,DFS)和OS差异无统计学意义(P>0.05)。但两组的肝脏切除范围、肿瘤边缘不规则差异有统计学意义(P<0.05)。
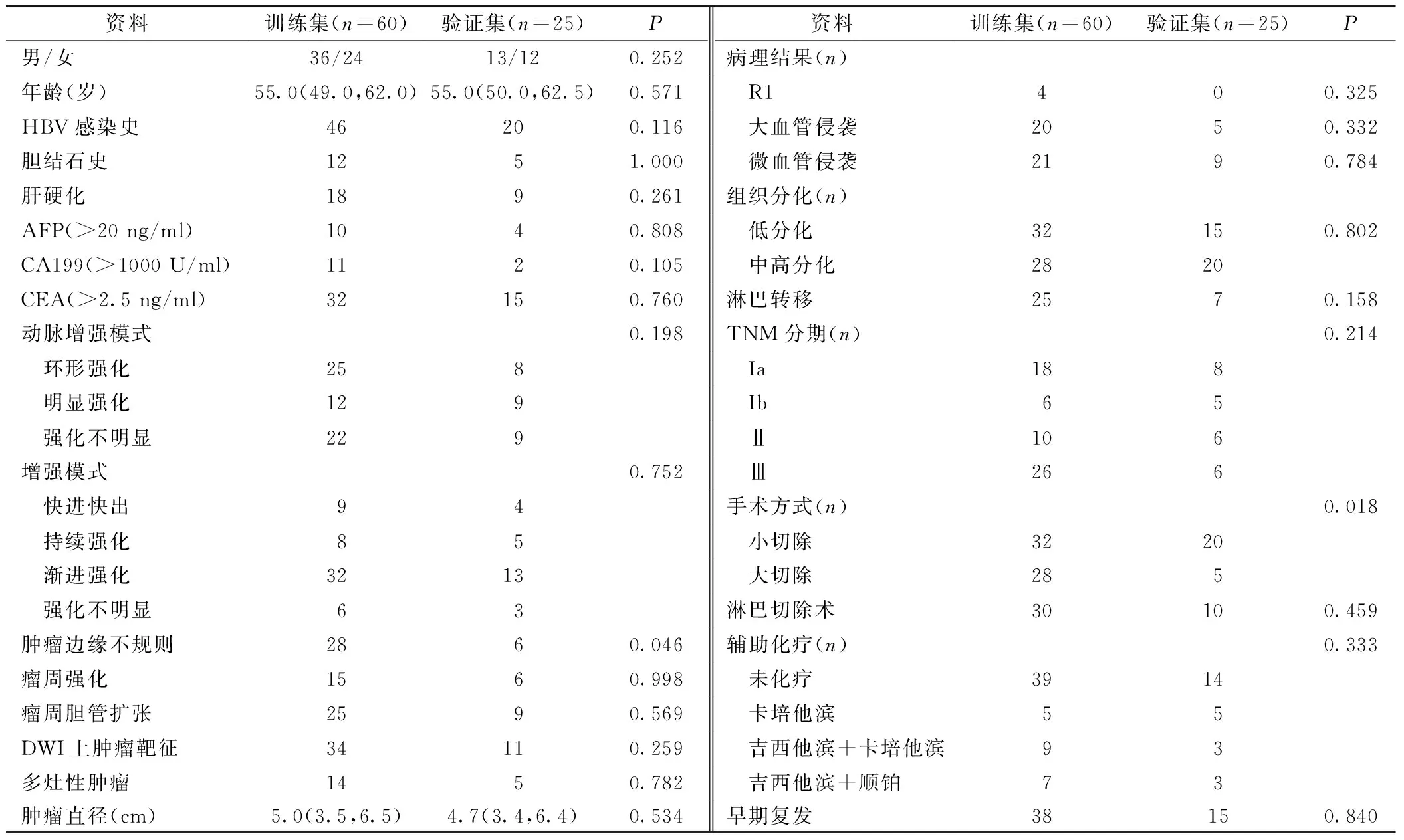
表1 两组患者一般资料比较[n,M(P25,P75)]
2.2 构建和验证预测ER的影像组学(Radio signature,RS)模型 从每个患者ADC图像中提取110个影像组学特征。利用最大相关最小冗余(mRMR)算法提取76个稳定的组学特征(观察者间及观察者内一致性分析,组内相关系数均>0.75)[12],筛选出与ER最相关的20个利用随机森林算法建立RS。训练集与验证集中,RS预测ER的AUC分别为0.830,0.762,见表2。
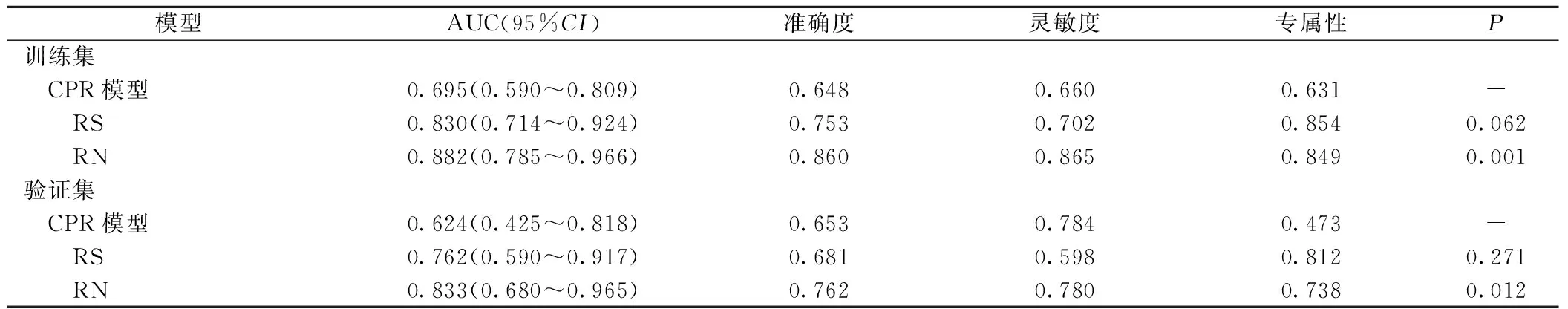
表2 不同预测模型的预测效能
2.3 构建并验证临床—病理—影像(CPR)模型和RN模型 多因素logistics回归分析显示组织分化、微血管侵袭是HPX后ICC患者ER的独立预测因素,并用上述两个因素在训练集建立CPR预测模型。AIC值为109.11,这两个临床病理-影像学危险因素建立CPR模型。通过将影像学特征与上述独立的危险因素结合构建RN,其AIC评分为82.452(图1A-C)。校准曲线表明,在训练集和验证集中,RN预测结果与实际结果基本一致(图1D-E)。Hosmer-Lemesow检验表明,两组样本均没有明显偏离拟合(P>0.05),训练集和验证集中,RS模型在预测ER显示出与CPR模型相似的辨别性能,而RN模型显示出比CPR和RS模型更高的辨别精度(均P<0.05),见表2。决策曲线显示RN模型净获益最大,见图2。
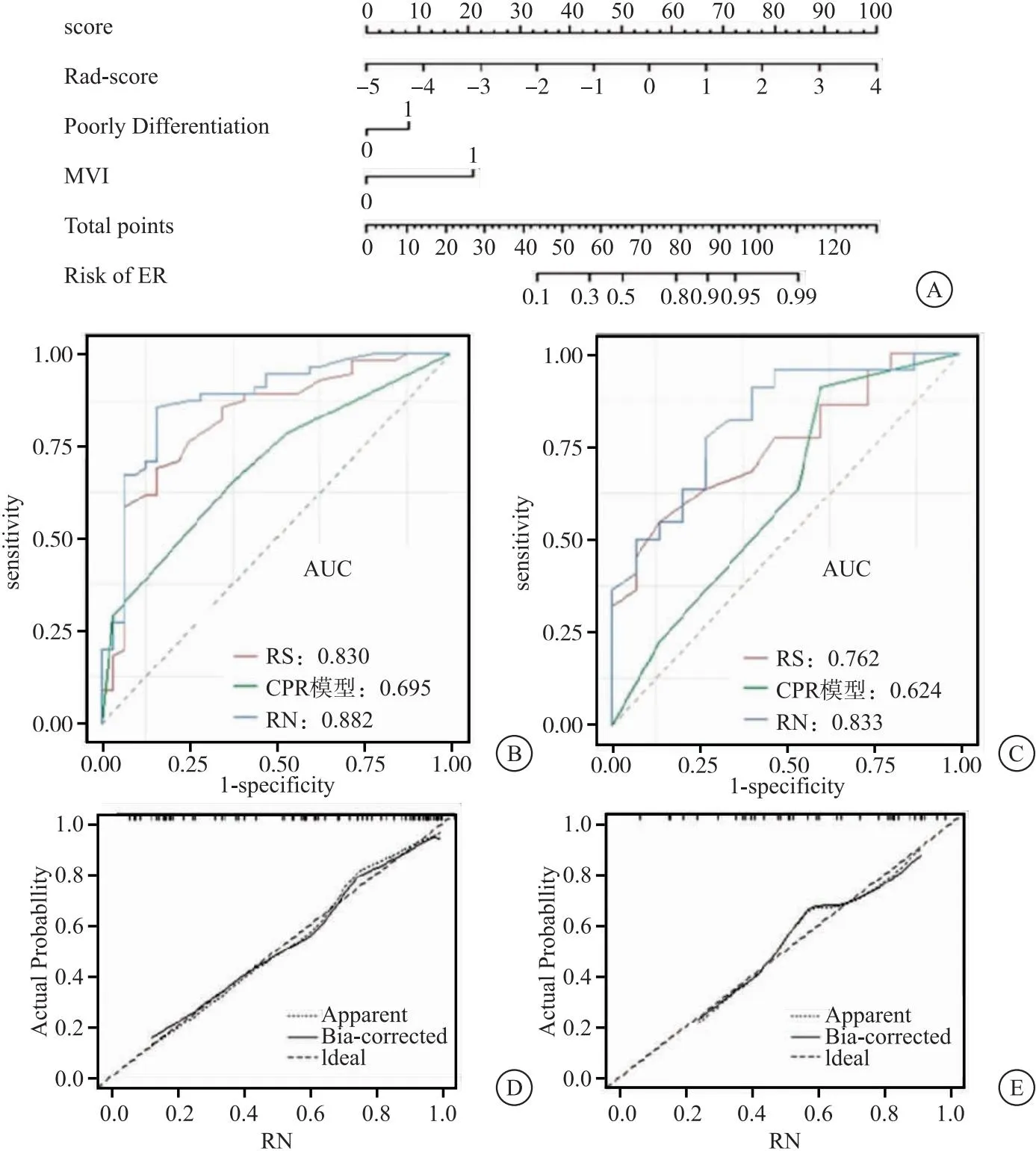
图1 列线图分析
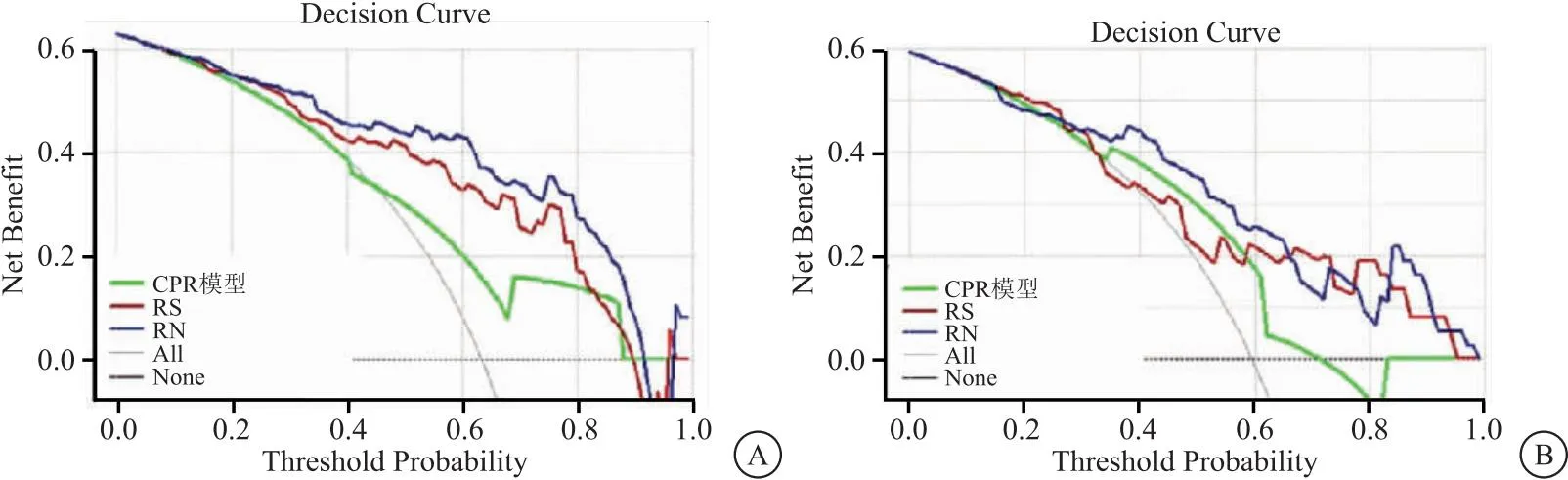
图2 CPR、RS和RN模型的决策曲线分析
2.4 RN在预后评估中的价值 基于训练集,确定RN图最佳radscore截断值为0.722。然后,将训练集中30例(50.0%)和验证集中13例(52.0%)评分≥为0.722患者归入ER的高危组,其余归入低危组。根据RN图划分的高低危组患者的DFS和OS有显著差异(P<0.05),见图3。
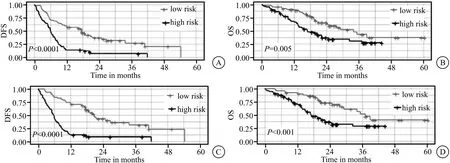
图3 Kaplan-Meier生存分析不同预测模型预测ER高、低危患者DFS和OS
2.5 AC受益 纳入的85例患者中,仅35例术后接受AC(41.2%)。术后不管有无接受AC治疗,中位DFS及OS不存在显著差异(中位OS:32.5vs21.5月,P=0.127;中位DFS:9.2vs8.1个月,P=0.722),见图4。在RS预测的ER高危组中,行手术+AC治疗患者的OS与DFS较仅接受手术治疗患者显著延长(P<0.05),而低危患者的DFS与OS则差异不显著(P>0.05)。
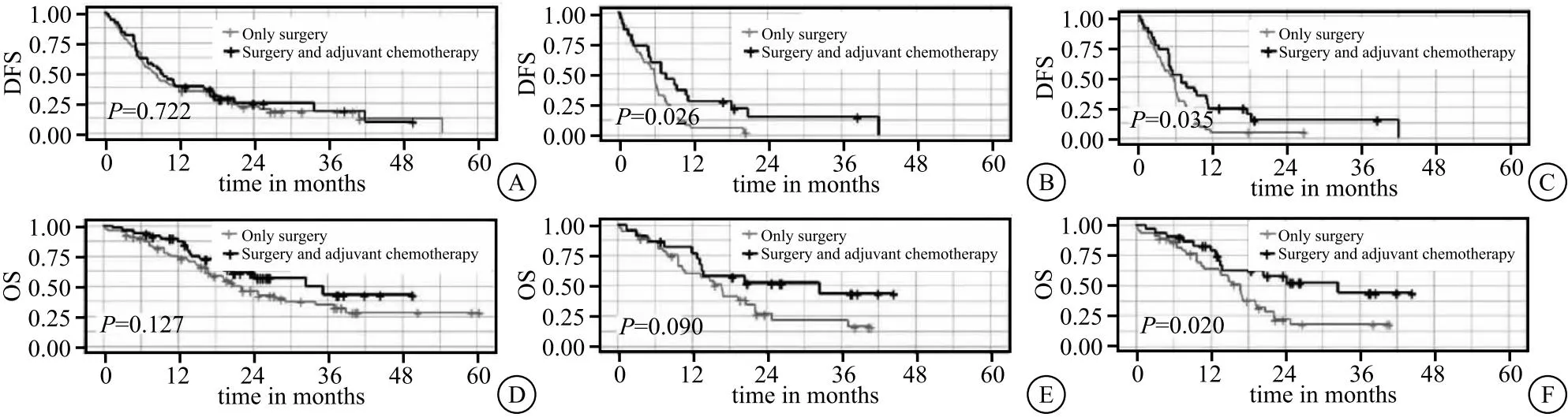
图4 Kaplan-Meier生存分析患者不同治疗方式的DFS和OS
3 讨论
ICC伴有不同程度的间质结缔组织增生[13]。有研究指出肿瘤内纤维间质丰富的ICC患者发生神经侵袭和淋巴转移风险更高,且预后更差[14]。Lee等[15]发现DWI上无扩散受限的肿瘤面积与致密纤维基质中肿瘤面积相关,肿瘤扩散受限的体积比是ICC预后的独立因素。因此,DWI可提供有关ICC肿瘤内部纤维基质构成比和分布情况的详细信息。但是,肿瘤是异质性的,纤维基质在肿瘤内分布不均[16],计算肿瘤的ADC值或不同ADC信号的体积比可提供有关纤维基质特征的信息有限。基于高通量的组学特征,RS可提供更为详细准确的肿瘤相关信息。而基于DWI的影像组学评分反映了DWI特征中提示ER的影像组学信息,在预测ICC预后方面有重要价值[17]。
美国临床肿瘤学会(ASCO)推荐ICC术后使用AC治疗[18]。然而,化疗的生存获益因人而异。ICC的生物异质性可以解释未筛选患者AC疗效不同的原因。一项Meta分析显示切缘阳性患者在AC中获益[19]。苏敬博等[20]研究显示ICC患者根治性切除术后行AC可明显延长OS和DFS,早期患者的AC获益可能更大。本次研究基于DWI构建RN,发现高危患者可从术后AC中受益,而低危患者则不能。两项研究结果有所差异的可能原因是低危患者不仅仅包括早期患者,其次,研究样本量差异较大。将临床-影像学特征和影像组学评分结合构建完整的RN在识别AC获益的人群方面应用价值更高。
本研究的局限性在于:①这是单中心的回顾性研究,验证集规模较小,需要外部验证来评估已报道结果的概括性。②很多随访时间<1年的患者被排除,可能会导致潜在的偏倚,但对本次研究结果影响不大,本次研究最终队列中患者的预后与既往类似研究的患者预后很相似[21]。③AC并不是随机分配给患者也会存在一定误差。
影像组学可提供较为全面的肿瘤异质性和表型的重要信息,基于对比增强MRI的影像组学已成功用于预测微血管侵犯程度和ICC复发[22-23]。然而,有关预测ICC患者AC获益的影像组学研究较少,扩散加权成像(Diffusion-weighted imaging,DWI)是利用水分子布朗运动反应病变内部情况,DWI和表观扩散系数(Apparent diffuasion coefficient,ADC)图可以反映细胞密度和结构变化,已被证实其在ICC生物学行为评估和预后预测方面意义重大[24-25]。
4 结论
基于DWI的RN不仅可以用于ICC患者术后的ER,还可有效筛选术后AC获益人群,也有助于ICC患者个体化治疗的选择。

