乳香散治疗绝经后骨质疏松性骨折临床研究
邬博来,王小军,马智敏,吴乐彬,卢梓皓
浙江中医药大学附属湖州中医院骨伤科,浙江 湖州 313000
骨质疏松性骨折(OPF)是骨质疏松症(OP)最主要的并发症之一,而绝经后女性因卵巢功能降低、雌激素水平下降及骨偶联过程失调等,是OP 的高发人群,绝经后骨质疏松性骨折(PMOPF)也较为高发,且呈现逐年增加趋势,已成为不可忽视的保健问题[1-2]。临床治疗PMOPF 以手术为主,虽可固定骨折,且因患者基础骨质较差,骨折的愈合能力较弱,仍面临术后骨密度(BMD)恢复慢、骨折延迟愈合甚至不愈合等问题[3]。近年研究显示,补肾壮骨类中药有助于OPF 骨折的治疗,与手术联用可促进BMD 的恢复及骨折愈合,改善临床预后,但多为自拟方或经验方,对中医经验的开发及理解程度不足[4-5]。乳香散是治疗损伤扑跌、筋骨寸断之症的经典方剂,有活血化瘀、补肾健骨等功效,但目前常用于抗痛风及关节炎,研究发现其可通过抗炎等缓解关节疼痛,促进症状消退及功能康复[6]。骨代谢在OP、OPF发生及骨折愈合中均具有重要作用,有研究显示健骨补肾、补肾活血类中药方剂可调节骨折大鼠的骨代谢指标、提高骨密度,改善骨生物力学性能[7]。姚颖等[8]研究显示,骨代谢生化指标异常与PMOPF 的发生具有密切相关性,主要表现为骨碱性磷酸酶(BALP)、Ⅰ型前胶原氨基端前肽(PⅠNP)、Ⅰ型胶原羧基端交联肽(CTX-Ⅰ)等异常表达。本研究对PMOPF 患者采用乳香散治疗,观察BMD 及骨代谢指标值的变化,旨在探究其对PMOPF 的疗效及可能作用机制,报道如下。
1 临床资料
1.1 诊断标准符合《原发性骨质疏松症基层诊疗指南(实践版·2019)》[9]、《骨质疏松性骨折诊疗指南(2022 年版)》[10]中OP 及OPF 的诊断标准,经BMD 测定、影像学检查(X 线、CT、MRI 等)确诊。
1.2 辨证标准参照《骨质疏松性骨折中医诊疗指南》[11]拟定肾虚血瘀证辨证标准。主症:伤肢疼痛,痛有定处,痛处拒按,活动时加重;腰脊刺痛或周身疼痛,腰膝酸软,筋肉挛缩;次症:发脱齿摇,头晕,耳鸣耳聋,健忘,动作迟缓;舌脉:舌质淡紫,有瘀点或瘀斑,脉细涩或弦。
1.3 纳入标准符合上述诊断及辨证标准;年龄50~70 岁,自然绝经≥2 年;术前6 个月内未服用其他影响骨代谢的药物;自愿参与本研究并签署知情同意书。
1.4 排除标准各种药物因素(糖皮质激素等)、内分泌疾病所致继发性OP;合并多发性骨髓瘤、骨性关节炎;多发性骨折、陈旧性骨折;合并严重脏器功能障碍(心、肝、脑、肺、肾等)、血液系统疾病、免疫系统疾病、血液系统疾病;合并精神疾病、沟通交流障碍;已知对本研究用药或对主要成分过敏、过敏性体质。
1.5 一般资料选取2020 年3 月—2022 年3 月浙江中医药大学附属湖州中医院收治的118 例PMOPF患者,按随机数字表法分为研究组及对照组各59 例。研究组年龄50~70 岁,平均(62.85±3.69)岁;体质量指数(BMI)18.2~28.5,平均23.85±2.36;绝经年限3~23 年,平均(7.12±2.35)年;骨质疏松病程1~7 年,平均(3.81±0.54)年;骨折部位:椎体骨折25 例,桡骨骨折17 例,胫骨骨折14 例,其他3 例。对照组年龄50~70 岁,平均(62.39±3.41)岁;BMI 18.5~28.5,平均23.69±2.17;绝经年限5~21 年,平均(7.03±2.19)年;骨质疏松病程1~7 年,平均(3.64±0.51)年;骨折部位:椎体骨折27 例,桡骨骨折15 例,胫骨骨折15 例,其他2 例。2 组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
2 治疗方法
2 组均接受内固定手术治疗,均顺利完成手术,术后接受常规抗感染、早期康复锻炼、预防深静脉血栓等治疗。
2.1 对照组术后给予骨化三醇胶丸(上海罗氏制药有限公司,国药准字J20150011,规格:0.25 μg)口服,每次0.25 μg,每天2 次;碳酸钙D3咀嚼片(惠氏制药有限公司,国药准字H10950029,规格:600 mg)嚼服,每次2 片,每天2 次,连续服用3 个月。
2.2 研究组在对照组基础上加用乳香散方剂内服,处方:何首乌35 g,桔梗25 g,乳香、没药各12 g,骨碎补(先煎)、木鳖(先煎)各15 g,当归、川乌、草乌、赤芍、川芎各10 g。每天1 剂,水煎至400 mL,分为2~3 次温服,疗程3 个月。
3 观察指标与统计学方法
3.1 观察指标①恢复情况评估。观察并记录2 组术后住院时间、首次负重时间、骨折愈合时间。②疼痛程度评分。于治疗前及治疗后7 d、1 个月,采用疼痛视觉模拟评分法(VAS)评价疼痛程度,总分分值0~10 分,得分越高表示疼痛越强烈。③骨代谢指标。于治疗前及治疗3 个月后,采集空腹静脉血检测血清骨保护素(OPG)、骨钙素(BGP)、BALP、PⅠNP、骨形态发生蛋白(BMP-2)、CTX-Ⅰ、抗酒石酸酸性磷酸酶(TRACP)。④BMD 测定。于治疗前及治疗后3 个月,采用双能X 射线骨密度仪检测腰椎L1~4、全髋及股骨颈的BMD。⑤并发症情况。统计2 组切口感染、骨折延迟愈合或不愈合、静脉血栓形成等并发症发生情况。随访12 个月,统计再骨折或新发骨折发生情况。
3.2 统计学方法应用SPSS23.0 统计学软件进行数据分析。计量资料以均数±标准差(±s)表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验;计数资料以百分比(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
4 治疗结果
4.1 2 组恢复情况比较见表1。研究组住院时间、首次负重时间、骨折愈合时间均短于对照组,首次负重时间、骨折愈合时间与对照组比较,差异有统计学意义(P<0.05)。
表1 2 组恢复情况比较(±s)
组 别研究组对照组t 值P 值例数59 59住院时间(d)9.86±2.15 10.41±2.59 1.255 0.212首次负重时间(d)15.51±2.32 16.74±2.79 2.604 0.010骨折愈合时间(周)11.03±1.15 12.27±1.58 4.874<0.001
4.2 2 组治疗前后VAS 评分比较见表2。治疗前,2 组VAS 评分比较,差异无统计学意义(P>0.05)。治疗7 d、治疗1 个月、治疗3 个月,2 组VAS 评分均较治疗前下降(P<0.05),研究组各时间段VAS 评分均低于对照组(P<0.05)。
表2 2 组治疗前后VAS 评分比较(±s)分
注:①与本组治疗前比较,P<0.05
治疗3 个月1.01±0.35①1.77±0.42①10.678<0.001组 别研究组对照组t 值P 值例数59 59治疗前6.73±1.69 6.42±1.52 1.047 0.297治疗7 d 4.01±0.79①4.75±0.92①4.687<0.001治疗1 个月2.21±0.57①2.82±0.79①4.810<0.001
4.3 2 组治疗前后骨代谢指标比较见表3。治疗前,2 组骨代谢各指标值比较,差异无统计学意义(P>0.05)。治疗3 个月后,2 组OPG、BGP、BALP、PⅠNP、BMP-2 骨代谢指标值均较治疗前上升(P<0.05),CTX-Ⅰ、TRACP 指标值均较治疗前下降(P<0.05);研究组OPG、BGP、BALP、PⅠNP、BMP-2 指标值均高于对照组(P<0.05),CTX-Ⅰ、TRACP 指标值均低于对照组(P<0.05)。
表3 2 组治疗前后骨代谢指标比较(±s)

表3 2 组治疗前后骨代谢指标比较(±s)
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
TRACP(U/L)5.52±1.16 4.03±0.97①②5.45±1.08 4.59±1.02①组 别研究组对照组时 间治疗前治疗3 个月治疗前治疗3 个月例数59 59 59 59 OPG(μg/L)1.13±0.32 2.34±0.57①②1.16±0.35 1.82±0.43①BGP(μg/L)5.02±1.13 8.25±1.56①②5.14±1.33 7.12±1.46①BALP(U/L)36.48±12.59 41.03±13.05①②37.27±11.34 39.65±12.61①PⅠNP(g/L)44.58±5.69 55.62±6.43①②46.01±5.74 50.26±6.17①BMP-2(μg/L)1.59±0.33 3.24±0.56①②1.61±0.37 2.48±0.49①CTX-Ⅰ(μg/L)0.59±0.16 0.35±0.12①②0.57±0.15 0.42±0.13①
表5 2 组治疗前后BMD 指标比较(±s)g/cm2
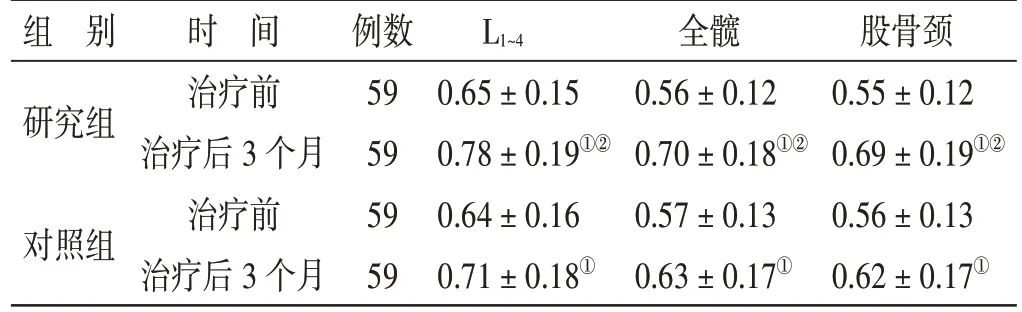
表5 2 组治疗前后BMD 指标比较(±s)g/cm2
注:①与本组治疗前比较,P<0.05;②与对照组治疗后比较,P<0.05
股骨颈0.55±0.12 0.69±0.19①②0.56±0.13 0.62±0.17①组 别研究组L1~4对照组时 间治疗前治疗后3 个月治疗前治疗后3 个月例数59 59 59 59 0.65±0.15 0.78±0.19①②0.64±0.16 0.71±0.18①全髋0.56±0.12 0.70±0.18①②0.57±0.13 0.63±0.17①
4.4 2 组治疗前后BMD 指标比较见表4。治疗前,2 组各部位BMD 指标值比较,差异无统计学意义(P>0.05)。治疗后3 个月,2 组L1~4、全髋、股骨颈BMD 指标值均较治疗前上升(P<0.05),研究组上述3 项BMD 指标值均大于对照组(P<0.05)。
4.5 2 组不良反应及再骨折情况比较用药期间,2 组均未出现肝肾功能损伤及心电图异常,对照组2 例胃肠道不适(3.39%),研究组1 例恶心呕吐(1.69%),2 组不良反应发生率比较,差异无统计学意义(χ2=0.099,P=0.753)。研究组与对照组分别有58 例、55 例完成12 个月随访,随访期间,研究组1 例(1.72%)再骨折,对照组4 例(7.27%)再骨折,研究组的再骨折发生率低于对照组,差异无统计学意义(χ2=2.411,P=0.121)。
5 讨论
女性进入绝经期后由于下丘脑-垂体-性腺轴功能减退,卵巢功能减低,机体分泌的雌激素呈波动性减少,雌激素相关受体对骨骼肌细胞代谢功能的调节作用减弱,成骨细胞活性降低而破骨细胞活性增强,容易发生OP,骨折发生风险升高[12]。外科手术虽可固定骨折,但由于PMOPF 患者年龄稍长,机体恢复能力较弱,加之本身骨质较差,极易发生并发症或再发骨折[13]。临床推荐配合抗OP 药物治疗,以降低骨转换并增加BMD,预防再次骨折的发生。
OP 归属于中医骨枯、骨痿、骨痹等范畴,主要病机为肾精亏虚。《素问》曰“肾藏精,主骨生髓,其冲在骨”,肾精充盈则骨髓生化有源,筋骨得养,气血条畅[14]。妇女年迈,天癸衰竭,肾气衰退,肾精不足,骨髓生化乏源,无以濡养骨骼,则易发为骨枯、骨痿[15]。因此,对PMOPF 的治疗当以滋补肝肾、强筋壮骨、活血通络之法为主。乳香散出自《仙授理伤续断秘方》,专治损伤仆跌、皮肉破绽及筋骨寸断之症。方中乳香具有活血行气、消肿止痛之功;没药活血祛瘀、理气止疼、消肿生肌,与乳香配伍可增强活血破瘀之力,为君药。何首乌可补益精血,骨碎补有补肾健骨、活血止痛、降火滋阴之功;当归活血通络、养血补血,并可调理冲任;以上可助君药补肾壮骨、活血祛瘀止痛,为臣药。川乌与草乌可祛风除湿、温经散瘀、消肿止痛;赤芍、川芎行气活血、通经活络、祛瘀止痛;桔梗化瘀排脓,并可载药上行;木鳖散结消肿、攻毒疗疮、温经散寒;以上共为佐药。诸药配伍,共奏补肾健骨、舒经活络、行气止痛、接骨生新之功。药理学研究表明,乳香-没药药对具有抗炎、抗肿瘤、镇痛、调节机体免疫等作用,这对骨折愈合及疼痛缓解均具有积极作用[16];何首乌的活性成分被证实具有抗衰老、抗氧化、抗炎、提高免疫力、保护肝肾及抗骨质疏松等作用[17];骨碎补的活性成分黄酮类、酚酸类、三萜类等具有抗炎镇痛、改善微循环、促进增殖分化、促进骨损伤修复、促进骨折愈合、保护关键软骨以及抗骨质疏松等多重作用,并可抑制软骨退变、促进软骨细胞的分化而抑制软骨基质的降解,保护骨组织及关节功能,是骨科疾病治疗常用中药[18];当归、赤芍、川芎是治疗骨折尤其是下肢骨折的中药复方中常用药物,有抗炎、抗氧化、抗血小板聚集、增强机体免疫、调节血管新生等多样药理作用,有利于促进骨折愈合[19];川乌-草乌药对也是治疗跌打损伤、关节疾病的经典药对,可从多靶点调节脂质代谢、抗炎镇痛、抗氧化等而发挥作用[20-21];桔梗、木鳖也有调节抗氧化、抗炎、免疫调节等多重作用,有利于骨折愈合[22-23]。
本研究结果显示,研究组的首次负重时间及骨折愈合时间均相比于对照组明显缩短,且治疗7 d、1 个月及3 个月时的VAS 评分均降幅更显著,提示乳香散方能够促进PMOPF 患者的骨折愈合,并可缓解术后疼痛程度,这也是骨折治疗的主要目标之一。骨折愈合是一个高度协调的、复杂的过程,骨代谢在该过程中具有关键性作用,主要由破骨细胞主导的骨吸收、成骨细胞主导的骨形成与软骨细胞主导的骨重塑参与[24]。骨转换标志物是骨代谢产物,故检测血清骨转换标志物水平有利于评估骨折愈合情况及骨折愈合过程中的骨代谢稳态。合并OP 的骨折主要表现为破骨细胞过度活跃及成骨细胞活力相对受抑,即骨吸收活动度超过骨形成活动度,此时不仅影响骨折断端愈合,也影响抗OP 治疗[25]。本研究结果显示,治疗后成骨代谢相关指标(OPG、BGP、BALP、BMP-2、PⅠNP)均得以提升,而破骨代谢相关标志物(CTX-Ⅰ、TRACP)的表达水平均得以明显降低,且研究组以上指标的改善幅度均优于对照组。其中,OPG 可负性调节破骨细胞,抑制其分化,并可诱导成熟破骨细胞的凋亡,以维持正常骨代谢;BGP 能够抑制软骨矿化及异常羟磷灰石结晶,其合成不足多提示骨细胞活性降低及细胞合成活动减弱[26-27]。BALP 可促进骨基质的矿化,可反应骨细胞的数量及活性[28]。BMP-2 可抑制炎症因子表达,促进骨细胞中胶原蛋白形成等,促进骨折愈合并改善成骨能力[29]。PⅠNP 能够反映成骨细胞的活性,也可反映Ⅰ型胶原蛋白的合成情况,是骨形成的敏感、特异性标志物[30]。CTX-Ⅰ和TRACP 主要反映破骨细胞的活性,也是评价骨吸收状态的特异性标志物[31]。由此推测,乳香散方可能通过提高成骨细胞活性并抑制破骨细胞活性等而调节骨代谢水平,从而促进骨折愈合。
本研究治疗后3 个月检测主要部位的BMD 显示,研究组L1~4、全髋及股骨颈的BMD 提升率均明显高于同期对照组。鞠洋等[32]研究也显示,补肾活血类中药方剂用于PMOPF 的治疗能够促进骨形成指标的表达并抑制骨吸收指标的表达,提升患者的BMD,并缓解疼痛度。提示乳香散方用于PMOPF 的治疗能够通过调节抑制破骨细胞活性,降低骨吸收,并刺激成骨细胞活性,促进骨形成,从而提高BMD,这对骨折愈合及再骨折的预防均有积极意义。但随访1 年,研究组的再骨折发生率虽较对照组有所降低,但差异并不显著。翟炳生[33]随访结果显示,补肾温阳、固疏健骨中药汤剂能够显著降低PMOPF 患者的再骨折发生率,可能与样本量小、随访时间短有关。
综上,乳香散方治疗PMOPF 能够促进骨折愈合,其机制可能与调节骨代谢、提高BMD 有关。但因本研究样本选择有限且样本量较小,加之随访时间较短,研究结果可能存在一定的偏倚,今后还需进一步深入研究其远期效果及详细作用机制。

