成胶质细胞瘤U87干细胞样细胞的培养及其代谢表型与成瘤能力鉴定
仇佳星,刘宇涵,郭泓江,张迪雅,王钰铖,鞠 瑞,郭 磊
中国医学科学院基础医学研究所 北京协和医学院基础学院 药理学系,北京 100005
成胶质细胞瘤(glioblastoma)是所有原发性恶性中枢神经系统肿瘤中常见的一种,具有高度的侵袭性和治疗抵抗性,其5年生存率低于6.9%,中位生存期小于15个月[1]。成胶质细胞瘤患者预后不良的主要原因包括肿瘤内和肿瘤间细胞高度的异质性、肿瘤细胞的高侵袭和转移能力以及术后极高的复发率,而这些特征也都可以通过肿瘤干细胞的假说进行合理的解释,即肿瘤细胞的成瘤能力具有异质性,存在干细胞样细胞(stem-like cells,SLCs)的亚群[2]。成胶质细胞瘤干细胞样细胞(glioblastoma stem-like cells,GSCs)被认为能够自我更新、增殖并且分化成其他肿瘤细胞类型,具有很强的可塑性以及对于放化疗的抵抗性[3]。由于其在肿瘤发生发展过程中可能发挥重要作用,对于GSCs的研究有助于开发更加有效的治疗策略。
成胶质细胞瘤干细胞样细胞研究的一个经典建模方法为神经球培养法(neuro-sphere formation assay),主要基于GSCs自我更新能力强,能够在化学成分确定的无血清培养基中成球增殖,而分化程度较高的细胞在这样的环境下不能自我更新,比例将逐渐降低[4-6]。此外,GSCs也可以通过在培养表面包被层黏连蛋白(laminin)或Matrigel基质胶实现贴壁培养,让细胞均匀地暴露在营养物质、氧气、生长因子等GSCs增殖的关键因素之下,并且黏附的细胞比漂浮的球体也更适合于高通量测定和筛选的研究[7]。
然而,当前各个实验室均使用了自己的培养方法来富集SLCs,包括了不同种类的培养基和添加剂[8]。这可能会导致实验室之间的结果存在差异,可能是肿瘤干细胞理论受到质疑的原因之一[9-10]。因此,标准化SLCs的培养方法是必要的,以避免培养基成分引起的结果的偏差,促进不同实验室结果的比较和交流。本研究提供了使用无血清干细胞培养基以及添加Matrigel基质胶包被的方式培养悬浮的和贴壁的成胶质细胞瘤U87干细胞样细胞(U87 SLCs)的方法,并对两种培养物的干性相关标志物的表达、代谢能力的改变和体内成瘤能力的变化进行了验证。
1 材料与方法
1.1 材料
1.1.1 细胞系:人脑星形成胶质细胞瘤细胞系U87(国家生物医学实验细胞资源库/中国医学科学院基础医学研究所细胞资源中心)。
1.1.2 实验动物:6周龄雄性SPF级BALB/c-nude小鼠(北京华阜康生物科技股份有限公司)。
1.1.3 试剂:DMEM(高糖)培养基、DMEM/F-12培养基、PBS(中国医学科学院基础医学研究所细胞资源中心);胎牛血清、B-27添加剂、Accutase细胞消化液、BCA蛋白质浓度测定试剂盒、Hepes-Tris 4%~12%高分辨率预制胶、脱脂奶粉(翌圣生物科技股份有限公司);人EGF、bFGF蛋白(北京义翘神州科技股份有限公司);Matrigel基质胶(Corning公司);AG RNAex Pro RNA提取试剂、Evo M-MLV反转录试剂预混液、SYBR Green Pro Taq HS预混型qPCR试剂盒(湖南艾科瑞生物工程有限公司);RIPA裂解液、PMSF(北京索莱宝科技有限公司);β-actin抗体(Cell Signaling Technology);CD133、Nestin抗体(Proteintech公司);PE anti-human CD133抗体(BioLegend公司);细胞线粒体压力测试试剂盒(Agilent公司)
1.2 方法
1.2.1 U87 SLCs的悬浮培养:向DMEM/F-12基础培养基中添加B-27、20 ng/mL EGF和20 ng/mL bFGF配成干细胞培养基。收集常规含血清DMEM培养基中的U87细胞,PBS洗细胞2遍后,以浓度1×104/mL细胞接种至干细胞培养基中。使用低黏附的培养表面,每2~3 d半数换液。
1.2.2 U87 SLCs的贴壁培养:用DMEM培养基稀释Matrigel至不同的浓度,以50 μL/cm2的用量覆盖培养表面,于37 ℃培养箱中孵育1 h以充分包被。用PBS清洗培养表面2次,再按浓度1×104/mL接种U87细胞。使用干细胞培养基,每2~3 d换液。
1.2.3 RT-qPCR检测mRNA表达:贴壁细胞弃去培养基、悬浮细胞离心收集沉淀后,加入AG RNAex Pro RNA提取试剂裂解细胞,再加入氯仿离心后收集含有总RNA的上清层,经异丙醇沉淀便可以回收得到细胞的总RNA。总RNA定量后使用Evo M-MLV反转录试剂预混液进行cDNA合成,直接混合RNA模板、预混液和水进行反应。利用SYBR Green Pro Taq HS预混型qPCR试剂盒进行最终的PCR反应,混合待测基因的引物对、cDNA、预混试剂和水并按照试剂盒说明书内的温度程序进行反应。采用2-ΔΔCt法计算目标基因的表达水平,内参基因选择β-actin,引物序列如下(表1)。

表1 实时荧光定量PCR的引物序列Table 1 Sequence of primers for RT-qPCR
1.2.4 Western blot检测蛋白质水平:使用含PMSF的RIPA试剂裂解细胞提取蛋白质,以BCA法测定蛋白质浓度。添加上样缓冲液并加热10 min制备电泳样品,每孔加30 μg蛋白样品进行SDS-PAGE分离。分离后的蛋白质样品湿式转印至PVDF膜,再使用5 %脱脂奶粉封闭1 h。一抗1∶1 000稀释,过夜孵育;二抗1∶5 000稀释,室温孵育1 h;洗涤液为TBST。最终膜在暗室内进行化学发光检测。内参蛋白选择β-actin。
1.2.5 流式细胞测量术检测CD133+细胞比例:U87细胞或U87 SLCs用Accutase溶液消化为单细胞悬液,PBS洗细胞2遍后,将1×106的细胞重悬于100 μL PBS,再加入5 μL PE anti-human CD133抗体,于4 ℃避光孵育15 min。用流式细胞仪检测CD133+细胞的比例,同时设置一个未染抗体的阴性对照。
1.2.6 Seahorse实时细胞代谢分析:将Matrigel 10倍稀释后包被Seahorse细胞培养板,每孔接种8×104个U87细胞或U87 SLCs。检测所用的呼吸作用调节剂的浓度为1.5 μmol/L寡霉素(oligomycin)、0.125 μmol/L羰基氰-4(三氟甲氧基)苯腙[carbonyl cyanide-4(trifluoromethoxy)phenylhydrazone,FCCP]、0.5 μmol/L鱼藤酮/抗霉素A(rotenone/antimycin A,Rot/AA)。检测完成后,使用含PMSF的RIPA试剂提取每孔蛋白质,BCA法进行蛋白质定量,用蛋白质总量标化各孔的耗氧速率(oxygen consump-tion rate, OCR)。
1.2.7 裸鼠皮下移植瘤模型:U87细胞或悬浮培养的U87 SLCs用Accutase溶液消化为单细胞悬液,PBS洗细胞2遍后,调整密度重悬于PBS,皮下注射至裸鼠右侧背部。U87细胞每只鼠注射1.5×106个,U87 SLCs每只鼠注射3×105个。40 d后,测量皮下肿瘤的长径和短径,并拍照记录。肿瘤体积计算公式为“体积=1/2×长径×短径2”。
1.3 统计学分析
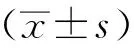
2 结果
2.1 悬浮培养的U87 SLCs的形态
使用干细胞培养基培养U87细胞5 d后,细胞呈现典型的细胞球形态(图1A)。细胞球大小不一,包括部分增殖慢、尚未成球的单个细胞。继续培养至15 d时,细胞球的体积明显增大(图1B)。较大的细胞球透光度降低,指示其中细胞更加致密。
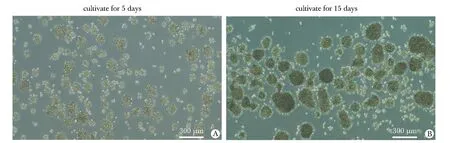
图1 U87干细胞样细胞球的形态Fig 1 Morphology of U87 stem-like cell spheres
2.2 悬浮培养的U87 SLCs的干性标志物的鉴定
培养1周之后,干性标志物CD133、nestin和OLIG2的基因转录水平在悬浮培养的U87 SLCs中大幅升高,与U87细胞相比有极显著的差异(P<0.001),而干性标志物CD44、FUT4/CD15和ITGA6的基因转录水平也有一定的提升(图2A)。主要干性标志物CD133和nestin的蛋白质水平在悬浮培养的U87 SLCs中也表现出升高趋势(图2B)。培养1个月之后,CD133+细胞的比例从培养前的2.75 %升高至84.6 %(图2C)。

A.mRNA levels of stemness markers; B.protein levels and quantitative results of stemness markers; C.proportion of CD133 positive cells; *P<0.05, **P<0.01, ***P<0.001 compared with U87.图2 U87干细胞样细胞球具有更高的干性标志物的mRNA和蛋白质水平Fig 2 U87 stem-like cell spheres showed higher mRNA and protein levels of stemness markers n=4)
2.3 贴壁培养的U87 SLCs的形态
使用未稀释的Matrigel包被培养表面后,诱导贴壁培养的U87 SLCs具有结团增殖的趋势,团块间细胞胞体拉长建立起网络状的连接(图3A)。若以10倍稀释的Matrigel包被,则U87 SLCs会均匀地平铺贴壁增殖(图3B)。包被培养表面的Matrigel浓度稀释2倍及以上,所培养的U87 SLCs均为平铺贴壁形态,且经验证的Matrigel发挥诱导贴壁作用的稀释倍数最高为100倍(结果未展示)。

A.coated with undiluted Matrigel; B.coated with 10-fold diluted Matrigel.图3 贴壁生长的U87干细胞样细胞Fig 3 Adherent culture of U87 stem-like cells
2.4 贴壁培养的U87 SLCs的干性标志物的鉴定
使用10倍稀释的Matrigel包被培养表面,主要干性标志物CD133和nestin的基因转录水平在贴壁的U87 SLCs中与U87相比大幅升高(P<0.001),干性标志物OLIG2、CD44、FUT4/CD15和ITGA6的转录水平也显著提升(OLIG2和CD44:P<0.001;FUT4/CD15和ITGA6:P<0.01)(图4A)。贴壁培养的U87 SLCs的主要干性标志物的蛋白质水平与悬浮培养表现出相似的升高趋势(图4B)。

A.mRNA levels of stemness markers; B.protein levels and quantitative results of stemness markers; *P<0.05, **P<0.01, ***P<0.001 compared with U87.图4 贴壁的U87干细胞样细胞具有更高的干性标志物的mRNA和蛋白质水平Fig 4 Adherent U87 stem-like cells showed higher mRNA and protein levels of stemness markers n=4)
2.5 U87 SLCs具有更高的线粒体呼吸水平
与U87细胞相比,U87 SLCs在加入解偶联剂FCCP后,诱导出更高的最大呼吸速率(maximal respiration rate),表明其更强的线粒体储备呼吸能力(spare respiratory capacity),即U87 SLCs对增加的能量需求或压力具有更强的反应能力(图5)。
*P<0.05 compared with U87.图5 U87干细胞样细胞具有更高的耗氧速率Fig 5 U87 stem-like cells showed higher oxygen
2.6 U87 SLCs具有更强的体内成瘤能力
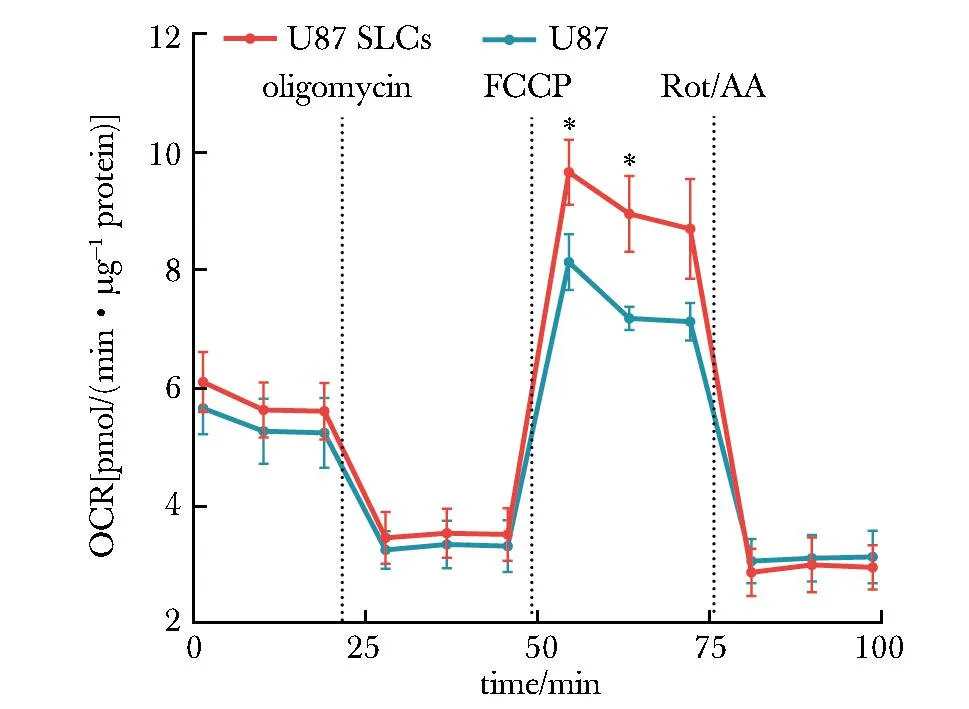
U87 SLCs接种动物体内40 d后,形成的肿瘤体积更大(图6)。U87形成的肿瘤体积均值为667 mm3(n=6),U87 SLCs形成的肿瘤体积均值为1 246 mm3(n=6),为U87的1.87倍(P<0.05)。由于U87 SLCs的初始接种数目为U87的1/5,则U87 SLCs的成瘤能力近似估计为U87的9.34倍。
Representative 2 images from 6 samples, U87 SLCs on the left and U87 on the right (scale bar: 1 cm).图6 U87细胞和U87干细胞样细胞的皮下移植瘤Fig 6 Subcutaneous tumor of U87 cells and U87 stem-like cells
3 讨论
越来越多的研究证实成胶质细胞瘤中存在一种具有干细胞特征的亚群,其处于缓慢分裂的状态,能够产生一些增殖更快的祖细胞群以及非增殖的细胞,并能够响应放化疗的干预以及手术切除。然而,当前并没有办法分离或定义能够绝对代表肿瘤干细胞的细胞图谱,多数研究试图通过鉴定可靠的标志物来分离或富集成胶质细胞瘤干细胞样细胞。CD133被认为是多种正常组织和肿瘤类型中干细胞的标志物,广泛用于分选具有干性特征的细胞群。Nestin是一种Ⅵ类中间丝蛋白,最初在发育过程中的神经干细胞中检测到,现已被证明在多种恶性肿瘤中与其他干性标志物共表达[11]。CD133和nestin也成为鉴定GSCs最主要的两个标志物。此外,CD44、CD15、整合素α6(integrin α6,ITGA6)以及少突胶质细胞谱系的主转录因子OLIG2等被报道在某些情况下可以用于富集肿瘤起始细胞,因此也可作为肿瘤细胞干性高低的一个检验标志[12]。
成胶质细胞瘤如同大多数肿瘤一样,被描述为主要依赖糖酵解代谢,然而GSCs却对线粒体氧化代谢更具偏好。GSCs通常比分化的肿瘤细胞糖酵解程度更低,但具有更高的线粒体储备呼吸能力,同时保持更高的ATP水平[13]。这也对应了其更高的抗氧化应激的能力,与放化疗的耐受密切相关。Seahorse实时细胞代谢分析是检测细胞生物能量代谢的金标准,是一种基于培养板的检测,需要细胞处于贴壁状态,因此实现GSCs贴壁对于某些应用是必要的。与层黏连蛋白10倍稀释后作为贴壁剂相比,Matrigel提供了成分更加丰富的胞外基质和生长因子,并且在多种稀释倍数下均能起诱导贴壁的作用。神经球培养法中细胞所形成的球体结构会带来物理和几何上的限制,阻止营养物质、生长因子等向内扩散,并且也缺乏体内微环境中基质细胞和分化的肿瘤细胞带来的黏附和支持作用,因此神经球培养能否作为GSCs培养的最适宜的条件,也值得反思和改进[14]。
肿瘤干细胞的定义应基于一系列实际的细胞功能的标准,即自我更新的能力、连续移植时肿瘤起始的能力以及复现肿瘤内部异质性的能力[2]。因此,体内成瘤能力是肿瘤细胞干性特征的核心标准之一,干细胞样细胞与分化细胞的主要差别即在于前者应具有更强的成瘤能力,在理想情况下,能够单个细胞连续移植并成瘤。有效GSCs的富集,应该做到降低体内成瘤所需的最低接种细胞数,提升同等接种细胞数的肿瘤生长速率和体积。
综上所述,本研究培养两种形态的GSCs,鉴定了与干性相关的细胞功能。作为具有更高干性的肿瘤细胞模型,U87 GSCs可用于后续肿瘤发生发展机理和药物作用的研究。

